- 2021-07-08 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省承德市第一中学高一上学期第三次月考化学试题
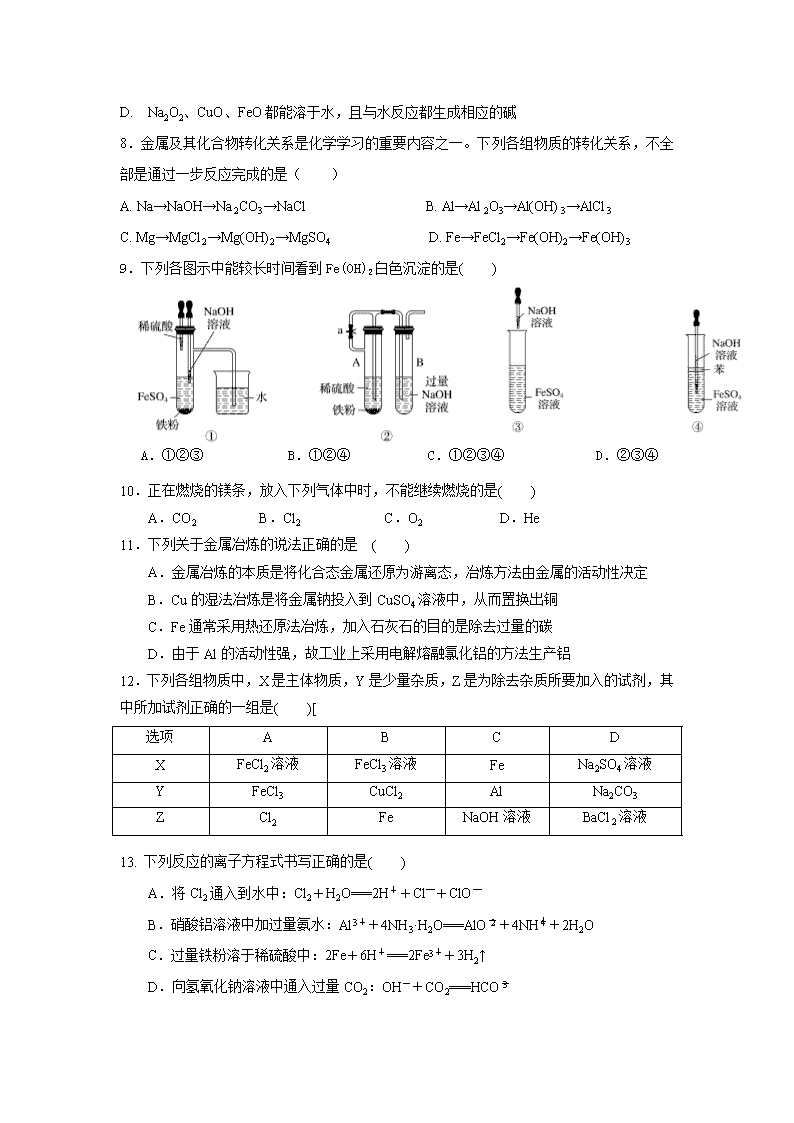
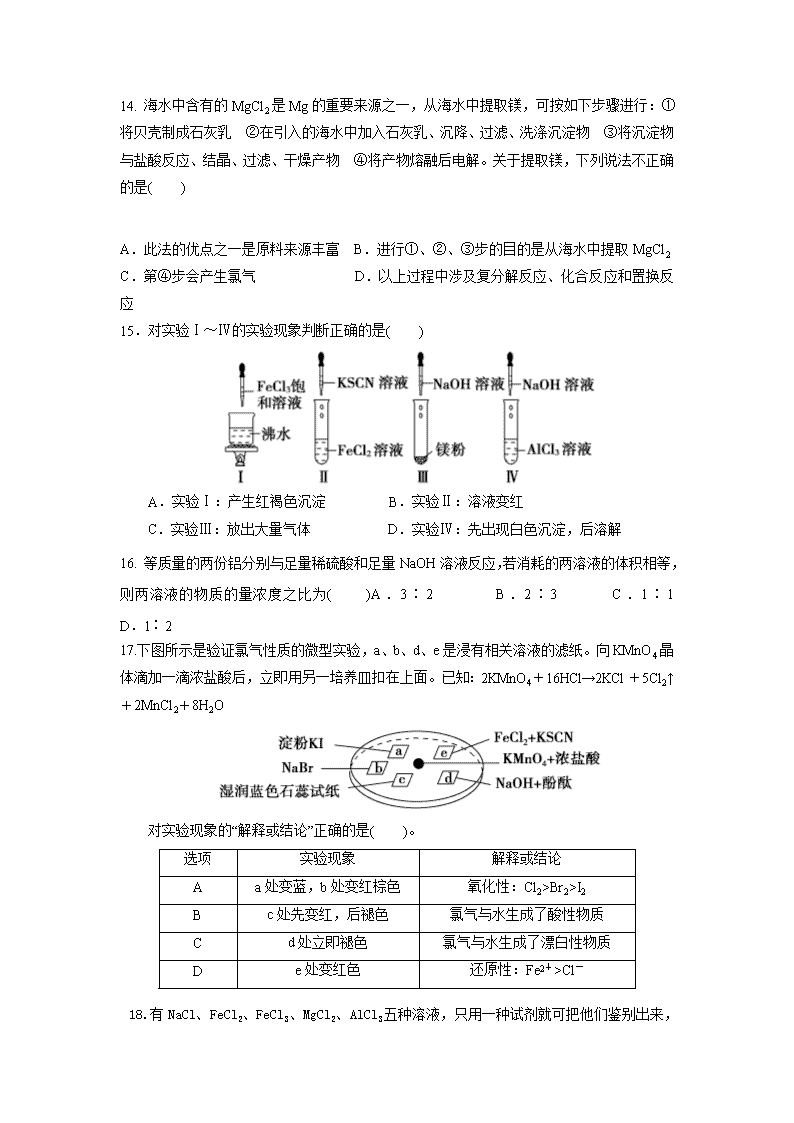
2018-2019学年河北省承德市第一中学高一上学期第三次月考化学试题 时间:60分钟 分值:100分 可能用到的原子量:H: 1, C: 12, O: 16, Na: 23, Mg: 24, Al:27, Fe: 56,Cu: 64 I卷(共25小题,每题3分) 1.我国十分重视海水资源的综合利用,下列物质不需经化学变化就能从海水中获得的是( ) A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水 2. 两种不同的微粒其质子总数与电子总数分别相等则他们的关系不可能是 ( ) A.两种不同的原子 B.一种原子和一种分子 C.一种阳离子和另一种阳离子 D.一种阴离子和一种阳离子 3.下列有关Na2CO3和NaHCO3比较中,不正确的是( ) A. 热稳定性:Na2CO3>NaHCO3 B. 常温下,两种盐在水中的溶解度:Na2CO3>NaHCO3 C. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 D. 相同温度下,0.1molL﹣1盐溶液分别与0.1molL﹣1HCl反应的剧烈程度:Na2CO3>NaHCO3 4.下列物质的分类结果全部正确的是( ) A.SO2—酸性氧化物 Na2O2—碱性氧化物 Al2O3—两性氧化物 B.绿矾—纯净物 HD—单质 氢氧化铁胶体—混合物 C.纯碱—碱 碱式碳酸铜—碱式盐 小苏打—酸式盐 D.液氯—非电解质 CaCO3—强电解质 H2O2—弱电解质 5.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )。 A.①比②多 B.②比①多 C.一样多 D.无法比较 6.下列各组物质相互反应后,没有碱生成的是 ( ) A. Na2O2溶于水 B. 红热的铁和水蒸气 C. 金属钠投入水中 D. Na2O投入水中 7.下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( ) A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料 C. MgO和Al2O3可用作耐高温材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱 8.金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系,不全部是通过一步反应完成的是( ) A. Na→NaOH→Na2CO3→NaCl B. Al→Al2O3→Al(OH)3→AlCl3 C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Fe→FeCl2→Fe(OH)2→Fe(OH)3 9.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( ) A.①②③ B.①②④ C.①②③④ D.②③④ 10.正在燃烧的镁条,放入下列气体中时,不能继续燃烧的是( ) A.CO2 B.Cl2 C.O2 D.He 11.下列关于金属冶炼的说法正确的是 ( ) A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活动性决定 B.Cu的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜 C.Fe通常采用热还原法冶炼,加入石灰石的目的是除去过量的碳 D.由于Al的活动性强,故工业上采用电解熔融氯化铝的方法生产铝 12.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )[ 选项 A B C D X FeCl2溶液 FeCl3溶液 Fe Na2SO4溶液 Y FeCl3 CuCl2 Al Na2CO3 Z Cl2 Fe NaOH溶液 BaCl2溶液 13. 下列反应的离子方程式书写正确的是( ) A.将Cl2通入到水中:Cl2+H2O===2H++Cl─+ClO─ B.硝酸铝溶液中加过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O C.过量铁粉溶于稀硫酸中:2Fe+6H+===2Fe3++3H2↑ D.向氢氧化钠溶液中通入过量CO2:OH-+CO2===HCO 14. 海水中含有的MgCl2是Mg的重要来源之一,从海水中提取镁,可按如下步骤进行:①将贝壳制成石灰乳 ②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应、结晶、过滤、干燥产物 ④将产物熔融后电解。关于提取镁,下列说法不正确的是( ) A.此法的优点之一是原料来源丰富 B.进行①、②、③步的目的是从海水中提取MgCl2 C.第④步会产生氯气 D.以上过程中涉及复分解反应、化合反应和置换反应 15.对实验Ⅰ~Ⅳ的实验现象判断正确的是( ) A.实验Ⅰ:产生红褐色沉淀 B.实验Ⅱ:溶液变红 C.实验Ⅲ:放出大量气体 D.实验Ⅳ:先出现白色沉淀,后溶解 16. 等质量的两份铝分别与足量稀硫酸和足量NaOH溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为( )A.3∶2 B.2∶3 C.1∶1 D.1∶2 17.下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O 对实验现象的“解释或结论”正确的是( )。 选项 实验现象 解释或结论 A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2 B c处先变红,后褪色 氯气与水生成了酸性物质 C d处立即褪色 氯气与水生成了漂白性物质 D e处变红色 还原性:Fe2+>Cl- 18.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3 五种溶液,只用一种试剂就可把他们鉴别出来,这 种试剂是 A.盐酸 B.烧碱溶液 C.氯水 D.KSCN溶液 19.已知下述三个实验均能发生化学反应:( ) ① ② ③ 将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中 下列判断正确的是( ) A.实验①中铁钉只做还原剂 B.实验②中Fe2+既显氧化性又显还原性 C.实验③中发生的是置换反应 D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+ 20. 下列有关说法不正确的是( ) A. 常温下浓硫酸能使铁发生钝化,可在常温下用铁制贮罐贮运浓硫酸 B. 为加快漂白粉的漂白速率,使用时可滴加盐酸 C. 小苏打可以治疗胃酸过多,明矾可以给自来水消毒 D. 将铁粉加入FeCl3、CuCl2的混合溶液中,充分反应后剩余的固体中不一定有铁 21.用铝热法还原下列化合物,若获得金属各1 mol,消耗铝最少的是( ) A.MnO2 B.Cr2O3 C.WO3 D.CuO 22. 如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( ) A.上述反应是置换反应 B.上述反应放出热量 C.上述反应中CuSO4表现了还原性 D.加热且无水条件下,Na可以与CuSO4反应并生成Cu 23.以下实验设计能达到实验目的是 ( ) 实验目的 实验设计 A 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 B 制备无水MgCl2 直接蒸发MgCl2溶液,结晶后过滤 C 判断某溶液中有Na+,并且没有K+ 用洁净的铂丝蘸取溶液在酒精灯的外焰上灼烧,观察到火焰呈黄色 D 鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取 24.向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )A.3.2 g B.2.4 g C.1.6 g D.0.8 g 25.下图为反应Fe+CuSO4===Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( ) A.Fe,S B.Cu,S C.Fe,Cu D.Fe,O Ⅱ卷(共2题,25分) 26.(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。 请根据以上信息回答下列问题: (1)画出A的原子结构示意图: , (2)写出下列物质的化学式: H: 、乙: , (3)C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是________________。 (4)写出反应①的离子方程式: 反应① ; (5)写出反应②的化学方程式: 反应② ; (6)检验溶液E中阴离子的常用方法是 。 27.(13分) (1)某化学兴趣小组利用下列试剂:铁粉、0.1 mol·L−1 FeCl3溶液、0.1 mol·L−1 FeCl2 溶液、KSCN溶液、新制氯水,二氧化硫气体,探究Fe3+ 、Fe2+的氧化性、还原性,并利用实验结 论解决一些问题。 ①用所给试剂写出体现Fe2+具有还原性的反应的离子方程式: 。 ②设计实验方案,完成下列表格。 探究内容 实验方案 实验现象 探究Fe3+具有氧化性 取少量0.1 mol·L−1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ ③该兴趣小组为说明“Fe3+具有氧化性”,提出向FeCl3溶液中通入二氧化硫气体的方案,该反应的离子方程式为 。 (2)某反应中反应物与生成物有Fe3+、Mn2+、H+、、H2O和一种未知离子X,已知 在反应中得到电子,则X离子是_______,该反应的离子方程式是 。 (3)有一铁的氧化物样品,用5 mol·L−1的盐酸140 mL恰好完全溶解,所得溶液还能与通 入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为 。 化学试题答案 1-5 DDDBB 6-10 BDBBD 11-15 ACDDD 16-20 ADBAC 21-25 DCDDC 26.(1) (2) H: Fe(OH)3 乙:Cl2 (3)Fe3O4 (4)Fe+2H+=Fe2++H2↑ (5)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (6)用硝酸酸化的AgNO3,出现白色沉淀,证明是Cl-. 27①2Fe2++Cl2=2Fe3++2Cl- ②黄色变为浅绿色;无明显变化 ③2H2O+2Fe3++SO2=2Fe2++SO42-+4H+ (2)Fe2+ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (3)Fe5O7查看更多