2021高考化学人教版一轮复习规范演练:第四章 第二讲 富集在海水中的元素—氯
www.ks5u.com
规范演练10
一、选择题
1.(2019·衡阳市第一中学模拟)下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是( )
A.FeCl2 B.AlCl3
C.FeCl3 D.CuCl2
解析:因为Cl2具有较强的氧化性,当Cl2与金属反应时,都可把金属氧化成最高价态的金属氯化物,而盐酸中H+的氧化能力较弱,只能把Fe氧化成Fe2+,而不能把Cu氧化。
答案:B
2.(2019·中山一中月考)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
解析:Cl2溶于水后,存在如下平衡:Cl2+H2OH++Cl-+HClO,HClOH++ClO-,前者程度大,后者程度小,故c(H+)增大的多,c(ClO-)增大的少,增大,A错误;SO2+Cl2+2H2O===2HCl+H2SO4,加入少量SO2后溶液漂白性减弱,B错误;加入少量NaOH固体后,只有当溶液pH=7时C项中式子才成立,故C错误;加入水后,溶液中c(H+)减小,平衡向c(H+)增大的方向移动,因此水的电离平衡向正反应方向移动,D正确。
答案:D
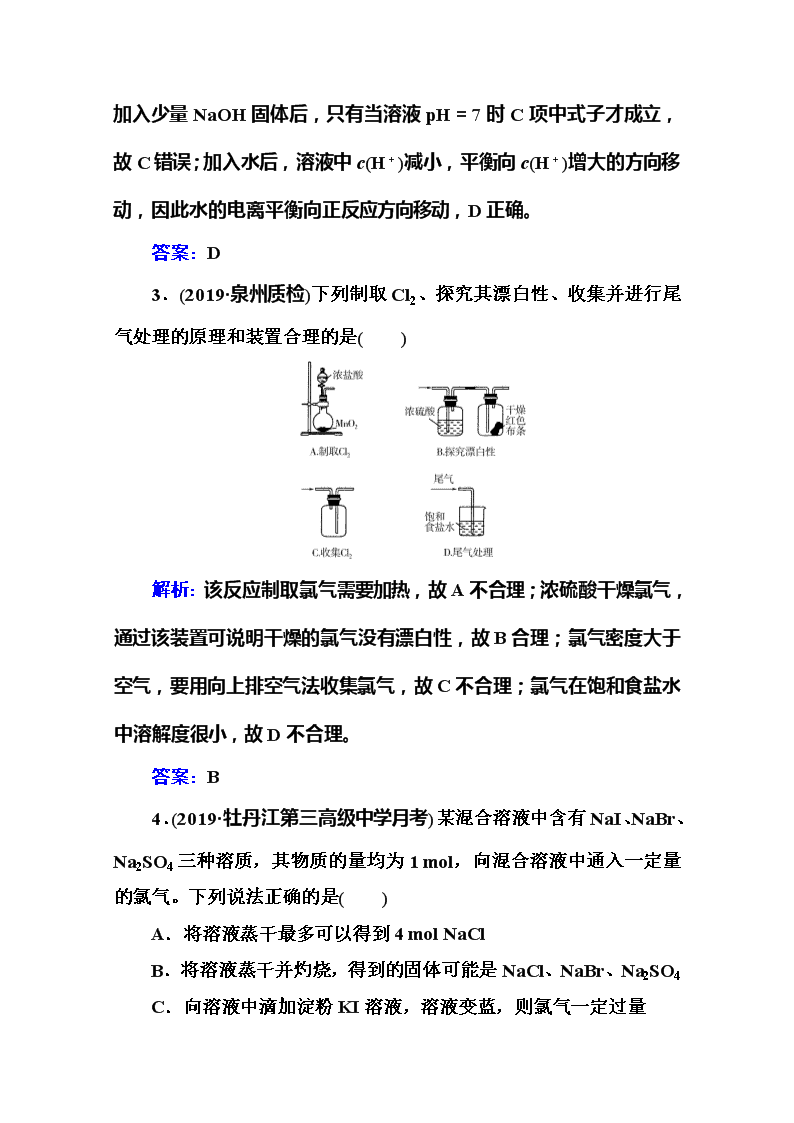
3.(2019·泉州质检)下列制取Cl2、探究其漂白性、收集并进行尾气处理的原理和装置合理的是( )
解析:该反应制取氯气需要加热,故A不合理;浓硫酸干燥氯气,通过该装置可说明干燥的氯气没有漂白性,故B合理;氯气密度大于空气,要用向上排空气法收集氯气,故C不合理;氯气在饱和食盐水中溶解度很小,故D不合理。
答案:B
4.(2019·牡丹江第三高级中学月考)某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1 mol,向混合溶液中通入一定量的氯气。下列说法正确的是( )
A.将溶液蒸干最多可以得到4 mol NaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加淀粉KI溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为22.4 L(标准状况),反应的离子方程式为2I-+Cl2===I2+2Cl-
解析:Cl2与Na2SO4不反应,因此将溶液蒸干最多可以得到2 mol NaCl,A错误;若Cl2与部分NaBr反应,则将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4,B正确;向溶液中滴加淀粉KI溶液,溶液变蓝,说明有碘生成,Cl2可能只与部分的NaI反应,C错误;D项,正确的离子方程式为2I-+Cl2===I2+2Cl-、2Br-+
Cl2===Br2+2Cl-,错误。
答案:B
5.(2019·河南中原名校联盟模拟)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒剂。实验室通过如图所示过程制备二氧化氯。下列说法正确的是( )
A.电解时发生反应的离子方程式为NH+3Cl-===2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
解析:A项,电解NH4Cl与盐酸的混合溶液,生成NCl3与H2,发生反应的离子方程式为NH+2H++3Cl-===3H2↑+NCl3,错误;B项,根据元素守恒,溶液X中大量存在的阴离子有Cl-和OH-,正确;C项,ClO2易溶于水,NH3显碱性,因此要除去混有的NH3,应该选择浓硫酸,错误;D项,明矾在水中可电离出Al3+,Al3+水解生成Al(OH)3胶体,Al(OH)3胶体可吸附水中的杂质起到净水作用,但不能用明矾除去NaClO2,错误。
答案:B
6.(2019·宿州十三所重点中学联考)将氯水分别滴到下列溶液中,由实验现象得出的结论正确的是( )
选项
氯水滴入
下列溶液中
实验现象
结论
A
滴有KSCN
的FeCl2溶液
变红
Cl2具有还原性
B
滴有酚酞的
NaOH溶液
褪色
Cl2具有酸性
C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
D
淀粉KI溶液
变蓝色
Cl2具有氧化性
解析:Cl2+2FeCl2===2FeCl3,Cl2显示氧化性,A错误;Cl2+2NaOH===NaCl+NaClO+H2O,Cl2显示氧化性和还原性,B错误;Cl2无漂白性,其漂白原理是Cl2+H2O===HCl+HClO,HClO具有漂白性,C错误。
答案:D
7.(2019·贵州剑河二中月考)下列关于卤素(用X表示)的叙述错误的是( )
A.卤素单质与水反应均可用:X2+H2OHXO+HX表示
B.HX都极易溶于水,它们的热稳定性随X的核电荷数的增加而减小
C.卤素单质的颜色由F2→I2随相对分子质量增大而变深
D.X-的还原性依次为F-
Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致。
(2)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。供选用的试剂:a.酚酞试液、b.四氯化碳、c.无水酒精、d.硫氰化钾溶液,请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填字母)
方案
选用试剂
实验现象
方案1
方案2
(3)应用与拓展:①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生反应的离子方程式为__________________
____________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有的溴元素被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____________。
解析:(1)①溴单质溶于水显黄色。②溴单质的氧化性比Fe3+强,溴单质与Fe2+反应生成Fe3+而使溶液显黄色。(2)证明溶液中没有溴单质而有Fe3+即可证明乙同学的观点,利用溴溶于四氯化碳,使四氯化碳层显红棕色,Fe3+遇SCN-显红色来设计实验。(3)①通过上述
分析可知,溴单质可以氧化Fe2+生成Fe3+和Br-,离子方程式为2Fe2++Br2===2Fe3++2Br-。②FeBr2中通入Cl2,Cl2先和Fe2+反应,后和Br-反应,假设FeBr2的浓度为x mol·L-1,根据得失电子守恒可知x×0.1+2(x×0.1×)=×2,则x=1.2。
答案:(1)①Br2 ②Fe3+
(2)
方案
选用试剂
实验现象
方案1
b
CCl4层呈无色
方案2
d
溶液变红
(3)①2Fe2++Br2===2Fe3++2Br- ②1.2 mol·L-1
10.(2019·深圳调研)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。请回答下列问题:
Ⅰ.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为________________________,仪器b的作用是_____________________________________________________。
(2)装置A中生成NaClO2的离子方程式为___________________
____________________________________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶、______________、________________、干燥等。
Ⅱ.探究亚氯酸钠的性质。
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向装置A中滴入稀硫酸。
(4)开始时装置A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因:________________________________________
_____________________________________________________。
(5)装置B中的现象为___________________________________。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是再次打开止水夹①,__________________________
_____________________________________________________。
解析:Ⅰ.(1)根据仪器的特点可知,仪器a为圆底烧瓶,仪器b为干燥管,仪器b的作用是防止倒吸。(2)根据实验步骤,装置A中加入NaOH、H2O2和通入ClO2,产物是NaClO2,Cl的化合价降低,即ClO2作氧化剂,则H2O2作还原剂,H2O2的氧化产物是O2,因此有ClO2+H2O2+OH-―→ClO+O2+H2O,根据化合价升降法进行配平,得出装置A中发生反应的离子方程式为2ClO2+2OH-+H2O2 === 2ClO+2H2O+O2。(3)蒸发浓缩、降温结晶,析出NaClO2晶体,然后过滤、洗涤、干燥即可。Ⅱ.(4)NaClO2在酸性条件下生成NaCl和ClO2,发生的反应是5NaClO2+2H2SO4===NaCl+4ClO2↑+2H2O+2Na2SO4,开始时装置A中反应缓慢,稍后产生气体的速率急剧加快,其原因可能是NaClO2与H2SO4反应生成的Cl-对反应起催化作用。(5)ClO2的性质与氯气相似,即ClO2的氧化性强于I2,ClO2把I-氧化成I2
,淀粉遇碘单质变蓝,即装置B中的现象是溶液变蓝色。(6)为了让有毒气体完全被吸收,从进气口通入一段时间的空气。
答案:Ⅰ.(1)圆底烧瓶 防止倒吸 (2)2ClO2+2OH-+H2O2===2ClO+2H2O+O2 (3)过滤 洗涤
Ⅱ.(4)NaClO2与H2SO4反应生成的Cl-对反应起催化作用 (5)溶液变蓝色 (6)从进气口通入一段时间的空气
11.(2019·揭阳三中月考)实验室用下图所示装置制备氯气并进行性质实验(必要时可加热,夹持装置已省略)。
(1)仪器a的名称是________;装置B中长颈漏斗的作用是
____________________________________________________。
蒸馏烧瓶b中发生反应的化学方程式为____________________
____________________________________________________。
(2)洗气装置B中试剂是饱和食盐水,其作用是______________
____________________________________________________,
分液漏斗D中发生反应的化学方程式为__________________
____________________________________________________。
(3)装置C中Ⅰ、Ⅱ、Ⅲ依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,设计C装置的目的是____________________
_____________________________________________________。
(4)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式:_______________________________________________。
(5)
实验结束后将产生的氯气通入含紫色石蕊溶液的试管中,请填写下表中的空白:
实验现象
原因
溶液最初从紫色逐渐变为______色
氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
然后溶液从无色逐渐变为________色
解析:(1)装置B是安全瓶,长颈漏斗的作用是监测实验进行时C中是否发生堵塞,平衡装置中压强,防止玻璃仪器破裂。(3)让氯气依次通过湿润的有色布条、无水氯化钙、干燥的有色布条是为了验证是氯气还是次氯酸具有漂白性。(5)氯水呈酸性,生成的次氯酸有强氧化性,所以氯气通入紫色石蕊试液中,溶液先变红后褪色,最后如果氯气过量形成氯水呈现浅黄绿色。
答案:(1)分液漏斗 平衡装置中压强,防止玻璃仪器破裂 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)除去氯气中的氯化氢气体 Cl2+2NaBr===Br2+2NaCl (3)验证是氯气还是次氯酸具有漂白性
(4)Cl2+2OH-===Cl-+ClO-+H2O (5)红 氯气与水反应生成的HClO具有漂白性 浅黄绿 过量的氯气溶于水
12.NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+===Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO,写出化学反应方程式:_______________________________
_____________________________________________________。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI淀粉溶液、1.0 mol·L-1 NaOH溶液、澄清石灰水、饱和NaCl溶液。请完成下列实验方案。
所加试剂
预期现象和结论
试管A中加足量①________;试管B中加1%品红溶液;试管C中加②________
若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;
③________________________,则消毒液未变质;
④________________________,则消毒液完全变质
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL。
②滴定分析:将c mol·L-1的酸性KMnO4溶液装入________(填“酸式”或“碱式”)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有NaClO+Na2SO3===NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4===K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算:消毒液中NaClO的浓度为________mol·L-1(用含a、b、c、V的代数式表示)。
解析:(2)可以通过KI淀粉溶液检验产生的气体中是否含有Cl2,确定是否有NaClO存在;通过澄清石灰水检验产生的气体中是否含有CO2,确定是否有NaHCO3存在;因此A中试剂是1.0 mol·L-1 KI淀粉溶液,C中试剂是澄清石灰水。(3)KMnO4溶液有强氧化性,应用酸式滴定管盛装。
答案:(1)NaClO+CO2+H2O===NaHCO3+HClO
(2)①1.0 mol·L-1 KI淀粉溶液 ②澄清石灰水
③若A中溶液变蓝色,B中溶液不褪色(无变化),C中溶液不变浑浊(无变化) ④若A中溶液不变蓝色(无变化),B中溶液不褪色(无变化),C中溶液变浑浊
(3)②酸式 ③