- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省六安市毛坦厂中学2020届高三下学期假期化学作业2
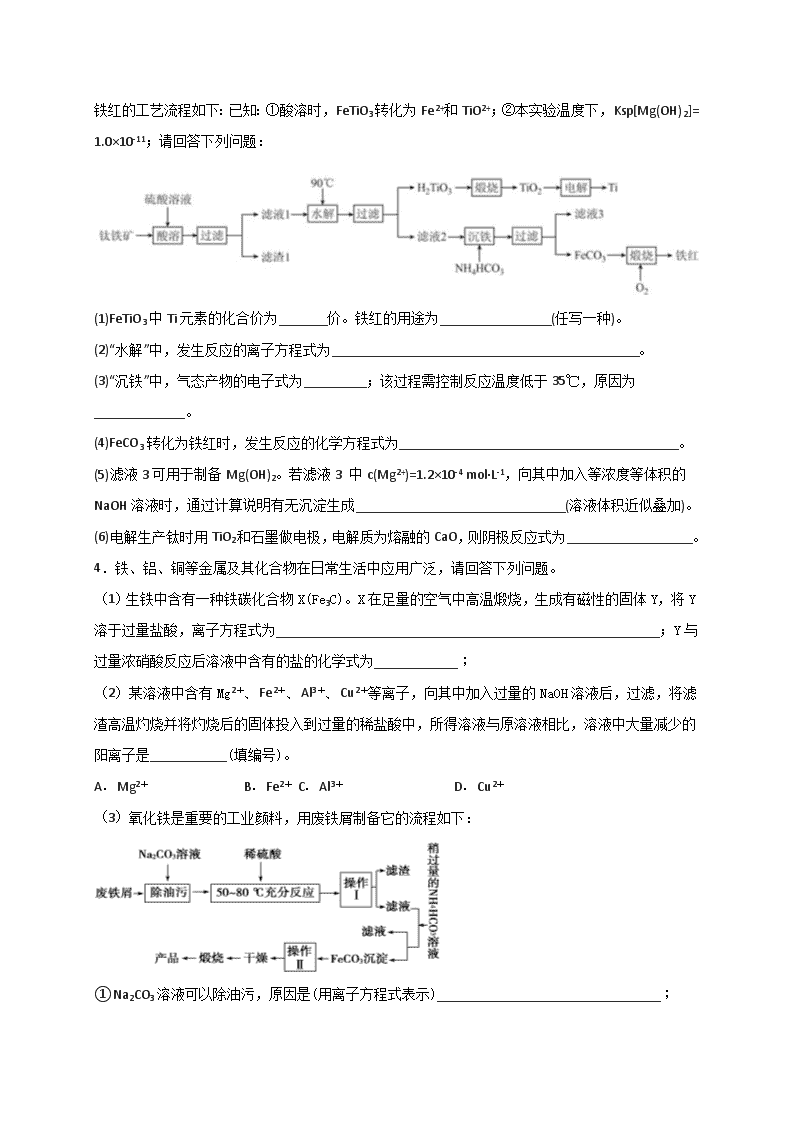
化学作业 一、综合题 1.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: (1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。 (2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。 (3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。 (4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。 (5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。 2.电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤: (1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。 (2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。 (3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。 (4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。 (5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。 3.工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质] 为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题: (1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。 (2)“水解”中,发生反应的离子方程式为____________________________________________。 (3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。 (4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。 (5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。 (6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。 4.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题。 (1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸,离子方程式为_______________________________________________________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为____________; (2)某溶液中含有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________(填编号)。 A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+ (3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: ①Na2CO3溶液可以除油污,原因是(用离子方程式表示)________________________________; ②操作Ⅱ中沉淀的洗涤方法是___________________________________________________________ ③请写出生成FeCO3沉淀的离子方程式_______________________________________________。 5.以下为中学化学中常见的物质:①Cu; ②1mol•L﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2 (1)以上物质中属于电解质的是__;属于非电解质的是__. (2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为__________________; (3)将②③⑧混合配制成浓度均为1mol•L﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有__阳离子,可能含有__阳离子. (4)向⑨溶液中逐滴加入稀硫酸,请完成下列问题: ① 写出该反应的离子方程式:______________________________. ② 下列三种情况下,离子方程式与①相同的是__( 填序号). A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性 B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀 C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量 6.为探究矿石样品A(仅含两种元素)的组成和性质,设计并完成如下实验: 已知溶液D中只含一种金属阳离子,与铁粉充分反应后固体质量减少14 g。 请回答: (1)样品A的化学式为________________。 (2)写出气体c与溴水反应的离子方程式___________________。 (3)写出样品A与盐酸发生氧化还原反应的化学方程式____________________。 7.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。 试回答下列问题: (1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是______(填序号)。 A.亚硝酸盐被还原 B.维生素C是还原剂 C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂 (2)下列方法中,不能用来区分NaNO2和NaCl的是_____(填序号)。 A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙 C.在酸性条件下加入KI-淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别 (3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方程式:_____________。 (4)Fe与过量稀硫酸反应可以制取FeSO4。若将反应所得的酸性溶液中Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。 A.Cl2 B.Fe C.H2O2 D.HNO2 (5)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,高铁酸钾作为水处理剂发挥的作用是____________________。 8.高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: 回答下列问题: (1)Cl2与NaOH溶液反应的离子方程式是__________________。 (2)经过步骤①后,加入NaOH固体的原因是________________________。 (3)步骤②反应的离子方程式是_______________。 (4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。 (5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。 (6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。 参考答案 1. 过滤 Fe2O3 2Al(OH)3 Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3•H2O=Al(OH)3↓+3NH4+ 硅酸钠(或Na2SiO3) 【解析】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝,向铝土矿中加入浓NaOH溶液并加热,Al2O3、SiO2都和NaOH反应生成可溶性的钠盐,Fe2O3不和NaOH反应,然后过滤得到的沉淀M为Fe2O3,滤液X中含有Na2SiO3、NaAlO2,通入CO2并控制一定条件过滤得到Al(OH)3,滤液Y中含有碳酸钠和硅酸钠,将Al(OH)3洗涤过滤加热,Al(OH)3分解生成Al2O3和水,则N为Al2O3;则 (1)I和II步骤中分离溶液和沉淀的操作是过滤。(2)沉淀M中除含有泥沙外,一定还含有难溶于NaOH溶液的氧化物,Fe2O3不和NaOH反应,然后过滤得到的沉淀M为Fe2O3,生成固体N反应的化学方程式为2Al(OH)3 Al2O3+3H2O。(3)根据以上分析可知滤液X中含铝元素的溶质的化学式为NaAlO2,它属于盐类物质。(4)氢氧化铝是两性氢氧化物,能溶于强碱溶液中,实验室里常往AlCl3溶液中加入氨水来制取Al(OH)3,该反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+。(5)根据以上分析可知滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠或Na2SiO3。 2.过滤 烧杯 漏斗 玻璃棒 2Fe3++Cu=2Fe2++Cu2+ 硫氰化钾 溶液由黄色转化为血红色 先产生白色絮状沉淀,然后迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe、Cu 2Fe2++Cl2=2Fe3++2Cl- 【解析】 【分析】 废液中含有FeCl2、CuCl2、FeCl3,向滤液中加入过量Fe,发生反应2Fe3++Fe=3Fe2+、Cu2++Fe=2Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量HCl,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向FeCl2滤液中通入过量Cl2,发生的反应为2Fe2++Cl2=2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。 【详解】 (1)步骤Ⅰ是从溶液中得到滤渣,则操作名称为过滤,所需玻璃仪器有烧杯、漏斗和玻璃棒。 (2)氯化铁具有氧化性,能与金属铜反应,则FeCl3溶液与铜箔发生反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。 (3)铁离子和KSCN溶液混合反应生成络合物硫氰化铁而使溶液呈血红色,可以用KSCN溶液检验铁离子,实验现象是:溶液由黄色转化为血红色; (4)滤液②中含有氯化亚铁,向②中加入NaOH溶液生成氢氧化亚铁沉淀,由于氢氧化亚铁不稳定,易被氧化,则反应中的现象为先产生白色絮状沉淀,然后迅速变为灰绿色,最终变为红褐色,此转化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3; (5)①是铁且是过量的,发生反应2Fe3++Fe=3Fe2+、Cu2++Fe=2Fe2++Cu,所以③中所含物质为Fe、Cu。氯化亚铁易被氧化为氯化铁,则⑥发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。 【点睛】 本题以铁及其化合物为载体考查物质分离和提纯,涉及离子方程式书写、氧化还原反应、离子检验等知识点,熟练掌握亚铁离子、铁离子性质及其检验方法、现象为解答的关键。注意氢氧化亚铁易被氧化的性质特点。 3.+4 制备红色颜料和油漆、冶炼铁等 TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2↓+2H+] 防止NH4HCO3分解(或减少Fe2+的水解) 4FeCO3+O2 2Fe2O3+4CO2 QC=2.16×10-13< 1.0×10-11,故没有沉淀 TiO2+4e-=Ti+2O2- 【解析】 【分析】 (1)FeTiO3中铁和氧的化合价分别为+2和-2,判断Ti元素的化合价;铁红的用途为制备红色颜料和油漆、冶炼铁等; (2)酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀,据此写出离子方程式; (3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解; (4) FeCO3在氧气中煅烧生成氧化铁和二氧化碳,据此写出反应的化学方程式; (5) 根据该反应的浓度商QC与 Ksp[Mg(OH)2]之间关系判断反应是否有沉淀生成; (6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,据此写出阴极反应。 【详解】 (1)FeTiO3中铁和氧的化合价分别为+2和-2,所以Ti元素的化合价为+4价;铁红的用途为制备红色颜料和油漆、冶炼铁等;综上所述,本题答案是:+4; 制备红色颜料和油漆、冶炼铁等。 (2) 酸溶时,FeTiO3转化为Fe2+和TiO2+;TiO2+水解生成H2TiO3沉淀;离子方程式为:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+];综上所述,本题答案是:TiO2++2H2O=H2TiO3↓+2H+[或TiO2++2H2O=TiO(OH)2+2H+]。 (3) “沉铁”中,亚铁离子与碳酸氢根离子发生反应生成碳酸亚铁沉淀和二氧化碳,二氧化碳为共价化合物,电子式为: ;该过程需控制反应温度低于35℃,温度过高 NH4HCO3会分解,而且会促进亚铁离子的水解,所以控制反应温度低于35℃是为了防止 NH4HCO3分解(或减少Fe2+的水解);综上所述。本题答案是: ;防止NH4HCO3分解(或减少Fe2+的水解) 。 (4) FeCO3在氧气中煅烧生成氧化铁和二氧化碳,反应的化学方程式为:4FeCO3+O2 2Fe2O3+4CO2;综上所述,本题答案是:4FeCO3+O2 2Fe2O3+4CO2。 (5) 若滤液3中c(Mg2+)=1.2×10-4 mol•L-1,则NaOH溶液的浓度为1.2×10-4 mol•L-1,而溶液等体积混合,所以c(Mg2+)=c(OH-)=0.6×10-4 mol•L-1,该反应的浓度商QC= c(Mg2+)×c2(OH-)=2.16×10-13< Ksp[Mg(OH)2]= 1.0×10-11;所以没有沉淀生成;综上所述,本题答案是:QC=2.16×10-13< 1.0×10-11,故没有沉淀。 (6)电解池中,TiO2在阴极发生还原反应生成钛,熔融的CaO为电解质,阴极反应式为TiO2+4e-=Ti+2O2-;综上所述,本题答案是:TiO2+4e-=Ti+2O2-。 4.Fe3O4+8H+===2Fe3++Fe2++4H2O Fe(NO3)3 BC CO32-+H2O HCO3-+OH- 向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 【解析】 【详解】 (1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,化学反应方程式为Fe3O4+8HCl==2FeCl3+FeCl2+4H2O,硝酸具有强氧化性,Fe3O4与过量的浓硝酸反应生成硝酸铁,化学式为Fe(NO3)3; (2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,故选BC; (3)①碳酸钠溶液中碳酸根水解CO32-+H2O⇌HCO3-+OH-,溶液呈碱性,油污主要为油脂,碱性条件下水解而除去;②FeCO3 沉淀会附着其它离子,需要进行洗涤,减少杂质,具体操作为:向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次;③由工艺流程可知,操作I所得的滤液中主要有硫酸亚铁,加入碳酸氢铵,实质是亚铁离子与碳酸氢根离子反应,生成FeCO3, 同时生成二氧化碳、水,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。 【点睛】 本题考查元素化合物性质、化学工艺流程、基本操作与方案设计、盐类水解、常用化学用语等。 5.⑤⑦⑧⑨ ④⑥ FeCl3+3H2O Fe(OH)3(胶体)+3HCl Fe2+ Cu2+ Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O A 【解析】 试题分析:(1)根据电解质、非电解的定义质判断; (2)氯化铁与水加热生成氢氧化铁胶体和氯化氢;(3)Fe3+的氧化性大于Cu2+,铁粉加入FeCl3、CuCl2、FeSO4的混合溶液中,铁依次发生 、 两个反应。(4)①向Ba(OH)2溶液中逐滴加入稀硫酸生成硫酸钡和水;②分别写出ABC三个反应的离子方程式作对比。 解析:(1)①Cu是单质,既不是电解质也不是非电解质; ②1mol•L﹣1的FeCl3溶液是混合物,既不是电解质也不是非电解质; ③CuCl2溶液是混合物,既不是电解质也不是非电解质;④CO2不能自身电离出离子导电,CO2属于非电解质;⑤H2SO4水溶液能导电,属于电解质;⑥酒精不能电离,属于非电解质;⑦CaCO3能电离出钙离子、碳酸根离子,属于电解质;⑧FeSO4水溶液能导电,属于电解质;⑨Ba(OH)2水溶液能导电,属于电解质;所以属于电解质的是⑤H2SO4、⑦CaCO3、⑧FeSO4、⑨Ba(OH)2;属于非电解质的是④CO2、⑥酒精; (2)氯化铁与水加热生成氢氧化铁胶体和氯化氢,离子方程式是FeCl3+3H2O Fe(OH)3(胶体)+3HCl; (3)Fe3+的氧化性大于Cu2+,铁粉加入FeCl3、CuCl2、FeSO4的混合溶液中,铁依次发生 、 两个反应,若铁粉无剩余,且有铜生成,说明 完全进行, 可能完全进行,也可能部分进行,反应后的溶液中一定含有Fe2+,可能含有Cu2+。 (4)①向Ba(OH)2溶液中逐滴加入稀硫酸生成硫酸钡和水,离子方程式是Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O; ②A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性,离子方程式是Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O; B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀,离子方程式是Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O; C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量,离子方程式是Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O;故A正确。 点睛:铁粉加入FeCl3、CuCl2、FeSO4的混合溶液中,铁依次发生 、 ,若铁粉无剩余,且有铜生成,说明 完全进行, 可能完全进行,也可能部分进行,反应后的溶液中一定含有Fe2+,可能含有Cu2+;若固体中有铁和铜,说明 、 都完全反应,所以溶液中的阳离子只有Fe2+,一定不含Cu2+。若没有固体剩余,说明 反应可能完全进行,也可能部分进行; 没反应,所以溶液中的阳离子一定有Fe2+、Cu2+,可能含有Fe3+。 6. Fe3S4 SO2+Br2+2H2O=4H++2Br-+SO42- Fe3S4+6HCl=3FeCl2+S↓+3H2S↑ 【解析】矿石样品A(仅含两种元素)在足量O2中灼烧,可生成固体B和气体C,气体C与溴水反应生成无色溶液E,说明气体C为SO2;固体B与过量的HCl反应,可生成棕黄色溶液D,D与过量铁粉反应生成H2,并且溶液D中只含一种金属阳离子,说明棕黄色溶液D为FeCl3。根据以上分析可以解答下列问题。 (1)根据以上分析可知样品A中含有Fe和S元素,设样品A中含有Fe原子物质的量为X摩尔,根据溶液D与铁粉充分反应后固体质量减少14g,发生的离子反应为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,可知减少固体的质量为:X/2×56+0.1×56=14,解得X=0.3mol,则S原子的物质的量为:(29.6-0.3×56)/32=0.4 mol,所以样品A的化学式为Fe3S4。答案为:Fe3S4 (2)SO2与溴水反应生成硫酸和溴化氢,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-答案为:SO2+Br2+2H2O=4H++2Br-+SO42- (3)Fe3S4与盐酸可以发生氧化还原反应,方程式为:Fe3S4+6HCl=3FeCl2+S↓+3H2S↑答案为:Fe3S4+6HCl=3FeCl2+S↓+3H2S↑ 7.D B NO2-+Cl2+H2O===NO3-+2H++2Cl- C 净水、消毒 【解析】 【详解】 (1)A.Fe2+→Fe3+化合价升高,被氧化,亚硝酸盐作氧化剂,被还原,A正确; B.Fe3+→Fe2+化合价降低,被还原,则维生素C作还原剂,B正确; C.根据信息,维生素C可以解毒,把Fe3+转变成Fe2+,C正确; D.根据上述判断,亚硝酸盐作氧化剂,D错误; 答案为D (2)A.HNO2是弱酸,则NaNO2属于强碱弱酸盐,水溶液显碱性,而NaCl水溶液显中性,故不符合题意; B.甲基橙的变色范围是3.1~4.4,溶液的pH大于4.4时显黄色,不能鉴别,故符合题意; C.因为HNO2是一种弱酸,NaNO2溶液中加入酸后生成HNO2,且HNO2具有氧化性,把I-氧化成I2,I2遇淀粉变蓝,而NaCl不具有这种性质,可以鉴别,故不符合题意; D.根据信息AgNO2是难溶于水但易溶于酸的物质,而AgCl既不溶于水也不溶于酸,可以鉴别,故不符合题意。 答案为B (3)新制氯水中主要含有Cl2,HNO2能被常见的强氧化剂氧化,Cl2表现强氧化性,把NO2-氧化成NO3-,本身被还原成Cl-,因此有NO2-+Cl2→NO3-+Cl-,依据化合价的升降法配平,即NO2-+Cl2→NO3-+2Cl-,根据电荷守恒及原子守恒,得出:NO2-+Cl2+H2O===NO3-+2H++2Cl-。 (4)A.要求产物纯净,用氯气作氧化剂,引入Cl-,A错误; B.Fe是还原剂,B错误; C.H2O2是绿色氧化剂,不引入新的杂质,C正确; D.HNO2具有氧化性,引入HNO2产生新的杂质,D错误; 答案为C (5)K2FeO4中Fe的化合价为+6,具有强氧化性,能杀菌、消毒,被还原成Fe3+,Fe3+能水解成氢氧化铁胶体,氢氧化铁胶体具有吸附作用,从而达到净水的目的。 8.Cl2+2OH-=Cl-+ClO-+H2O Na2FeO4只在碱性环境中稳定存在,NaOH调节pH 2Fe2++2H++H2O2=2Fe3++2H2O 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 低 方便保存,消毒的同时可以净水,无毒 Zn-2e-+2OH-=Zn(OH)2, 增强 【解析】 【详解】 (1)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O; (2)经过步骤①后,加入NaOH固体的原因是Na2FeO4只在碱性环境中稳定存在,NaOH调节pH; (3)步骤②硫酸亚铁在双氧水作用下被氧化生成硫酸铁和水,反应的离子方程式是2Fe2++2H++H2O2=2Fe3++2H2O; (4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中硫酸铁在碱性条件下被次氯酸钠氧化生成高铁酸钠,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O; (5)FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-,单位质量得到电子 =0.018, Cl2+2e-═2Cl-,单位质量得到电子 =0.028, 所以Na2FeO4的消毒效率比氯气低;高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用,答案为方便保存,消毒的同时可以净水,无毒; (6)放电时,负极上锌失电子发生氧化反应,电极反应式为Zn-2e-+2OH-=Zn(OH)2;正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,正极附近溶液的碱性增强。查看更多