- 2021-07-08 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题 Word版含答案
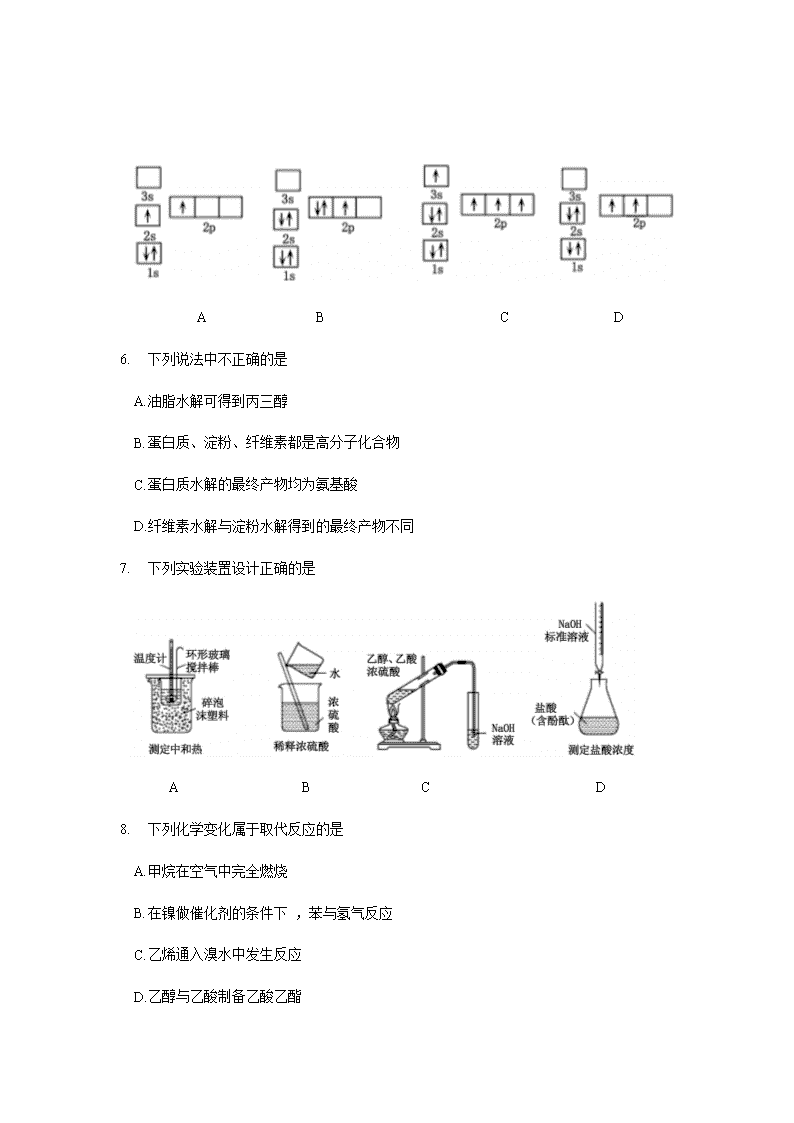
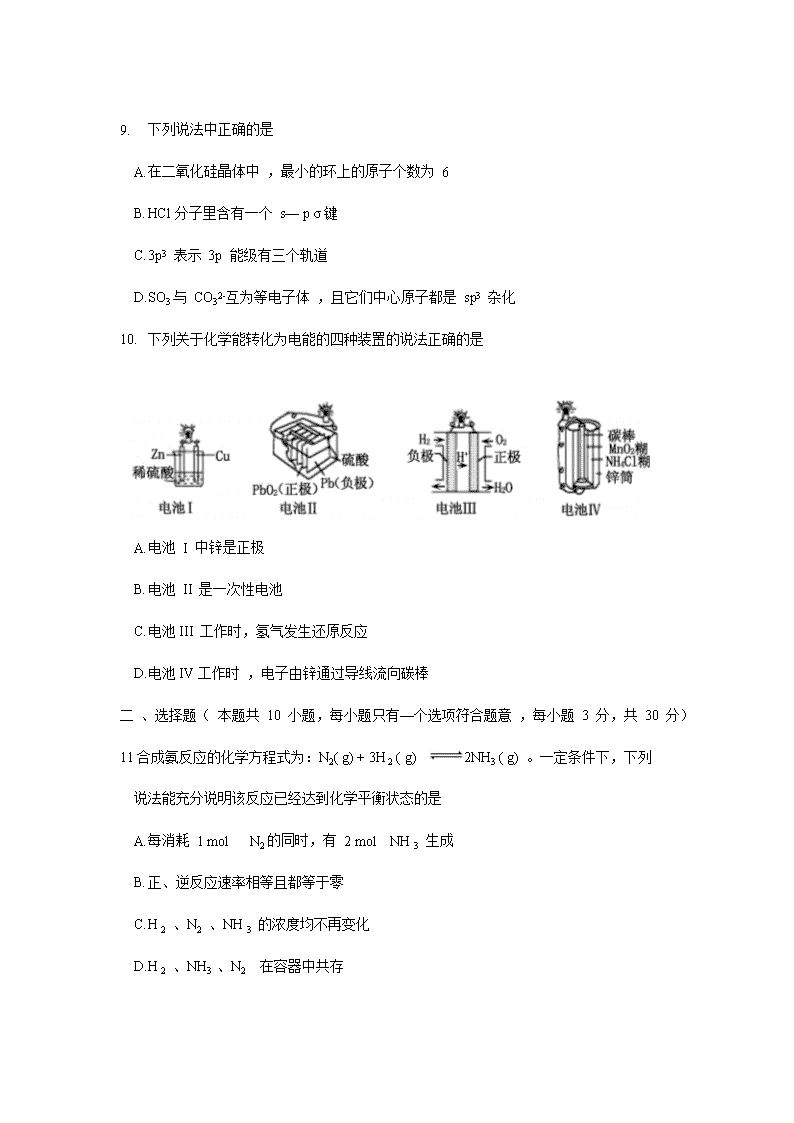
洛阳市 2019 ——2020 学年高二质量检测 化学试卷 本试卷共 100 分,考试时间 90 分钟。 注意事项: 1. 答卷前,考生务必将自己的姓名、考号填写在答题卡上。 2. 考试结束 ,将答题卡交回。 本试卷可能用到的相对原子质最: H :1 C :12 O:16 Cu :64 Ni :59 一、选择题( 本题共 1 0 小题,每小题只有一个选项符合题意 ,每小题 2 分,共 20 分) 1. 下列有关化学用语使用正确的是 A. CH4 分子的比例模型 : B. 乙醇的分子式:CH3CH2OH C . 苯的最简式:C6H 6 D. 乙烯的结构简式: CH2CH2 2. 下列各组物质中 ,能用银镜反应进行鉴别的是 A. 乙醇、乙酸 B. 苯、乙酸 C. 苯、已烯 D. 乙醛、乙酸 3. 下列分子中存在π键的是 A. H2 B. Cl2 C. N2 D. HCl 4. 常温下 ,向氨水中加水稀释的过程中,N H3 • H2O的电离平衡常数、电离度、溶液导电性的变化正确的是 A. 增大、增大、减小 B. 不变、增大、减小 C. 不变、减小、减小 D. 减小、减小、增大 5. 下列电子排布图所表示的元素原子中 ,其能量处于最低状态的是 A B C D 6. 下列说法中不正确的是 A. 油脂水解可得到丙三醇 B. 蛋白质、淀粉、纤维素都是高分子化合物 C. 蛋白质水解的最终产物均为氨基酸 D. 纤维素水解与淀粉水解得到的最终产物不同 7. 下列实验装置设计正确的是 A B C D 8. 下列化学变化属于取代反应的是 A. 甲烷在空气中完全燃烧 B. 在镍做催化剂的条件下 ,苯与氢气反应 C. 乙烯通入溴水中发生反应 D. 乙醇与乙酸制备乙酸乙酯 9. 下列说法中正确的是 A. 在二氧化硅晶体中 ,最小的环上的原子个数为 6 B. HCl分子里含有一个 s— p σ键 C. 3p3 表示 3p 能级有三个轨道 D. SO3与 CO32-互为等电子体 ,且它们中心原子都是 sp3 杂化 10. 下列关于化学能转化为电能的四种装置的说法正确的是 A. 电池 I 中锌是正极 B. 电池 II 是一次性电池 C. 电池III 工作时,氢气发生还原反应 D. 电池IV工作时 ,电子由锌通过导线流向碳棒 二 、选择题( 本题共 10 小题,每小题只有—个选项符合题意 ,每小题 3 分,共 30 分) 11合成氨反应的化学方程式为:N2( g) + 3H 2 ( g) 2NH3 ( g) 。一定条件下,下列 说法能充分说明该反应已经达到化学平衡状态的是 A. 每消耗 1 mol N2的同时,有 2 mol NH 3 生成 B. 正、逆反应速率相等且都等于零 C. H 2 、N2 、NH 3 的浓度均不再变化 D. H 2 、NH3 、N2 在容器中共存 1 2. 根据 的结构,它不可能发生的反应是 A. 水解反应 B. 使溴的四氯化碳溶液褪色 C. 与乙醇在浓硫酸催化下发生酯化反应 D. 与碳酸钠溶液反应 13. 已知 H2O2 在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是 A. 加入催化剂,减小了反应的热效应 B. 加入催化剂,可提高H2O2 的平衡转化率 C. H2O2分解的热化学方程式:H2O2 =H2O 十1/ 2 O2 ΔH < 0 D. 反应物的总能最高于生成物的总能量 14. 常温下,稀释 0. 1 mol • L-1 Na2SO3溶液 ,下图中的纵坐标可以表示 A. SO32-水解的平衡常数 B. 溶液的 pH C. 溶液中 HSO3-的数目 D. 溶液中的 c( SO32-) 15 . 已知有机物 M 在一定条件下可转化为 N。下列说法正确的是 A. 该反应类型为取代反应 B. N 分子中所有碳原子一定共平面 C. M 中苯环上的一氯代物共有 4 种 D. 可用溴水鉴别 M 和 N 16. 可逆反应 :aA(g) +bB(s) cC(g) + dD(g), 当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度 ( T) 、压强( p ) 的关系如下图所示,下列判断正确的是 A. T1< T 2 ΔH > 0 B. T1 > T 2 ΔH < 0 C. P1 < P2 a = c+ d D. P1 < P2 a + b= c+ d 17 . 如图是第三周期 11 ~ 17 号元素某些性质变化趋势的柱形图(横坐标表示原子序数依次递增),下列有关说法中正确的是 A. y 轴表示的可能是第 一电离能 B. y 轴表示的可能是电负性 C. y 轴表示的可能是原子半径 D. y 轴表示的可能是形成基态离子转移的电子数 18. 下列说法不正确的是 A. pH > 7 的溶液不一定呈碱性 B. 中和 pH 和体积均相等的氨水、NaOH 溶液 ,所需 HCl 的物质的量相同 C. 相同温度下 ,pH 相等的盐酸 、CH3COO H 溶液中 ,c (OH-) 相等 D. 氨水和盐酸反应后的溶液,若溶液呈中性 ,则 c( Cl -) = c( NH4+ ) 19. 25 °C 时,用一定浓度 NaOH 溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如下图所示 ,其中 b 点为恰好反应点。下列说法不正确的是 A. 溶液的导电能力与离子种类和浓度有关 B. b 点溶液的 pH = 7 C. a→c 过程中 ,n ( CH3COO-) 不断增大 D. c点的混合溶液中,c( Na+)> c (OH-)> c( CH3COO-) 20 . 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为 LiCoO2+6C Li1-xCoO2+LixC6,结构如下图所示。下列说法正确的是 A. 放电时,正极质量增加 B. 充电时,锂离子由右向左移动 C. 该锂离子电池工作时,正极锂元素化合价降低 D. 充电时,阳极的电极反应式为:Li1-xCoO2+ xLi+ + xe- = LiCoO2 三、填空题( 本题共 4 小题,共 50 分) 21. ( 11 分)已知水在 25 °C 和 100 °C 时,电离平衡曲线如下图所示: (1 ) 25 °C 时水的电离平衡曲线应为 (填“A” 或“B”)。 ( 2 ) 常温下 ,某溶液中由水电离的 c( H +)=l × l0- 13 mol• L-1,该溶液可能是 ①二氧化硫水溶液 ② 氯化铵水溶液 ③ 硝酸钠水溶液 ④氢氧化钠水溶液 A. ①④ B. ①② C. ②③ D.③④ ( 3 ) 侯氏制碱法广泛用于工业制纯碱( Na 2CO3 ) , 是我国科学家为人类做出的重大贡 献。现有 25 °C 时,浓度为 0. 10 mol• L-1 Na 2CO3 溶液。请回答: ①该溶液中 c( H +) c( OH-) (填“> ”、“< ”或“=”)。 ②用离子方程式解释① 的原因 。 ( 4) 已知在 25 °C 时,醋酸和亚硫酸的电离平衡常数分别为 : 醋酸: K = l. 75× l0- 5 亚硫酸: K1= 1. 54 ×10 - 2 K2 = 1. 02 × 10 -7 ① 25 °C 时,相同浓度的醋酸和亚硫酸溶液的酸性强弱: CH3COOH H 2SO3 (填“> ”、“< ”或“=”)。 (2) 25 °C 时,向0.10 mol• L-1 CH3COOH 溶液中加入少量盐酸,若溶液中c( OH-) 为 1. 0 ×10 - 12 mol•L-1 , 则该溶液的 pH = 。 ③向 0. 10 mol•L-1 的 CH3COO Na 溶液中加入少量水,比 值的变化情况是 (填“增大”、“减少” 或“不变”) 。 22 . (1 2 分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景 。 (1 ) 工业上一般采用下列两种反应合成甲醇: 反应 I :CO ( g) + 2H2(g) CH3OH ( g) ΔH 1 反应 II ::CO2(g)+ 3H2 ( g) CH3OH(g) + H2O( g) ΔH2 ①上述反应符合“原子经济”原则的是 (填“I ” 或“ II ”) ②下表所列数据是反应 I 在不同温度下的化学平衡常数 (K ) : 温度 250°C 300°C 350°C K 2. 041 0. 270 0. 012 由表中数据判断ΔH 1 0 (填“> ”、“< ”或“=”)。 ③某温度下 ,将 2 mol CO 和 6 mol H2 充入 2 L 的密闭容器中,充分反应,达到平衡后,测得 n ( CO) = 0. 4 mol, 则 CO的转化率为 ,此时的温度为 °C (从上表中选择)。 ( 2 ) 已知在常温常压下 : ①2CH3OH (l) + 3O2(g) = 2CO2(g) + 4 H2O( g) ΔH = —1 275 . 6 kJ• mol-1 ② 2CO ( g) + O2 ( g) = 2CO2(g) ΔH = — 566. 0 kJ• mol-1 写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方 程式 。 ( 3) 用下图所示的装置电解 K2SO4溶液同时制备 H2SO4和 KOH 溶液, II 中装入 K2SO4溶液( a、b 是离子交换膜),下列有关分析正确的是 。 A. I 区生成H2SO4 B. a 是阴离子交换膜 C. II 区中的 K+ 进入 I 区 D.III区溶液的 pH 会升高 23 . (1 4 分)东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币 ,亦可用于制作仿银饰品。回答下列间题: (l ) 镍元素基态原子的电子排布式为 ,3d 能级上的未成对电子数为 。 ( 2 ) 硫酸镍溶于氨水形成 [ Ni( NH3 )6] SO4 蓝色溶液 。 ①[ Ni( NH3 )6] SO4 中 SO42- 的空间立体构型是 。 ②在[ Ni( NH3 )6] 2+ 中 Ni2-与 NH3之间形成的化学键称为 。 ③ 氨的沸点 (填“高于”或“低于”)膦 ( PH3 ) , 原因是 。 氨分子中 ,中心原子的轨道杂化类型为 。 ( 3 ) 单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu = 1958 kJ • mol-1、INi= 1 753 kJ • mol- l,ICu > INi的原因是 。 ( 4 ) 某镍白铜合金的立方晶胞结构如右图所示。 若合金的密度为 d g• cm-3 , 晶胞参数 a = nm 。 24. (1 3 分)醇酸树脂,附着力强 ,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广泛的应用。下面是一种醇酸树脂 G 的合成路线: 已知: RCH2CH = CH 2 (l) A 物质的名称为 。 ( 2 ) 反应⑤的反应类型为 。 ( 3 ) F 的结构简式为 。 ( 4 ) 反应①的化学方程式为 。 反应的④化学方程式为 。 ( 5 ) 写出符合下列条件的 F 的一种同分异构体的结构简式 。 ①1 mol该物质与 4 mol 新制 Cu(OH)2悬浊液反应 ② 遇 FeCl3溶液产生显色反应 ③核磁共振氢谱有 3 组峰 ,比值为 1 : 1 : 1 ( 6) 设计由1—溴丙烷( )制备聚丙烯醇的合成路线 ( ) (用流程图表示,无机试剂任选)。 洛阳市 2019 ——2020 学年高二质量检测 化学试卷参考答案 一、选择题(只有一个选项符合题意,共 10 小题,每小题 2 分,共 20 分) 1. A 2. D 3. C 4. B 5. D 6. D 7. A 8. D 9. B 10. D 二、选择题(只有一个选项符合题意,共 10 小题,每小题 3 分,共 30 分) 11.C 12. A 13. D 14. C 15. D 16. C 17. B 18. B 19. B 20 . A 三、填空题( 本题共 4 小题,共 50 分) 21. ( 共 11 分) (l)A (1 分) ( 2) A( 2 分) (3) ) ①< Cl 分) ②CO32-+ H2O HCO3-+ OH- 2 分 ) ( 4 ) ①< Cl 分) ②2( 2 分) ③不变( 2 分) 22 . ( 共 12 分 ) (1 ) ① I (2 分 ) ② < ( 2 分) ③80 % ( 2 分) 250 ( 2 分) ( 2) CH3O H (l ) + O2 (g) = CO ( g) + 2 H2O ( g) ΔH = — 354. 8 kJ • mol-1 ( 2 分) (3)C ( 2 分) 23 . ( 共 14 分) (1)[ Ar ] 3d8 4s2(2 分) 2 (1 分 ) ( 2 ) ①正四面体 ( 2 分) ② 配位键(1 分) ③高于(1 分) NH3 分子间可形成氢键(1 分) sp3 ( 2 分) ( 3 ) 铜失去的是全充满的 3 d10电子,镍失去的是 4s1 电子( 2 分) (4)×107( 2 分) 24 . ( 共 13 分) (1 ) 丙烯 (1 分) (2)缩聚反应(1分) (3) (1 分 ) ( 4 ) ①+ NaOH CH 2= CH — CH3+ NaBr + H2O( 2 分) ④+O2+ 2 H2O( 2 分 ) ( 5 ) 或 或或 ( 2 分 ) (任意写出一种即可,其它合理答案也可) ( 6 ) CH3CH2CH2Br CH2 = CH CH3 CH2 = CHCH2Br CH2 = CHCH2OH ( 每步 1 分,共 4 分) 查看更多