2020届二轮复习物质结构元素周期律作业(全国通用)(3)
物质结构 元素周期律
1.(2019·上海市宝山区高考化学二模)15C-NMR(核磁共振)可用于含碳化合物的结构分析,14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( C )
A.13C与15N具有相同的中子数
B.13C与C60是同一种物质
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
[解析] A.13C的中子数=13-6=7,15N的中子数=15-7=8,故A错误; B.13C是一种原子,C60是由碳原子形成的分子,故B错误; C.15N与14N的质子数相同,中子数不同,故互为同位素,故C正确; D.15N的核外电子数=质子数=7,中子数=15-7=8,故D错误; 故选C。
2.(2019·河南省平顶山市高考化学二调)短周期元素a、b、c、d的原子序数依次增大。a、b能组成常温下呈液态的两种常见化合物。b和d位于同主族。已知:a2b和c2d3混合发生剧烈反应生成白色沉淀和无色气体。下列说法正确的是( D )
A.气态氢化物稳定性:d>b
B.原子半径:d>c>b>a
C.a2db3化合物能促进水电离
D.工业上电解熔融c2b3冶炼c单质
[解析] 短周期元素a、b、c、d的原子序数依次增大,a、b能组成常温下呈液态的两种常见化合物,H2O、H2O2是常见的组成元素相同的液态化合物,根据分析可知:a为H元素,b为O元素,c为Al元素,d为S元素。 A.非金属性S<O,则H2O比H2S稳定,即气态氢化物稳定性:d<b,故A错误; B.电子层越多原子半径越大,同一周期从左向右原子半径逐渐减小,则原子半径Al>S>O>H,故B错误; C.H2SO3为弱酸,电离出的氢离子抑制了水电离,故C错误; D.工业上,电解熔融的Al2O3制备铝单质,故D正确; 故选D。
3.(2019·河南省郑州市高考化学二模)R、W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Y同主族,R的最外层电子数是次外层电子数的2倍。W元素形成的一种单质可用于自来水的杀菌消毒。R与W元素原子的最外层电子数之和等于X与Z元素原子的最外层电子数之和。下列说法正确的是( D )
A.简单离子的半径:W
R>X
C.X与Z形成的化合物溶于水可抑制水的电离
D.最高价氧化物的熔点:Y>R
[解析] R、W、X、Y、Z为原子序数依次增大的短周期主族元素,R的最外层电子数是次外层电子数的2倍,R含有2个电子层,最外层含有4个电子,为C元素;W元素形成的一种单质可用于自来水的杀菌消毒,该单质为臭氧,则W为O元素,W与Y同主族,则Y为S元素;Z为短周期主族元素,原子序数大于S,则Z为Cl元素;R与W元素原子的最外层电子数之和等于X与Z元素原子的最外层电子数之和,则X最外层电子数=4+6-7=3,位于ⅢA族,原子序数大于O,则X为Al元素,根据分析,A.离子的电子层越多离子半径越大,电子层数相同时,核电荷数越大离子半径越小,则简单离子半径:W<Z<Y,故A错误; B.没有指出最高价,无法比较C、Cl的含氧酸酸性,故B错误; C.X与Z形成的化合物为氯化铝,铝离子水解促进了水的电离,故C错误; D.三氧化硫和二氧化碳都属于分子晶体,相对原子质量越大沸点越高,则最高价氧化物的熔点:Y>R,故D正确; 故选D。
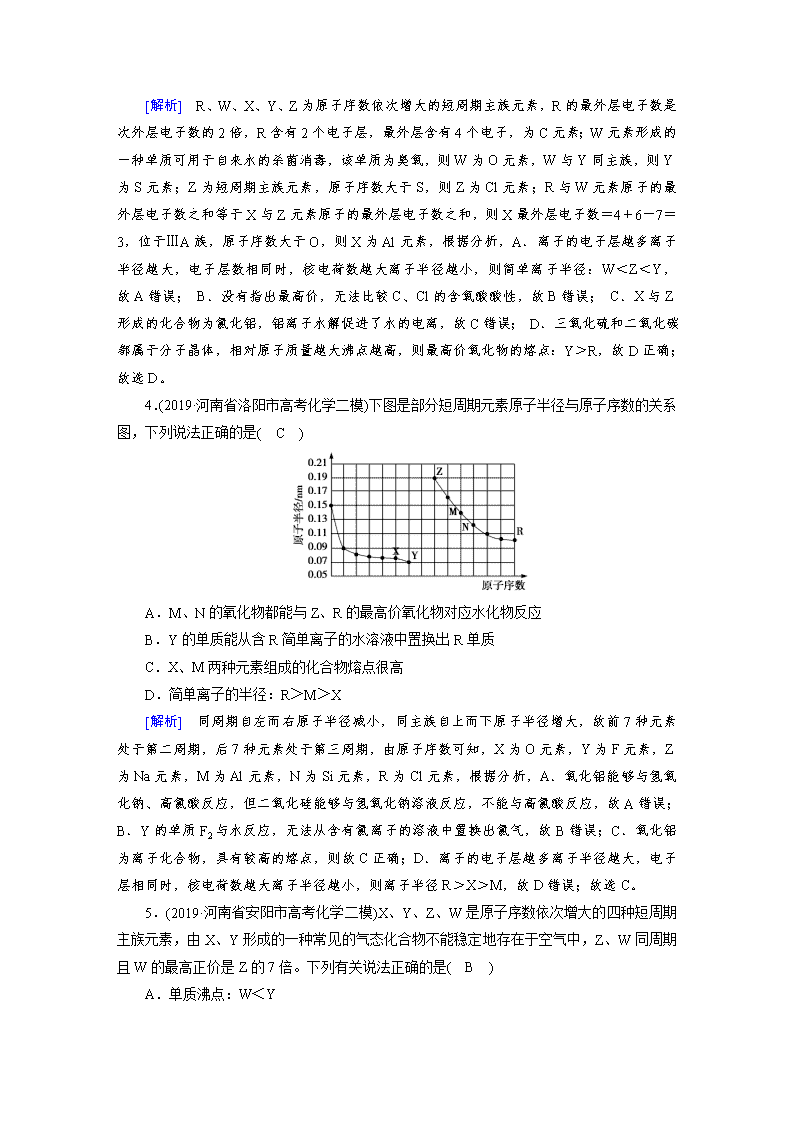
4.(2019·河南省洛阳市高考化学二模)下图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( C )
A.M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B.Y的单质能从含R简单离子的水溶液中置换出R单质
C.X、M两种元素组成的化合物熔点很高
D.简单离子的半径:R>M>X
[解析] 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素,根据分析,A.氧化铝能够与氢氧化钠、高氯酸反应,但二氧化硅能够与氢氧化钠溶液反应,不能与高氯酸反应,故A错误;B.Y的单质F2与水反应,无法从含有氯离子的溶液中置换出氯气,故B错误;C.氧化铝为离子化合物,具有较高的熔点,则故C正确;D.离子的电子层越多离子半径越大,电子层相同时,核电荷数越大离子半径越小,则离子半径R>X>M,故D错误;故选C。
5.(2019·河南省安阳市高考化学二模)X、Y、Z、W是原子序数依次增大的四种短周期主族元素,由X、Y形成的一种常见的气态化合物不能稳定地存在于空气中,Z、W同周期且W的最高正价是Z的7倍。下列有关说法正确的是( B )
A.单质沸点:W<Y
B.简单离子半径:W>X>Y>Z
C.含氧酸的酸性:W>X
D.Z与Y形成的化合物中只含离子键
[解析] X、Y、Z、W是原子序数依次增大的四种短周期主族元素,由X、Y形成的一种常见的气态化合物不能稳定地存在于空气中,该化合物为NO,则X为N,Y为O元素;Z、W同周期且W的最高正价是Z的7倍,二者位于第三周期,则Z为Na元素,W为Cl元素,据此解答。根据分析可知:X为N,Y为O,Z为Na,W为Cl元素。A.氧气和氯气都属于分子晶体,相对分子质量越大沸点越高,则单质沸点W>Y,故A错误;B.离子的电子层越多离子半径越大,电子层相同时,核电荷数越大离子半径越小,则简单离子半径:W>X>Y>Z,故B正确;C.没有指出最高价,该关系不一定成立,如硝酸的酸性大于次氯酸,故C错误;D.Na、O形成的过氧化钠中除了含有离子键,还含有共价键,故D错误;故选B。
6.(2019·江苏省苏、锡、常、镇四市高三(下)第二次模拟)短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y为金属元素,且Y的原子序数小于X和Z的最外层电子数之和,Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是( D )
A.原子半径:r(W)>r(Y)>r(X)
B.X与Y组成的化合物中均不含共价键
C.Z的简单气态氢化物的热稳定性比W的强
D.WX2是一种高效安全灭菌消毒剂
[解析] Z原子的最外层电子数与核外电子总数之比为3∶8,即最外层电子数与内层电子数之比为3∶5,则Z原子的核外有三层,即Z元素为S;X、Z同主族,则X元素为O,Y的原子序数大于8且小于X和Z的最外层电子数之和12,所以金属元素Y为Na,短周期主族元素X、Y、Z、W原子序数依次增大,所以W元素为Cl, A.Na是短周期主族元素中原子半径最大的元素,Cl元素原子比O多一电子层; B.X与Y组成的化合物有Na2O或Na2O2,其中Na2O2由钠离子和过氧根离子构成; C.S、Cl位于同一周期并且Cl原子半径大,同一周期中,非金属元素的非金属性随原子序数的增大而增大; D.WX2即ClO2,ClO2有强氧化性,可用于杀菌消毒。故选D。
7.(2019·安徽省蚌埠市高考化学二模)W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01 mol·L-1戊溶液的pH大于2,上述物质转化关系如图所示。下列说法正确的是( C )
A.原子半径:Z>Y>X>W
B.W、X、Y、Z不可能同存于一种离子化合物中
C.W和X形成的化合物既可能含有极性键也可能含有非极性键
D.比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
[解析] W、X、Y、Z为原子序数依次增大的短周期主族元素,丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态,考虑丁为H2O,可推知W为氢元素。甲、乙分别是元素Y、Z的单质,其中Y元素在同周期中离子半径最小,甲与乙化合生成丙,丙与水反应生成戊,戊为酸性气体,常温下0.01 mol·L-1戊溶液的pH大于2,戊溶液为弱酸,应是Al2S3与水反应生成H2S与Al(OH)3,故丙为Al2S3、戊为H2S、己为Al(OH)3,结合原子序数可知X为氧元素、Y为Al、Z为硫元素,故甲为O2、乙为硫单质。A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:Y(Al)>Z(S)>X(O)>W(H),故A错误;B.H、O、Al、S可能同存于一种离子化合物中,如KAl(SO4)2·12H2O,故B错误;C.W和Ⅹ形成的化合物有H2O、H2O2,H2O2中既含有极性键也含有非极性键,故C正确;D.氧元素没有最高价氧化物,不能通过比较最高价氧化物对应的水化物的酸性判断O、S的非金属性,故D错误。故选C。
8.(2019·福建省漳州市高考化学二模)短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是( A )
A.最简单氢化物的稳定性:Z>W>Y
B.原子半径:Y>X>W
C.X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝
D.Y的氧化物既能与碱反应,也能与酸反应,属于两性氧化物
[解析] 短周期主族元素W、X,Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,则W位于第二周期,Y位于第三周期;X原子的最外层电子数等于周期数,X可能为B或Al元素;X为B元素时,X、Y、Z的最外层电子数之和=18-2=16,X为Al元素时,X、Y、Z的最外层电子数之和=18-3=15,X、Y、Z的最外层电子数的平均值大于5,结合Z的原子序数大于Y,且Z的单质在常温下为气体可知,Z为Cl元素;X为B元素时,W、Y的最外层电子数之和=18-7-4=7,不可能;当X为Al元素时,W、Y的最外层电子式之和为18-7-3=8,则W为C元素,Y为Si元素,符合条件,据此解答。根据分析可知:W为C元素,X为Al元素,Y为Si元素,Z为Cl元素。 A.非金属性Cl>C>Si,则简单氢化物的稳定性Z>W>Y,故A正确; B.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:X>Y>W,故B错误; C.X与Z形成的化合物为氯化铝,氯化铝溶液呈酸性,不能使红色石蕊试纸变蓝,故C错误; D.二氧化硅不与硝酸、硫酸、盐酸等强酸反应,能够与碱溶液反应,属于酸性氧化物,故D错误; 故选A。
9.(2019·广东省肇庆市高考化学二模)已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W与Z同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是( D )
A.X与Y形成的其中一种化合物中阴阳离子的个数比均为1∶2
B.简单氢化物Y比R的稳定、且熔沸点高
C.RY2和X2Y2均具有漂白性,均能使品红试液褪色
D.RY2和WY2通入Ba(NO3)2溶液中均不产生白色沉淀
[解析] X的原子半径在短周期主族元素中最大,则X是Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,则Y为O元素,Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2∶1,Y的核外电子数为8,则R的核外电子数为16,则R为S元素,据此解答。由分析可知:X为Na、Y为O、Z为Si、W为C元素、R为S元素。 A.X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阴、阳离子的个数比均为1∶2,故A正确; B.Y是O元素,R是S元素,元素的非金属性越强其氢化物越稳定,氧元素的非金属性大于硫元素,所以水的稳定性大于硫化氢,且水中含有氢键,沸点高,故B正确; C.二氧化硫和过氧化钠都具有漂白性,都可使品红褪色,但原理不同,二氧化硫发生化合反应,过氧化钠具有强氧化性,故C正确; D.二氧化硫具有还原性,酸性条件下可被硝酸根离子氧化生成硫酸根离子,可生成硫酸钡沉淀,故D错误; 故选D。
10.(2019·陕西省高三第二次模拟联考)X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,下列说法不正确的是( B )
A.R的氧化物都含有离子键
B.最高价含氧酸的酸性:ZW>M
B.原子半径:XM>Y
[解析]
X、Y、Z、M、W为5种短周期主族元素且原子序数依次增大。X有三种核素,质量数之比为1:2:3,则X为H元素;Y是植物生长所需的三大营养元素之一,则Y为N元素;Z和M同主族,Z只能为第二周期元素,若Z为O,则M为S元素,W为Cl元素;若Z为F元素,则M为Cl,W只能为Ar,但Ar不是主族元素,所以Z为O,则M为S元素,W为Cl元素,据此进行解答。根据分析可知,X为H,Y为N元素,Z为O,则M为S元素,W为Cl元素,A.氮气和氯气常温下为气体,而S单质为固态,则单质沸点Y<W<M,故A错误;B.电子层越多原子半径越大,电子层相同时核电荷数越大原子半径越小,则原子半径:X<Z<Y<M,故B错误;C.H、O、N可以形成硝酸铵,硝酸铵属于离子化合物,含有离子键,故C正确;D.氨气水溶液呈碱性,硫化氢水溶液为弱酸,HCl溶液为强酸,则等物质的量浓度水溶液的pH:W<M<Y,故D错误;故选C。
13.(2019·浙江省十二校高三第一次联考)四种短周期元素W、X、Y和Z在周期表中的位置如图所示,四种元素原子的最外层电子数之和为22。下列说法正确的是( D )
W
X
Y
Z
A.氢化物的沸点:X<Z
B.最高价氧化物对应水化物的酸性:Y>W
C.化合物熔点:YX2<YZ4
D.简单离子的半径:X<W
[解析] 根据元素在周期表中的位置知,W、X是第二周期元素而Y和Z位于第三周期,设W原子最外层电子数是a,则X、Y、Z原子序数分别是a+1、a-1、a+2,这四种元素的原子最外层电子数之和为22,则a+a+1+a-1+a+2=22,则a=5,则X、Y、Z、W分别是O、Si、Cl、N元素;A.NH3和SiH4均为分子晶体,NH3分子间存在氢键,其沸点比SiH4高,故A错误;B.N元素的非金属性比Si元素强,HNO3的酸性比H2SiO3酸性强,故B错误;C.二氧化硅是原子晶体,四氯化硅是分子晶体,原子晶体的熔点高,即SiO2的熔点比SiCl4高,故C错误;D.N3-和O2-离子结构相同,核电荷数越大,离子半径越小,则N3->O2-,故D正确;故选D。
14.(2019·广东省佛山市高考化学一模)已知W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20,Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。W、X、Y均能与Z形成离子化合物。下列说法错误的是( B )
A.X、Z两元素的简单离子电子层结构相同
B.X与Z形成的离子化合物一定只含有离子键
C.Y的氢化物比X的氢化物稳定
D.W与Y形成的化合物WY可刻蚀玻璃
[解析] W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20。Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质,可知m为H2
O,结合原子序数、元素的位置及性质可知,Y为F、X为O、Z为Na、W为H,且W、X、Y均能与Z形成离子化合物,以此来解答。 A.X、Z两元素的简单离子的核外电子数均为10,则电子层结构相同,故A正确; B.X与Z形成的离子化合物若为过氧化钠,含离子键及共价键,故B错误; C.非金属性越强,对应氢化物越稳定,则Y的氢化物比X的氢化物稳定,故C正确; D.W与Y形成的化合物为HF,可刻蚀玻璃,故D正确; 故选B。
15.(2019·四川省广元市高考化学一诊)已知元素X、Y、Z、W均为短周期元素,其中X、Y、Z位于同一周期,其原子核外均有三个电子层且价电子数依次增大1,Y2+与W-具有相同的电子层结构,下列说法正确的是( A )
A.离子半径:W->Y2+
B.X的氧化物中只含有离子键
C.W的最高正化合价为+7
D.工业上常用电解Z的氯化物来制备Z的单质
[解析] 已知X、Y、Z、M 四种元素均为短周期元素,Y2+与M-具有相同电子层结构,其原子核外均有三个电子层且价电子数依次增大1,可知Y为Mg,X为Na,Z为Al,则W为F元素,结合原子结构,元素性质解答。 A.F、Mg对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故A正确; B.如为过氧化钠,含有离子键和共价键,故B错误; C.F无正价,故C错误; D.氯化铝不导电,工业电解熔融的氧化铝冶炼铝,故D错误。 故选A。
16.(2019·四川省绵阳市高考化学二诊)W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W为空气中含量最多的元素,四种元素中X的原子半径最大,Y的周期数等于其族序数,Z的最外层电子数是最内层电子数的3倍。下列叙述错误的是( D )
A.W、X、Y的最高价氧化物的水化物可两两反应生成盐和水
B.W、X、Z均可形成两种或两种以上的氧化物
C.简单离子的半径:Y<X<W<Z
D.含Y元素的盐溶液一定呈酸性
[解析] W、X、Y和Z为原子序数依次增大的四种短周期主族元素,W为空气中含量最多的元素,为N元素; Z的最外层电子数是最内层电子数的3倍,其最外层有6个电子,为S元素; Y的周期数等于其族序数,原子序数大于W而小于Z,为Al元素; 四种元素中X的原子半径最大,则X为Na元素;通过以上分析知,W、X、Y、Z分别是N、Na、Al、S元素,据此分析解答。 A.W、X、Y分别是N、Na、Al元素,其最高价氧化物的水化物是硝酸、氢氧化钠、氢氧化铝,其最高价氧化物的水化物能两两相互反应生成盐和水,故A正确; B.W、X、Z分别是N、Na、S元素,N可以形成NO、NO2等氧化物,Na可以形成氧化钠、过氧化钠,S可以形成二氧化硫、三氧化硫,故B正确; C.
离子核外电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,W、X、Y、Z离子核外电子层数分别是2、2、2、3,且原子序数W<X<Y,所以离子半径Y<X<W<Z,故C正确; D.含有Y的盐溶液可能呈酸性,如氯化铝等,可能呈碱性,如偏铝酸钠溶液,故D错误; 故选D。
17.(2019·四川省乐山市高考一模)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原子最外层电子数之和为24。下列说法正确的是( C )
A.元素X和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(X)
C.气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D.元素Z的氧化物对应水化物都是强酸
[解析] 由短周期元素X、Y、Z、W在元素周期表中的相对位置可知,X、W位于第二周期,四种原子最外层电子数之和为24,设X的最外层电子数为x,则x+x+1+x+x-1=24,解得x=6,可知X为O、W为F、Y为P、Z为S,以此来解答。A.X为O,不存在最高正价,故A错误; B.具有相同电子排布的离子中原子序数大的离子半径小,则单核阴离子半径的大小顺序为:r(W)<r(X),故B错误; C.非金属性越强,对应氢化物越稳定,则气态简单氢化物的热稳定性顺序为:Y<Z<X<W,故C正确; D.元素Z的氧化物对应水化物若为亚硫酸,属于弱酸,故D错误; 故选C。
18.(2019·四川省内江市高考化学一模)X、Y、Z、M、G五种短周期元素原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子;Y、G的单质或两元素之间形成的化合物可作水消毒剂。下列叙述正确的是( C )
A.元素M的氧化物对应的水化物酸性比G的弱
B.化合物Z2M、MY2中化学键的类型相同
C.ZX与水的反应属于氧化还原反应
D.简单离子半径的大小顺序:X<Y<Z<M<G
[解析] X、Y、Z、M、G五种短周期元素原子序数依次增大。X、Z同主族,可形成离子化合物ZX,该化合物为NaH,则X为H、Z为Na元素;Y、M同主族,可形成MY2、MY3两种分子,MY2、MY3为SO2、SO3,则Y为O、M为S元素;Y(O)、G的单质或两元素之间形成的化合物可作水消毒剂,G的原子序数大于S,则G为Cl元素,据此进行解答。根据分析可知,X为H、Y为O、Z为Na、M为S、G为Cl元素,A.元素M(S)的最高价氧化物对应的水化物酸性比G(Cl)的弱,但没有指出最高价氧化物,该关系不一定成立,故A错误; B.Z2M、MY2分别为Na2S、SO2,前者为离子化合物,后者为共价化合物,二者含有化学键类型不同,故B错误; C.NaH与水反应生成氢氧化钠和氢气,该反应为氧化还原反应,故C正确; D.
电子层越多离子半径越大,电子层相同时,离子的核电荷数越大离子半径越小,则简单离子半径的大小顺序:X<Z<Y<G<M,故D错误; 故选C。
19.(2019·河南八市重高联盟高三第三次测评)短周期主族元素X、Y、Z、M、N的原子序数依次增大。X和M的原子核外最外层电子数是周期数的二倍,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应。下列叙述正确的是( B )
A.元素非金属性由弱到强的顺序:M、N、X
B.原子最外层电子数由少到多的顺序:Y、Z、X、M、N
C.电解熔融的N和Z形成的化合物可得到对应的N和Z的单质
D.单质Y的熔点高于单质Z的熔点
[解析] X和M的原子核外最外层电子数是周期数的二倍,说明X为第二周期最外层有4个电子,即为碳元素,M为第三周期最外层有6个电子,为硫元素,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应,说明为钠、铝和氯元素。X、Y、Z、M、N分别为C、Na、Al、S、Cl。A项非金属性由弱到强的顺序是X、M、N,A错;B项五种元素最外层电子数分别为4、1、3、6、7,所以顺序为Y、Z、X、M、N,故正确;C项AlCl3属共价化合物,熔融态不导电,C错;D项单质钠的熔点低于单质铝的熔点,D错。故选B。
20.(2019·陕西省榆林市高考三模)短周期主族元素X、Y、Z、W原子序数依次增大,且位于不同的主族,其主族序数之和等于前三周期元素的种类数,X原子的核外电子数等于Y的最外层电子数,短周期主族元素中Z的原子半径最大。下列说法正确的是( A )
A.一定条件下,X和Z的单质与水反应均生成H2
B.Y的氢化物的沸点低于硫化氢
C.Z与Y和W分别形成1∶1的化合物中,所含化学键完全相同
D.W是所在周期中金属性最强的元素
[解析] 短周期主族元素X、Y、Z、W原子序数依次增大,短周期主族元素中Z的原子半径最大,则Z为Na元素;四种元素主族序数之和等于前三周期元素的种类数,即为18,则X、Y、W的主族序数之和为18-1=17,平均为>5,且位于不同的主族,X原子的核外电子数等于Y的最外层电子数,Y的原子序数小于Na,X、Y只能位于第二周期,W的主族序数最大为Ⅶ,Y的族序数大于X,则Y的主族序数>=5,当Y为O时,X为C元素,W为Cl元素,满足条件;Y为F时,X为N,W为P,P、N同主族,不满足条件,据此解答。根据分析可知,X为C,Y为O,Z为Na,W为Cl元素。A.碳单质与水蒸气在高温下反应生成CO和氢气,钠与水反应生成氢氧化钠和氢气,故A正确;B.水分子之间存在氢键,则水的沸点大于硫化氢,故B错误;C.O与Na形成的过氧化钠中含有离子键和共价键,Na与Cl形成的NaCl中只含有离子键,二者含有化学键类型不完全相同,故C错误;D.W为Cl,Cl元素为第三周期中非金属性最强的元素,故D错误;故选A。
21.(2019·新疆高考化学一诊)A、B、C、D、E、F、G是7种短周期元素,
它们在周期表中的相对位置如下图所示。
(1)A、B、C三元素按原子个数比4∶2∶3形成的盐含有的化学键类型是_共价键、离子键__,C、D两元素形成的淡黄色化合物中,阴阳离子个数比是_1∶2__。
(2)C、D、E各自形成的简单离子中,离子半径由大到小的顺序是_O2->Na+>Al3+__(填离子符号)。
(3)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_Al(OH)3__(写化学式)。
(4)G的单质与F气态氢化物水溶液反应,溶液变浑浊,写出该反应的离子方程式Cl2+H2S===2H++2Cl-+S↓,该实验现象说明非金属性F_<__G(填“>”或“<”)。
(5)写出A2C2与FC2发生化合反应的化学方程式__H2O2+SO2===H2SO4__。标准状况下,1.12 L FC2参与反应,转移的电子个数为_0.1NA__。
[解析] A、B、C、D、E、F、G是7种短周期元素,它们在周期表中的相对位置如下图所示,A位于第一周期ⅠA族,则A为H元素;结合各元素相对位置可知,D为Na元素,B为N元素,C为O元素,E为Al元素,F为S元素,G为Cl元素,据此结合元素周期律知识解答。(1)由H、N、O按原子个数比4∶2∶3形成的盐为NH4NO3,在铵根离子和硝酸根离子内部都有共价键,在铵根离子和硝酸根离子之间形成离子键;O、Na形成的淡黄色固体为过氧化钠,过氧化钠的化学式中含有2个钠离子和1个过氧根离子,则阴阳离子个数比是1∶2;(2)O、Na、Al形成的简单离子分别为O2-、Na+、Al3+,三种离子都含有2个电子层,核电荷数越大离子半径越小,则离子半径大小为:O2->Na+>Al3+;(3)表中所列4种第三周期元素中Na、Al为金属,金属性Na>Al,则最高价氧化物的水化物碱性最弱的是Al(OH)3;(4)氯气与硫化氢反应的离子方程式为:Cl2+H2S===2H++2Cl-+S↓,该反应说明氧化性Cl2>S,则非金属性S
查看更多