2021新高考化学二轮总复习选择题专项练(二) Word版含解析
www.ks5u.com
选择题专项练(二)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.(2019山东德州二模)改革开放40周年我国取得了很多标志性成果,下列说法不正确的是( )
A.“中国天眼”的镜片材料为SiC,属于新型无机非金属材料
B.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C.北斗导航专用ASIC硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为SiO2
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
2.(2020山东菏泽一模)下列有关仪器的使用方法或实验操作正确的是( )
A.用pH试纸测定次氯酸钙溶液的pH,证明次氯酸是弱酸
B.对于碘和铁粉的混合物,可加热,利用碘易升华的特性分离
C.用乙醇和乙酸制取乙酸乙酯过程中忘加碎瓷片,立刻补加防止暴沸
D.用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏高
3.(2020山东新高考全真模拟)下列各微粒的电子排布式或电子排布图不符合能量最低原理的是( )
A.Fe2+ 1s22s22p63s23p63d6
B.Cu 1s22s22p63s23p63d94s2
C.F
D.Na+
4.(2020山东潍坊三模)甲、乙、丙三种有机物的结构简式如下,下列说法正确的是( )
A.甲与溴水加成的产物只有两种
B.乙中所有碳原子共平面
C.丙的二氯代物有4种
D.丙的同分异构体中,属于炔烃的有4种
5.(2020山东青岛一模)我国科研人员发现了一种新型超导体Bi3O2S2Cl,该超导体由[Bi2O2]2+和[BiS2Cl]2-交替堆叠构成。已知Bi位于第六周期ⅤA族,下列有关说法错误的是( )
A.Bi的价电子排布式为5d106s26p3
B.有关元素的电负性:O>Cl>S
C.Bi3O2S2Cl属于含共价键的离子化合物
D.该新型超导体的组成元素全部位于元素周期表p区
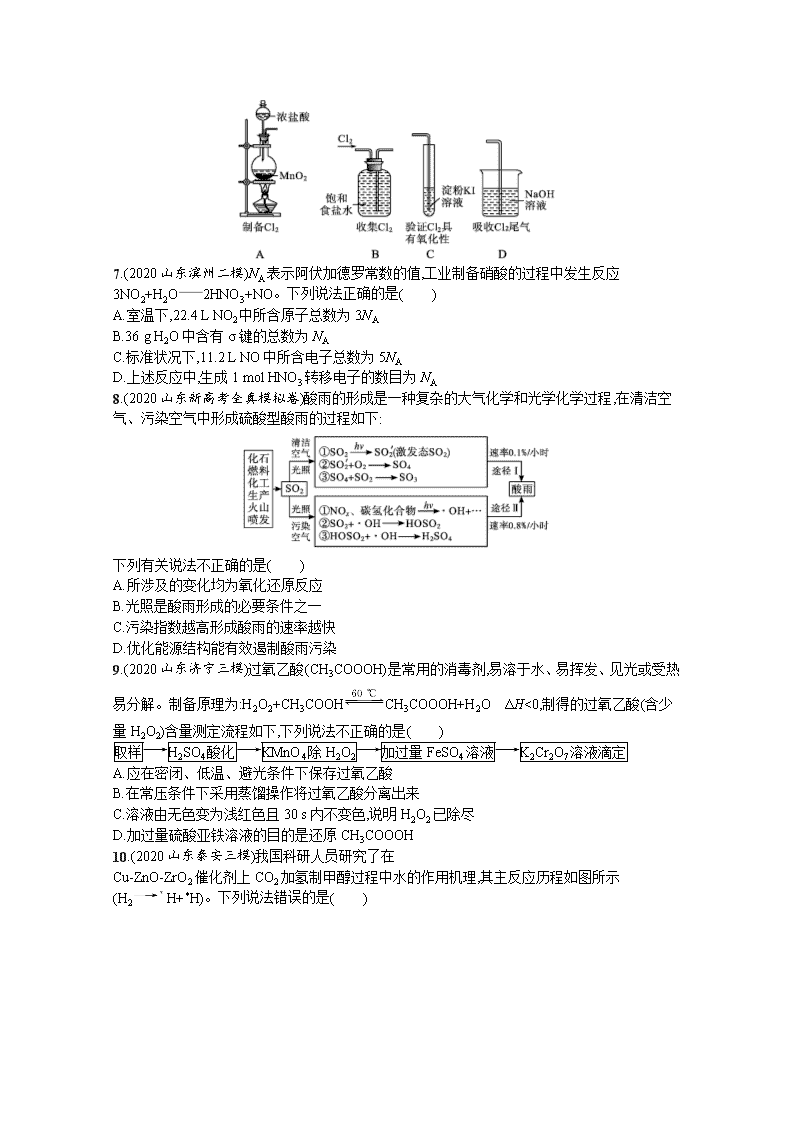
6.(2020江苏泰州二模)下列有关实验室氯气的制备、收集、性质检验及尾气处理的装置中,错误的是( )
7.(2020山东滨州二模)NA表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应3NO2+H2O2HNO3+NO。下列说法正确的是( )
A.室温下,22.4 L NO2中所含原子总数为3NA
B.36 g H2O中含有σ键的总数为NA
C.标准状况下,11.2 L NO中所含电子总数为5NA
D.上述反应中,生成1 mol HNO3转移电子的数目为NA
8.(2020山东新高考全真模拟卷)酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:
下列有关说法不正确的是( )
A.所涉及的变化均为氧化还原反应
B.光照是酸雨形成的必要条件之一
C.污染指数越高形成酸雨的速率越快
D.优化能源结构能有效遏制酸雨污染
9.(2020山东济宁三模)过氧乙酸(CH3COOOH)是常用的消毒剂,易溶于水、易挥发、见光或受热易分解。制备原理为:H2O2+CH3COOHCH3COOOH+H2O ΔH<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
取样H2SO4酸化KMnO4除H2O2加过量FeSO4溶液K2Cr2O7溶液滴定
A.应在密闭、低温、避光条件下保存过氧乙酸
B.在常压条件下采用蒸馏操作将过氧乙酸分离出来
C.溶液由无色变为浅红色且30 s内不变色,说明H2O2已除尽
D.加过量硫酸亚铁溶液的目的是还原CH3COOOH
10.(2020山东泰安三模)我国科研人员研究了在
Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2H+*H)。下列说法错误的是( )
A.二氧化碳加氢制甲醇的过程中原子利用率小于100%
B.带*标记的物质是该反应历程中的中间产物
C.Cu-ZnO-ZrO2可提高甲醇的产率
D.第④步的反应式为*HO+*HH2O
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.(2020山东聊城二模)重铬酸钾是工业合成的常用氧化剂和催化剂,如图所示的微生物电池,能利用K2Cr2O7实现对含苯酚(或醛类)废水的有效处理,该电池工作一段时间后,中间室内的NaCl溶液浓度减小,则下列叙述正确的是( )
A.a电极为负极,电子从a电极经过中间室到达b电极
B.M为阳离子交换膜,电解过程中中间室内的n(NaCl)减小
C.处理含苯甲醛的废水时a电极反应式为C6H5CHO-32e-+13H2O7CO2+32H+
D.当b电极消耗等物质的量的K2Cr2O7时,a电极消耗的C6H5OH或C6H5CHO的物质的量之比为8∶7
12.(2020山东日照校际联合)利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2-,制取石膏(CaSO4·2H2O)的过程如下:
下列说法错误的是( )
A.CaSO4·2H2O属于盐类和纯净物
B.过程Ⅱ中,反应的离子方程式为2S2-+4MnO32-+10H+4Mn(OH)2+S2O32-+H2O
C.过程Ⅰ后溶液pH减小
D.将10 L上清液中的S2-(S2-浓度为480 mg·L-1)转化为SO42-,理论上共需要0.15 mol O2
13.(2020山东新高考全真模拟)8.34 g FeSO4·7H2O(相对分子质量为278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法不正确的是( )
A.温度为78 ℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2OFeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
14.(2019山东潍坊高三模拟)25 ℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的负对数值p(SO42-)=-lg c(SO42-)与p(M2+)=-lg(M2+)的关系如图所示,下列说法正确的是( )
A.Ksp(CaSO4)
Cl>S,B正确;Bi3O2S2Cl由[Bi2O2]2+和[BiS2Cl]2-交替堆叠构成,为离子化合物,在原子团内含共价键,属于含共价键的离子化合物,C正确;该新型超导体的组成元素位于ⅢA~ⅦA之间,全部位于元素周期表p区,D正确。
6.A 解析用MnO2和浓盐酸在加热条件下反应可制备出氯气,反应时,浓盐酸应盛放在分液漏斗中,分液漏斗是带旋塞的,图中的长颈漏斗没有旋塞,A项错误;收集氯气可采用向上排空气法或排饱和食盐水法,饱和食盐水可以降低氯气在水中的溶解,
并且一定要注意由短管进气,B项正确;氯气可将KI溶液中的I-氧化为碘单质,从而使淀粉变蓝,因此该装置可用于验证氯气的氧化性,C项正确;氯气有毒,可以利用NaOH溶液对其进行吸收,D项正确。
7.D 解析反应3NO2+H2O2HNO3+NO中,NO2发生歧化反应,NO2中N元素由反应前的+4价变为反应后HNO3中的+5价和NO中的+2价。室温下,不能用22.4L·mol-1计算22.4LNO2的物质的量,A错误;一个水分子中含有2个O—H共价键,都是σ键,H2O的物质的量为36g18g·mol-1=2mol,则含有的σ键总数为4NA,B错误;一个NO分子中含有15个电子,标准状况下,11.2LNO的物质的量为0.5mol,所含的电子总数为7.5NA,C错误;根据反应的化学方程式可知,生成2molHNO3转移2mol电子,故生成1molHNO3转移电子的数目为NA,D正确。
8.A 解析SO2变为激发态SO2,没有化合价变化,并未发生氧化还原反应,A项不正确;结合图中信息可知,产生激发态SO2和·OH自由基都需要光照条件,B项正确;途径Ⅱ的速率大于途径Ⅰ,C项正确;使用化石燃料会产生SO2进而产生酸雨,如果对化石燃料进行优化处理,能有效遏制酸雨污染,D项正确。
9.B 解析取样加硫酸酸化,先用高锰酸钾将过氧化氢除尽后,加过量的硫酸亚铁还原过氧乙酸,再用重铬酸钾溶液滴定过量的硫酸亚铁溶液,从而可得被过氧乙酸氧化的硫酸亚铁的量,进而求得过氧乙酸的含量。过氧乙酸(CH3COOOH)易挥发、见光或受热易分解,应在密闭、低温、避光条件下保存过氧乙酸,A正确;因过氧乙酸受热易分解,常压蒸馏会导致过氧乙酸受热分解,B错误;溶液由无色变为浅红色且30s内不变色,说明高锰酸钾过量,从而证明H2O2已除尽,C正确;加过量的硫酸亚铁还原过氧乙酸,再用重铬酸钾溶液滴定过量的硫酸亚铁溶液,从而确定过氧乙酸的量,D正确。
10.C 解析根据题中图示可知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率小于100%,A正确;根据图示可知,带*标记的物质在反应过程中最终被消耗,所以带*标记的物质是该反应历程中的中间产物,故B正确;Cu-ZnO-ZrO2作为催化剂,只能提高该反应的速率,不能提高甲醇的产率,C错误;第④步中*HO和*H反应生成H2O,反应式为*HO+*H→H2O,D正确。
11.CD 解析根据电池装置图可知,a极上苯酚或苯甲醛反应生成CO2,碳元素化合价升高发生氧化反应,故a极为负极,电子从a电极经过导线到达b电极,A错误;因阴离子向负极移动,阳离子向正极移动,为保证电解质溶液导电的稳定性,M应为阴离子交换膜,中间室内的n(NaCl)减小,B错误;处理含苯甲醛的废水时,苯甲醛中碳元素失电子化合价升高生成CO2,根据元素和电荷守恒,电极反应式为C6H5CHO-32e-+13H2O7CO2+32H+,C正确;b极上,Cr2O72-中铬元素化合价降低生成Cr(OH)3,每消耗1molK2Cr2O7转移6mol电子,当转移6mol电子时,根据电极反应式C6H5OH-28e-+11H2O6CO2+28H+、C6H5CHO-32e-+13H2O7CO2+32H+可知,消耗的C6H5OH与C6H5CHO的物质的量之比为628∶632=8∶7,D正确。
12.BD 解析氧化钙溶于水后生成氢氧化钙,与硫酸锰反应生成氢氧化锰,过程Ⅰ中,通入氧气将氢氧化锰氧化为MnO32-,过程Ⅱ中,MnO32-将上清液中的S2-氧化为S2O32-,同时MnO32-被还原为氢氧化锰,再通入氧气将S2O32-氧化为SO42-,经过浓缩结晶,
可得到石膏。CaSO4·2H2O俗名生石膏,属于结晶水合物,具有固定的组成和性质,属于纯净物里的盐类,A正确;根据转化关系图,过程Ⅱ中S2-与MnO32-生成S2O32-和Mn(OH)2,根据氧化还原反应得失电子守恒和物料守恒可知,该反应的离子方程式为4MnO32-+2S2-+9H2OS2O32-+4Mn(OH)2↓+10OH-,B错误;由分析可知过程Ⅰ中发生反应2Mn(OH)2+O2+4OH-2MnO32-+4H2O,溶液的pH减小,C正确;10L上清液中的S2-的物质的量为10×480×10-3g32g·mol-1=0.15mol,根据物质转化过程可知,S2-转化为S2O32-过程中需要消耗氧气,S2O32-转化为SO42-也需要消耗氧气,在S2-→12S2O32-→SO42-的过程中,硫元素的化合价由-2价变成+6价,S2-共失去0.15mol×8=1.2mol电子,1molO2在反应中得到4mol电子,所以将10L上清液中的S2-转化为SO42-,理论上共需要O2的物质的量=1.24mol=0.3mol,D错误。
13.D 解析8.34gFeSO4·7H2O的物质的量为0.03mol。温度为78℃时,固体质量为6.72g,其中m(FeSO4)=0.03mol×152g·mol-1=4.56g,m(H2O)=6.72g-4.56g=2.16g,n(H2O)=2.16g÷18g·mol-1=0.12mol,则n(H2O)∶n(FeSO4)=0.12mol∶0.03mol=4∶1,则M的化学式为FeSO4·4H2O,A正确;加热至650℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO4·7H2O)=0.03mol,m(Fe)=0.03mol×56g·mol-1=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=0.72g÷16g·mol-1=0.045mol,则n(Fe)∶n(O)=0.03mol∶0.045mol=2∶3,则固体物质Q的化学式为Fe2O3,B正确;固体N的质量为5.10g,其中m(FeSO4)=0.03mol×152g·mol-1=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=0.54g÷18g·mol-1=0.03mol,则n(H2O)∶n(FeSO4)=0.03mol∶0.03mol=1∶1,则N的化学式为FeSO4·H2O,P的化学式为FeSO4,则在隔绝空气条件下由N得到P的化学方程式为FeSO4·H2OFeSO4+H2O,C正确;温度为159℃时,由C项可知N的化学式为FeSO4·H2O,D错误。
14.D 解析根据SO42-最低浓度的负对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)的关系图可知,三种沉淀的Ksp大小顺序为Ksp(CaSO4)>Ksp(PbSO4)>Ksp(BaSO4),A错误;根据图像可知,a点在曲线上,可表示CaSO4的饱和溶液,但是c(Ca2+)>c(SO42-),B错误;图中坐标数值越大,对应离子实际浓度越小,b点在曲线下方,表示PbSO4的过饱和溶液,C错误;由于Ksp(CaSO4)>Ksp(BaSO4),溶解度较大的沉淀可以向溶解度更小的沉淀转化,向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,沉淀由CaSO4转化为BaSO4沉淀,D正确。
15.BC 解析总反应的反应速率取决于最慢的反应,活化能越大,反应速率越慢,根据图像可知活化能大的步骤为第二步反应,其活化能为(E4-E2)kJ·mol-1,A
错误;2NO(g)+O2(g)2NO2(g)平衡常数表达式K=c2(NO2)c2(NO)·c(O2)=c(N2O2)·c2(NO2)c2(NO)·c(N2O2)·c(O2),而对于反应①平衡时正逆反应速率相等,即k1正c2(NO)=k1逆c(N2O2),所以c(N2O2)c2(NO)=k1正k1逆,同理反应②达到平衡时c2(NO2)c(N2O2)·c(O2)=k2正k2逆,所以K=k1正·k2正k1逆·k2逆,B正确;根据图像可知该反应的反应物能量高于生成物能量,所以为放热反应,升高温度,平衡逆向移动,C正确;设等物质的量的NO和O2分别为40mol,NO的平衡转化率为40%,根据三段式分析:
2NO(g)+O2(g)2NO2(g)
起始/mol 40 40 0
转化/mol 16 8 16
平衡/mol 24 32 16
刚性容器中气体的压强比等于物质的量之比,起始气体的总物质的量为80mol,压强为80kPa,则平衡时p(NO)=24kPa,p(O2)=32kPa,p(NO2)=16kPa,Kp=p2(NO2)p(O2)·p2(NO)=16232×242(kPa)-1=172(kPa)-1,D错误。