广东省揭阳市揭西县2020届高三下学期综合测试(一)化学试题(实验班)
化学科综合测练卷一
第1部分
7.化学与生产、生活密切相关。下列叙述错误的是( )
A.生活中可用氢氟酸在玻璃器皿上做标记
B.液态HCl不能导电,说明HCl是共价化合物
C.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
D.“霾尘积聚难见路人”,雾和霾所形成的气溶胶具有丁达尔效应
8.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.71gCl2溶于足量水中,Cl−的数量为NA
B.46g乙醇中含有共价键的数量为7NA
C.25℃时,1L pH=2的H2SO4溶液中含H+的总数为0.02NA
D.标准状况下,2.24L CO2与足量Na2O2反应转移的电子数为0.1NA
9.双酚A是重要的有机化工原料,其结构如图所示。下列关于双酚A的说法正确的是( )
A.双酚A的分子式为C15H14O2
B.一定条件下能发生取代和水解反应
C.最多有13个碳原子在同一平面
D.苯环上的二氯代物有4种
10.右图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
A.W、X对应的简单离子的半径:X>W
B.电解W的氯化物水溶液可以制得W单质
C.实验室可用X和Z形成的某种化合物制取单质X
D.25℃时,Y的最高价氧化物对应水化物的钠盐溶液pH大于7
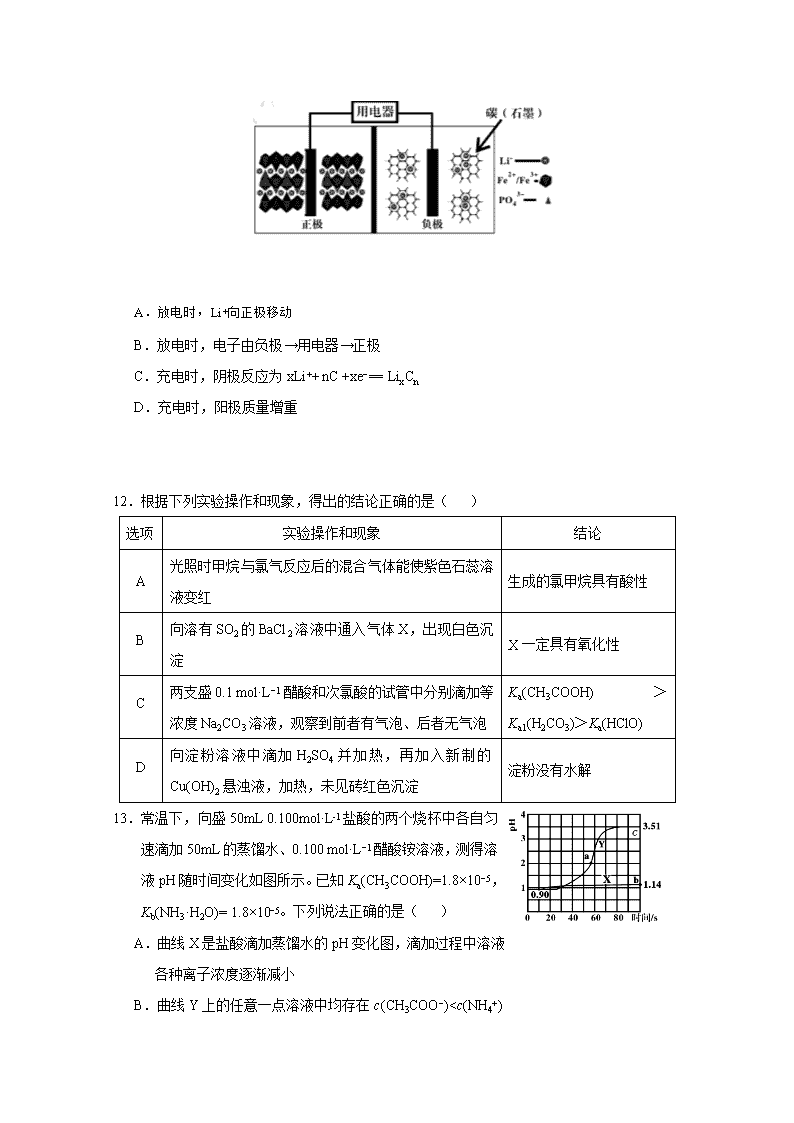
11.高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:
(1− x)LiFePO4+xFePO4+LixCn LiFePO4+nC。
下列说法错误的是( )
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++ nC +xe−= LixCn
D.充电时,阳极质量增重
12.根据下列实验操作和现象,得出的结论正确的是( )
选项
实验操作和现象
结论
A
光照时甲烷与氯气反应后的混合气体能使紫色石蕊溶液变红
生成的氯甲烷具有酸性
B
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X一定具有氧化性
C
两支盛0.1 mol·L−1醋酸和次氯酸的试管中分别滴加等浓度Na2CO3溶液,观察到前者有气泡、后者无气泡
Ka(CH3COOH)>Ka1(H2CO3)>Ka(HClO)
D
向淀粉溶液中滴加H2SO4并加热,再加入新制的Cu(OH)2悬浊液,加热,未见砖红色沉淀
淀粉没有水解
13.常温下,向盛50mL 0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100 mol·L−1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10−5,Kb(NH3·H2O)= 1.8×10−5。下列说法正确的是( )
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO−)
”、“<”或“=”)。
③提高处于C点状态的混合物中Cu+沉淀率措施是 ;
(4)“过滤”所得滤液中溶质主要成分的化学式为________;
(5)不能用硝酸代替硫酸进行“酸洗”,理由是____________。
27.(14分)铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如右图(加热和夹持仪器已略去),部分物质性质如下:
物质
NaBiO3
Bi(OH)3
性质
不溶于冷水,浅黄色
难溶于水;白色
(1)B装置用于除去HCl,盛放的试剂是 ;
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3
,反应的离子方程式为 ;
(3)当观察到 (填现象)时,可以初步判断C中反应已经完成;
(4)拆除装置前必须先除去烧瓶中残留Cl2以免污染空气。除去Cl2的操作是 ;
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有 ;
Ⅱ.铋酸钠的应用——检验Mn2+
(6)往待测液中加入铋酸钠晶体,加硫酸酸化,溶液变为紫红色,证明待测液中存在Mn2+。
①产生紫红色现象的离子方程式为 ;
②某同学在较浓的MnSO4溶液中加入铋酸钠晶体,加硫酸酸化,结果没有紫红色出现,但观察到黑色固体(MnO2)生成。产生此现象的离子反应方程式为 。
Ⅲ.产品纯度的测定
(7)取上述NaBiO3产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用cmo1·L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4−→ CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗vmL 标准溶液。该产品的纯度为 (用含w、c、v的代数式表示)。
28.(14分)一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
(1)已知:①C2H4(g)+2O2(g)=2CO2(g)+2H2(g) ΔH1
②2H2(g)+O2(g)=2H2O(1) ΔH2
③H2O(1)=H2O(g) ΔH3
④2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH4
则ΔH4=________________________ (用ΔH1、ΔH2、ΔH3表示)。
(2)反应④的反应温度、投料比[n(H2)/n(CO2)=x]对CO2平衡转化率的影响如下图所示。
①a____3 (填“>”、“<”或“=”);M、N两点反应的平衡常数KM____KN (填填“>”、“<”或“=”)
②M点乙烯体积分数为_____;(保留2位有效数字)
③300℃,往6L反应容器中加入3mol H2、1mol CO2,反应10min达到平衡。求0到10min氢气的平均反应速率为_______________;
(3)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂
CO2转化率
(%)
各产物在所有产物中的占比(%)
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____;
②下列说法正确的是______;
a.第ⅰ步所反应为:CO2+H2⇌CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原CO2制乙烯研究取得突破进展,原理如右图所示。
①b极接的是太阳能电池的______极;
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式______。
36.(15分)【化学—有机化学基础】
比鲁卡胺(分子结构见合成线路)是有抗癌活性,其一种合成路线如下:
回答下列问题
(1)A的化学名称为______________________。
(2)D中官能团的名称是_________________________________。
(3)反应④所需试剂、条件分别为__________________、____________________。
(4)写出⑤的反应方程式______________________。
(5)F的分子式为___________。
(6)写出与E互为同分异构体,且符合下列条件的化合物的结构简式___________。
①所含官能团类别与E相同;②核磁共振氢谱为三组峰,峰面积比为1:1:6
(7)参考比鲁卡胺合成的相关信息,完成如下合成线路(其他试剂任选)。
第2部分
7.《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A.赤色固体可能是Fe2O3 B.“青矾厂气”可能是CO和CO2
C.青矾宜密闭保存,防止氧化变质 D.青矾燃烧过程中发生了电子转移
8.NA代表阿伏加德罗常数的值。下列说法正角的是
A. 1 mol CH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA
B. pH=1的H2SO3溶液中,含有0.1 NA个H+
C.1 mol Fe分别与足量的稀硫酸和稀硝酸反应转移电子数均为3NA
D.常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
9.化学与生活、生产密切相关,下列说法正确的是
A.常用于染料、医药、农药等的酚类物质可来源于煤的干馏
B.大豆中含有丰富的蛋白质,豆浆煮沸后蛋白质全部变为了氨基酸
C.可以用酸性高锰酸钾溶液鉴别苯和直馏汽油
D.涤纶、有机玻璃、光导纤维都是有机高分子化合物
10.KIO3可作为食盐中的补碘剂。利用“KIO3氧化法”制备KIO3包括以下两个反应:
① 11KIO3+6I2+3H2O=6KH(IO3)2+3Cl2↑+5KCl
② 2KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是
A.反应①表明氧化性:KH(IO3)2> KIO3
B.反应①中每转移4mol电子生成2.24L Cl2
C.向淀粉溶液中加入少量碘盐,溶液会变蓝
D.可用焰色反应实验证明碘盐中含有钾元素
11. 实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时已经沉淀完全)。其中分析错误的是
A.步骤②发生的主要反应为:2Fe2++H2O2+2H++2Fe3++2H2O
B.步骤④为过滤,步骤⑤蒸发结晶
C.步骤②不能用氯水、硝酸等强氧化剂代替H2O2
D.步骤③用CuCO3代替CuO也可调节溶液的pH
12.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0mol/L Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
无液态铝滴落
金属铝的熔点高
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
D
将稀盐酸滴入Na2SiO3溶液中
溶液中出现凝胶
酸性:HCl>H2SiO3
13.实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是
A
B
C
D
制取Cl2
使Br—转化为Br2
分离出溴的苯溶液
将分液后的水层蒸干获得无水FeCl3
26.
27.(15分)用含锂废渣(主要金属元素的含量:Li 3.50% ,Ni 6.55%,Ca 6.41%,Mg
13.24%)制备Li2CO3,并用其制备Li+电池的正极材料 LiFePO4。部分工艺流程如下
资料:ⅰ.滤液 1、滤液2中部分离子的浓度(g/L):
ⅱ.EDTA能和某些二价金属离子形成稳定的水溶性络合物。
iii.Li2CO3微溶于水,溶解度随温度升高而降低。
(1)滤渣2含有多种成分,除含有Ca(OH)2外,还含有 。
(2)加入饱和Na2CO3 溶液,90℃充分反应后,分离出固体Li2CO3粗品的操作是 。
(3)滤液2中先加入EDTA的作用是 。
(4)有人提出将上述工艺中流程中制得的Li2CO3先转化为LiHCO3,再用隔膜法电解 LiHCO3溶液可制备高纯度的LiOH,电解原理如右图所示,阳极的电极反应式是 , 该电池使用了 (填“阳”或“阴”)离子交换膜,电解装置中阴极通入的稀溶液中含有的溶质为 (填写化学式)。
(5)将MnO2和Li2CO3按一定物质的量之比配料,高温下反应得到LiMn2O4
,并且产生了含有CO2的混合气体,该反应的化学方程式是 。
(6)在锂离子电池中掺杂的Li1+xMn2-xO4 可拓宽充、放电的电压范围,其中Mn的化合价为+3和+4,计算 n(Mn3+):n(Mn4+)= 。
28.(14分)合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖。其反应原理为N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
(1)工业生产常采用甲烷制氢,其反应是:
I. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
① 写出甲烷获得CO2(g)的热化学方程式 。
② 一定条件下,在体积为1L的密闭容器中通入1mol CH4和1mol H2O(g)进行甲烷制氢的反应,达到平衡时,H2O(g)的转化率为80%,H2的物质的量为2mol。则c(CO)= ,反应I的平衡常数(K)= 。
(2)某研究小组在仅改变某条件下,进行合成氨的反应,获得数据如下表:
编号
活化能
(kJ•mol-1)
平衡时各组分的浓度(mol•L-1)
到达平衡的时间(s)
N2
H2
NH3
1
50
0.224
0.672
1.552
2408
2
40
0.224
0.672
1.552
1104
3
30
0.224
0.672
1.552
504
改变的条件是 ,理由是 。
(3)某工厂氨气合成过程中,按一定空速(注:空速指单位时间内通过单位体积催化剂的气体量)通入反应器。反应的相关数据如下图所示。
图 1 功耗与压力(压强)的关系 图 2 氨产率与温度和空速的关系
① 该反应选择的温度和压力最佳条件是 。
② 4500C 时,空速越低时,氨的产率越高,原因是 。
(4)常温常压下的电化学合成氨备受关注,一种电解法合成氨的装置如下图所示,该电解的阴极反应式是 。
36. 中国工程院院士李兰娟团队,于2月4日公布治疗新冠病毒感染的肺炎最新研究成果。他们初步测试发现,在体外细胞实验中,阿比朵尔在10~30微摩尔浓度下,与药物未处理的对照组比较,能有效抑制冠状病毒达60倍,并有显著抑制病毒对细胞的病变效应。“阿比朵尔”合成路线如下:
(1)B中含有的官能团名称是 。
(2)反应②、⑥反应类型分别是 、 。
(3)G 的分子式为 。(4)请写出反应③的化学反应方程式 。
(5)M 是B的同分异构体,写出满足如下条件的M的结构简式: 。
①苯环上有3个取代基 ②能发生银镜反应③能发生水解反应,且1mol M水解消耗4mol NaOH④核磁共振氢谱为有4组峰,峰面积之比为2:2:2:1
(6)设计由甲苯和2-丙醇为原料制备的合成路线 。
化学科综合测试卷一 参考答案
第1部分
题号
7
8
9
10
11
12
13
答案
C
D
C
B
D
C
B
26.(15分)
(1)增大接触面积,加快酸浸速率,提高Cu的浸出率等(1分 )
CuS+H2SO4+H2O2=CuSO4+S+2H2O(2分)
(2)16.3 (1分) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(生成NO2也给分) (2分)
(3)SO42- 或(NH4)2SO4(1分) 2:1 (2分)
(4)①> (1分) ②加水稀释 (1分)
(5)(NH4)2SO4 (1分)
(6)HNO3具有强氧化性会把CuCl氧化 (2分)
27.(14分)
(1)饱和食盐水 (1分)
(2)Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O (2分)
(3)C中白色固体消失(或黄色不再加深)(1分)
(4)关闭K1、K3,打开K2 (关闭K1可不写)(2分)
(5)在冰水中冷却结晶、过滤、洗涤、干燥 (答蒸发浓缩,得0分)(2分)
(6)①5NaBiO3+2Mn2++14H+=5Bi3++2MnO4-+5Na++7H2O (2分)
②3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ (2分)
(7)(280cv×10-3)/w ×100%或(0.28cv/w)×100%或(28cv/w) % (2分)
28.(14分)
(1)2△H2+4△H3-△H1 (2分)
(2)①>(1分) > (1分) ②9.7%或3/31 (2分) 0.03mol·L-1·min-1 (2分)
(3)①K (1分) 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响(1分) ② ac (2分)
(4)①正 (1分) ②2CO2+12e-+8H2O=C2H4+12OH- (2分)
36.(15分)
(1) 丙酮 (1分) (2)碳碳双键、羧基(2分)
(3) 甲醇 浓硫酸 加热 (2分)
(4)(2分)
(5)C12H9N2OF3(2分) (6) (2分)
(7)(4分)
第2部分
7
8
9
10
11
12
13
B
D
A
D
D
D
C
26.