- 2021-07-08 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第7章 专题讲座四 真实复杂情景中化学反应速率和平衡图像识图策略
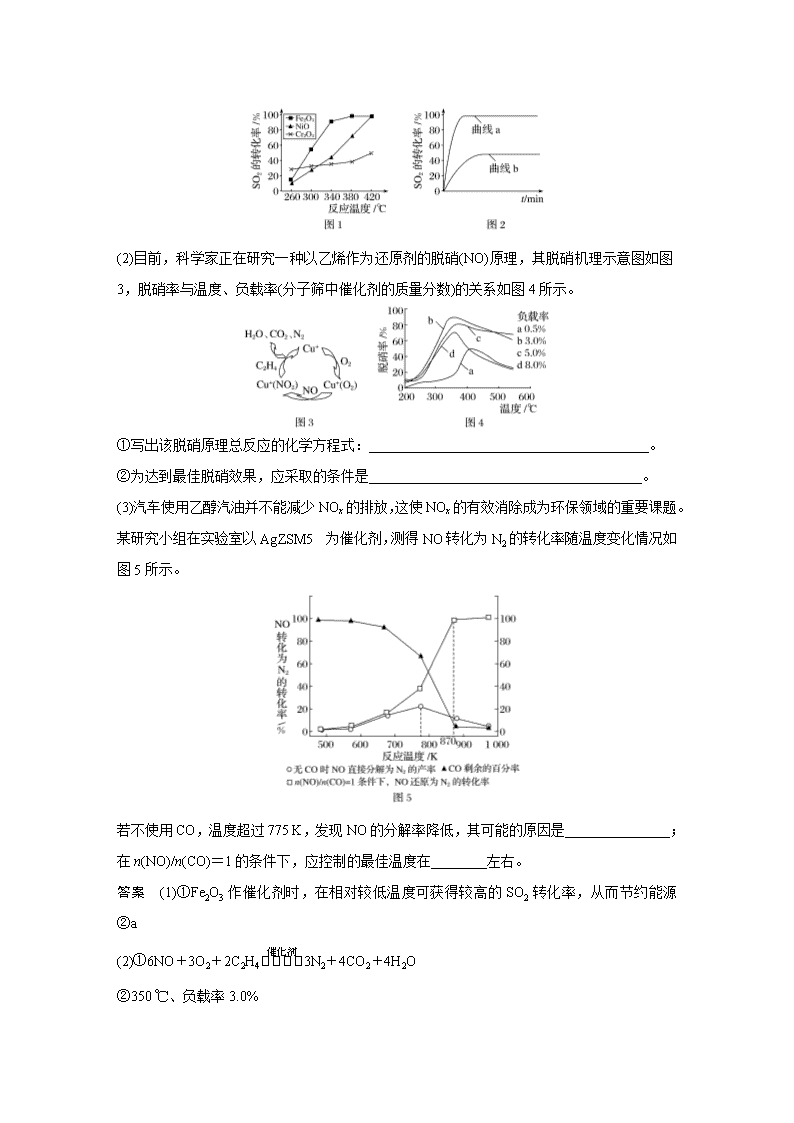
专题讲座四 真实复杂情景中化学反应速率和平衡图像识图策略 化学平衡图像题,除以常规图像形式(如c —t图、含量—时间—温度图、含量—时间—压强图、恒压线图、恒温线图等)考查平衡知识外,又出现了很多新型图像。这些图像常与生产生活中的实际问题相结合,从反应时间、投料比值、催化剂的选择、转化率等角度考查。图像形式看似更加难辨,所涉问题看似更加复杂,但只要仔细分析,抓住图像中的关键点(常为最高点、最低点、转折点)、看清横坐标、纵坐标代表的条件、弄清曲线的变化趋势,即可将复杂图像转化为常规图像。进而运用化学平衡知识进行解答即可。 1.转化率—投料比—温度图像 [例1] 将燃煤废气中的CO2转化为甲醚的反应原理为 2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) 已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图: 此反应__________(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”“减小”或“不变”)。 解析 当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡左移,正反应为放热反应。平衡常数只与温度有关,不随投料比的变化而变化。 答案 放热 不变 2.根据图像判断投料比 [例2] 采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。 主反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) 副反应:CO(g)+H2O(g)CO2(g)+H2(g) CO(g)+2H2(g)CH3OH(g) 测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。 则催化剂中n(Mn)/n(Cu)约为________时最有利于二甲醚的合成。 解析 由图可知当催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,生成的二甲醚最多。 答案 2.0 3.废物回收及污染处理图像 [例3] (1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收。反应为 2CO(g)+SO2(g)2CO2(g)+S(l) ΔH=-270 kJ·mol-1 ①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是________________________________________________________________________。 ②某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为__________。 (2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。 ①写出该脱硝原理总反应的化学方程式:________________________________________。 ②为达到最佳脱硝效果,应采取的条件是_______________________________________。 (3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以AgZSM5为催化剂,测得NO转化为N2的转化率随温度变化情况如图5所示。 若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因是_______________; 在n(NO)/n(CO)=1的条件下,应控制的最佳温度在________左右。 答案 (1)①Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源 ②a (2)①6NO+3O2+2C2H43N2+4CO2+4H2O ②350 ℃、负载率3.0% (3)NO分解反应是放热反应,升高温度不利于分解反应进行 870 K 1.在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应Fe(s)+5CO(g)Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法正确的是( ) A.反应进行到5 min时,b容器中v正=v逆 B.正反应为吸热反应,平衡常数:K(T1)>K(T2) C.b中v正大于a中v逆 D.反应达到平衡时,CO的转化率:b>c>a 答案 C 2.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH。在某压强下起始时按不同氢碳比投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( ) A.该反应的ΔH>0 B.氢碳比:①<②<③ C.其他条件不变的情况下,增大容器的体积可提高CO2的转化率 D.若起始CO2的浓度为2 mol·L-1、H2为4 mol·L-1,在图中曲线③氢碳比条件下进行,则400 K时该反应的平衡常数数值约为1.7 答案 D 解析 根据图像可知,在氢碳比相等的条件下,随着温度的升高,CO2的转化率降低,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,ΔH<0,A错误;氢碳比越大,CO2的转化率越高,根据图像可知,在温度相等的条件下,CO2的转化率:①>②>③ ,则氢碳比:①>②>③,B错误;正反应是气体体积减小的反应,因此其他条件不变的情况下,缩小容器的体积,压强增大,平衡向正反应方向移动,可提高CO2的转化率,C错误;根据图像可知,400 K时曲线③中CO2的转化率是50%,这说明消耗CO2 1 mol·L-1,则消耗氢气3 mol ·L-1,生成乙醇和水蒸气分别是0.5 mol·L-1、1.5 mol·L-1,剩余CO2和氢气分别是1 mol·L-1、1 mol·L-1,该温度下平衡常数K= mol-4·L4≈1.7 mol-4·L4,D正确。 3.(2020·山东等级模拟考,15)热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了TiHFe双温区催化剂(TiH区域和Fe区域有温度差可超过100 ℃)。TiHFe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( ) A.①为N≡N的断裂过程 B.①②③在高温区发生,④⑤在低温区发生 C.④为N原子由Fe区域向TiH区域的传递过程 D.使用TiHFe双温区催化剂使合成氨反应转变为吸热反应 答案 BC 解析 ①为N2被催化剂吸附,②为形成过渡态过程,③为N≡N断裂过程,④为N原子传递过程,⑤为N—H成键过程。 4.Bodensteins研究了下列反应: 2HI(g)H2(g)+I2(g) ΔH>0 在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表: t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 x(HI) 0 0.60 0.73 0.773 0.780 0.784 (1)根据上述实验结果,该反应的平衡常数K的计算式为____________________________。 (2)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、 k逆为速率常数,则k逆为_______(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=________min-1。 (3)由上述实验数据计算得到v正-x(HI)和v逆-x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。 答案 (1) (2)k正/K 1.95×10-3 (3)A、E 解析 (1)2HI(g)H2 (g)+I2 (g)是反应前后气体物质的量不变的反应。反应后x(HI)=0.784,则x(H2)=x(I2)=0.108,K===。(2)到达平衡时,v正=v逆,即k正x2(HI)=k逆x(H2)x(I2),k逆=k正·=k正/K。在t=40 min时,x(HI)=0.85,v正=k正x2(HI)=0.002 7 min-1×(0.85)2≈1.95×10-3 min-1。(3)原平衡时,x(HI)为0.784,x(H2)为0.108,二者在图中的纵坐标均约为1.6(因为平衡时v正=v逆),升高温度,正、逆反应速率均加快,对应两点在1.6上面,升高温度,平衡向正反应方向移动,x(HI)减小(A点符合),x(H2)增大(E点符合)。查看更多