- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省成都艺术高级中学2020届高三高考模拟考试理科综合化学试题(一)
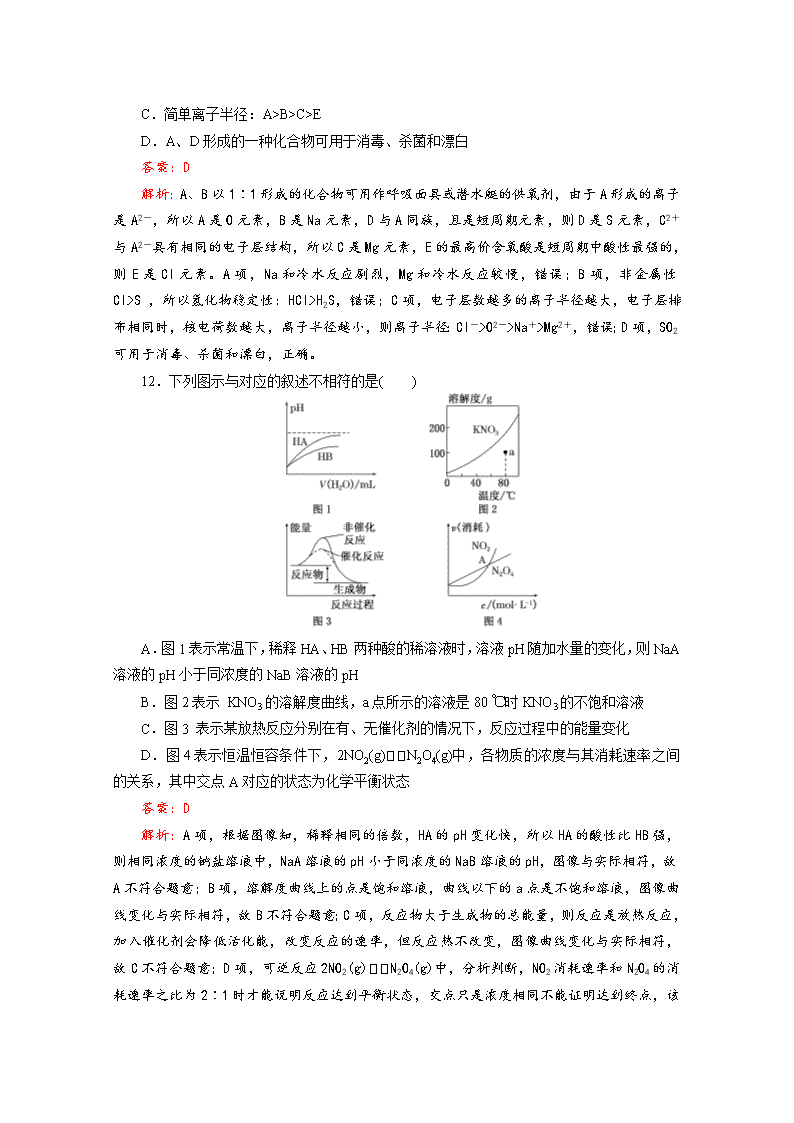
成都艺术高级中学2020届高考模拟考试试题(一) 理科综合能力测试 (化学部分) 本试卷分选择题和非选择题两部分,共40题,满分300分,考试时间150分钟。 可能用到的相对原子质量:H 1 C 12 O 16 N 14 B 11 Cu 64 第Ⅰ卷(选择题 共126分) 一、选择题(每小题6分,本大题共13小题。每小题给出的四个选项中,只有一项是符合题目要求的。) 7.化学与生产、生活、科技、环境等密切相关。下列说法正确的是( ) A.“华为麒麟980”手机中芯片的主要成分是单质硅 B.高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于无机高分子材料 C.医用双氧水和酒精均可用于伤口清洗,两者消毒原理相同 D.纯碱既可用于清洗油污,也可用于治疗胃酸过多 答案:A 解析:A项,硅是半导体材料,“华为麒麟980”手机中芯片的主要成分是单质硅,正确;B项,聚四氟乙烯俗称“塑料王”,属于有机高分子材料,错误;C项,医用双氧水消毒是利用强氧化性使蛋白质变性,而酒精消毒也是使蛋白质变性,但不是利用强氧化性,两者消毒原理不相同,错误;D项,纯碱由于碱性较强,不可用于治疗胃酸过多,错误。 8.下列依据相关实验得出的结论正确的是( ) A.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 D.取少量某晶体放入试管中,加热,将产生的气体通过硫酸铜粉末,硫酸铜粉末变蓝,则可证明晶体的成分中含有结晶水 答案:A 解析:向溶液中滴加KSCN溶液,溶液不变色,则不含Fe3+,滴加氯水后显红色,则是因为生成了Fe3+,因此一定含有Fe2+,A项正确;焰色反应是元素的性质,焰色反应呈黄色的溶液含有Na+,则可能是NaOH溶液或钠盐溶液,B项错误;能使溴水褪色的气体除了乙烯,还可以为SO2等,C项错误;使硫酸铜粉末变蓝的物质是水,可能是受潮带有的水,也可能是晶体分解产生的水,D项错误。 9.有机物X、Y、Z在一定条件下可实现如下转化,下列说法正确的是( ) A.化合物Z环上的一氯代物共有3种(不考虑立体异构) B.Y和Z可以用金属钠来鉴别 C.X、Y、Z分子中所有碳原子均处于同一平面 D.Y的分子式为C7H9O 答案:B 解析:A项,Z的环上一氯代物共有4种,分别为错误;B项,Y中的醛基不能和金属钠反应,而Z中的羟基能和金属钠反应放出H2,故可用金属钠将两者鉴别,正确;C项,Y、Z分子中环上的碳原子有饱和碳原子,呈四面体结构,所有碳原子不可能处于同一平面,错误;D项,Y的分子式为C7H10O,错误。 10.钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( ) A.将黑钨铁矿粉碎的目的是增大反应的速率 B.共熔过程中空气的作用是氧化Fe(Ⅱ)和Mn(Ⅱ) C.在高温下WO3被氧化成W D.操作Ⅱ是过滤、洗涤、干燥,H2WO4难溶于水且不稳定 答案:C 解析:A项,将固体反应物粉碎可以增大反应物的接触面积,能提高反应速率,正确;B项,通过流程图可知,纯碱、空气、FeWO4和MnWO4共熔发生反应,使Fe(Ⅱ)和Mn(Ⅱ)转化为难溶的Fe2O3和MnO2,进而通过冷却、水浸、过滤的方法除去,正确;C项,在高温下H2与WO3反应生成W和H2O,从元素价态变化来看,WO3为氧化剂,被还原,错误;D项,Na2WO4溶液中加入硫酸发生复分解反应,生成难溶于水的H2WO4,经过过滤、洗涤、干燥获得较为纯净的H2WO4,加热使其分解为WO3,正确。 11.有A、B、C、D、E五种短周期元素。其中A、B以1∶1形成的化合物可用作呼吸面具或潜水艇的供氧剂;A、D同族;C2+与A2-具有相同的电子层结构;E的最高价含氧酸是短周期中酸性最强的。下列有关五种元素及其化合物的说法正确的是( ) A.B能与冷水反应,C不能与冷水反应 B.简单氢化物的稳定性:D>E C.简单离子半径:A>B>C>E D.A、D形成的一种化合物可用于消毒、杀菌和漂白 答案:D 解析:A、B以1∶1形成的化合物可用作呼吸面具或潜水艇的供氧剂,由于A形成的离子是A2-,所以A是O元素,B是Na元素,D与A同族,且是短周期元素,则D是S元素,C2+与A2-具有相同的电子层结构,所以C是Mg元素,E的最高价含氧酸是短周期中酸性最强的,则E是Cl元素。A项,Na和冷水反应剧烈,Mg和冷水反应较慢,错误;B项,非金属性Cl>S ,所以氢化物稳定性:HCl>H2S,错误;C项,电子层数越多的离子半径越大,电子层排布相同时,核电荷数越大,离子半径越小,则离子半径:Cl->O2->Na+>Mg2+,错误;D项,SO2可用于消毒、杀菌和漂白,正确。 12.下列图示与对应的叙述不相符的是( ) A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH B.图2表示 KNO3的溶解度曲线,a点所示的溶液是80 ℃时KNO3的不饱和溶液 C.图3 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化 D.图4表示恒温恒容条件下,2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 答案:D 解析:A项,根据图像知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,则相同浓度的钠盐溶液中,NaA溶液的pH小于同浓度的NaB溶液的pH,图像与实际相符,故A不符合题意;B项,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,图像曲线变化与实际相符,故B不符合题意;C项,反应物大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,图像曲线变化与实际相符,故C不符合题意;D项,可逆反应2NO2(g)N2O4(g)中,分析判断,NO2消耗速率和N2O4的消耗速率之比为2∶ 1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,该说法不合理,故D符合题意。 13.水系锌离子电池是一种新型二次电池,工作原理如下图。该电池以粉末多孔锌电极(锌粉、活性炭及黏结剂等)为负极,V2O5为正极,三氟甲磺酸锌[Zn(CF3SO3)2]为电解液。下列叙述错误的是( ) A.放电时,Zn2+向V2O5电极移动 B.充电时,阳极区电解液的浓度变大 C.充电时,粉末多孔锌电极发生还原反应 D.放电时,V2O5电极上的电极反应式为V2O5+xZn2++2xe-===ZnxV2O5 答案:B 解析:A项,放电时,阳离子向正极移动,所以Zn2+向V2O5电极移动,正确;B项,充电时,阳极区发生氧化反应,同时阳离子向阴极移动,则锌离子通过阳膜向左移动,所以阳极区电解液的浓度不变,错误;C项,充电时,粉末多孔锌电极为阴极,发生还原反应,正确;D项,放电时,V2O5电极为正极,发生还原反应,电极反应式为V2O5+xZn2++2xe-===ZnxV2O5,正确。 第II卷(非选择题共174分) 三、非选择题:本卷包括必考题和选考题两部分。第22~32题为必考题,每个试题考生都必须做答。第33~40题为选考题,考生根据要求做答。 (一)必考题(共129分) 26.(15分)某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验。 实验Ⅰ:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想此固体为:xCuCO3·yCu(OH)2。 (1)为了验证猜想,先进行定性实验。 实验序号 实验步骤 实验现象 结论 实验Ⅱ 取适量蓝绿色固体,加入足量稀硫酸 固体溶解,生成蓝色溶液及________ 蓝绿色固体中含有 CO (2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验。 实验Ⅲ:称取5.190 g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中。 ①装置C中盛放的试剂是________,装置E的作用是_____________________________,反应结束时要通入适量的空气,其作用是__________________________________________。 ②实验结束后,测得装置C增重0.270 g,装置D增重1.320 g。则该蓝绿色固体的化学式为__________________________________________________。 (3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式:_____________________________________________________________________。 (4)已知20 ℃时溶解度数据:S[Ca(OH)2]=0.16 g,S[Ba(OH)2]=3.89 g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是_____________________________________________________。 (5)有同学为了降低实验误差,提出如下建议,其中合理的是________(填字母序号)。 A.加热装置B前,先通空气一段时间后再称量C、D的初始质量 B.将D换为盛有碱石灰的U形管 C.将C、D颠倒并省去E装置 解析:(1)实验Ⅱ中加入了足量稀硫酸,结论是蓝绿色固体中含有CO,则实验现象应为有无色气体(即CO2)产生。(2)①实验Ⅲ是定量实验,蓝绿色固体xCuCO3·yCu(OH)2受热会生成水蒸气和CO2,装置C是为了测量生成的水蒸气的质量,盛放的试剂为无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D中,使测量出现误差。反应结束时要通入适量的空气,其作用是使分解产生的气体全部进入装置C和D中,以保证测量的准确性。②n(H2O)=0.270 g÷18 g·mol-1=0.015 mol,n(H)=0.03 mol,n(CO2)=1.320 g÷44 g·mol-1=0.03 mol,n(C)=0.03 mol,结合化学式xCuCO3·yCu(OH)2,知x∶y=2∶1,即该蓝绿色固体的化学式为2CuCO3·Cu(OH)2。(3)若x=y=1,则CuSO4溶液与Na2CO3溶液混合时反应的化学方程式为2CuSO4+2Na2CO3+H2O===CuCO3·Cu(OH)2↓+CO2↑+2Na2SO4。(4)根据题意S[Ba(OH)2]>S[Ca(OH)2],在相同体积时,饱和Ba(OH)2溶液吸收CO2的量更多。(5)加热装置B前,先通空气一段时间,可排出装置内的二氧化碳气体,使测量更准确,A项合理。将D换为盛有碱石灰的U形管,可以充分吸收生成的二氧化碳气体,B项合理。若将C、D颠倒,则所测水蒸气的质量不准确;若省去E装置,则空气中的水蒸气和二氧化碳会进入装置中,使测量结果不准确,C项不合理。 答案:(1)产生无色气体 (2)①无水氯化钙 防止空气中的二氧化碳和水蒸气进入装置D中 使分解产生的气体全部进入装置C和D中 ②2CuCO3·Cu(OH)2 (3)2CuSO4+2Na2CO3 +H2O===CuCO3·Cu(OH)2↓+CO2↑+2Na2SO4 (4)Ba(OH)2的溶解度大于Ca(OH)2,相同体积的饱和Ba(OH)2溶液吸收CO2的量更多(答案合理即可) (5)AB 27.(14分)用NH3催化还原NxOy可以消除氮氧化物的污染。 已知:反应Ⅰ:4NH3(g)+6NO(g)5N2(g)+6H2O(l) ΔH1 反应Ⅱ:2NO(g)+O2(g)2NO2(g) ΔH2 (且|ΔH1|=2|ΔH2|) 反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l) ΔH3 反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表: 温度/K 反应Ⅰ 反应Ⅱ 已知: K2>K1>K2′>K1′ 298 K1 K2 398 K1′ K2′ (1)推测反应Ⅲ是____________反应(填“吸热”或“放热”)。 (2)相同条件下,反应Ⅰ 在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示。 ①计算0~4 min在A催化剂作用下,反应速率v(NO)=____________。 ②下列说法正确的是____________。 A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C) B.增大压强能使反应速率加快,是因为增加了活化分子百分数 C.单位时间内HO键与NH键断裂的数目相等时,说明反应已经达到平衡 D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡 (3)一定条件下,反应Ⅱ达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)____________;恒温恒容容器,φ(NO2)____________。 (4)一定温度下,反应Ⅲ在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则: ①变为曲线Y改变的条件是____________。变为曲线Z改变的条件是____________。 ②若t2降低温度,t3达到平衡,请在上图2中画出曲线X在t2~t4内 c(N2)的变化曲线。 解析:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,ΔH1<0;K2>K2′,说明随温度升高,K减小,则反应Ⅱ为放热反应,ΔH2<0;反应Ⅰ-反应Ⅱ×3得到反应Ⅲ,则ΔH3=ΔH1-3ΔH2,已知|ΔH1|=2|ΔH2|,所以ΔH3=ΔH1-3ΔH2=|ΔH2 |>0,即反应Ⅲ为吸热反应;(2)① 已知4分钟时N2为2.5 mol,则消耗的NO为3 mol,所以v(NO)===0.375 mol·L-1·min-1;②相同时间内生成的N2的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;增大压强能使反应速率加快,是因为增大了单位体积内的活化分子数,而活化分子百分数不变,故B错误;单位时间内H—O键断裂表示逆速率,N—H键断裂表示正速率,单位时间内H—O键与N—H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4∶6,则正逆速率相等,说明反应已经达到平衡,故C正确;该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;(3)一定条件下,反应 Ⅱ 2NO(g)+O2(g)2NO2(g)达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。在其他条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;(4)①分析图像可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂,当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3 L,N2浓度为3 mol·L-1,改变条件当曲线X变为曲线Z时,N2浓度为4.5 mol·L-1,则体积压缩体积为:3∶V=4.5∶3,V=2 L,所以将容器的体积快速压缩至2 L符合;②反应Ⅲ为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2~t4内 c(N2)的变化曲线图见答案。 答案:(1)吸热 (2)①0.375 mol·L-1·min-1 ②C、D (3)不变 变大 (4)①加入催化剂 将容器的体积快速压缩至2 L ② 28.(14分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下: 已知:①NiCO3是一种不溶于水易溶于强酸的沉淀;②已知25℃,Fe(OH)3的Ksp=2.64×10−39。 (1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。 (2)步骤②,向滤液I中加入适量Na2S溶液的目的是除去Cu2+和Zn2+,其中除去Cu2+的离子方程式为____________________________________;加Na2S之前需控制pH不能太低的目的是_____________________________________________________________。 (3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是________________________。若在25℃时,调pH=4除去铁,此时溶液中c(Fe3+)=______________。 (4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是______________(已知:氧化性Fe2+查看更多