2020-2021学年高二上学期月考化学试题(山东省枣庄市第八中学(东校区))
高二化学单元检测(一)
(满分:100分;时间:90分钟)
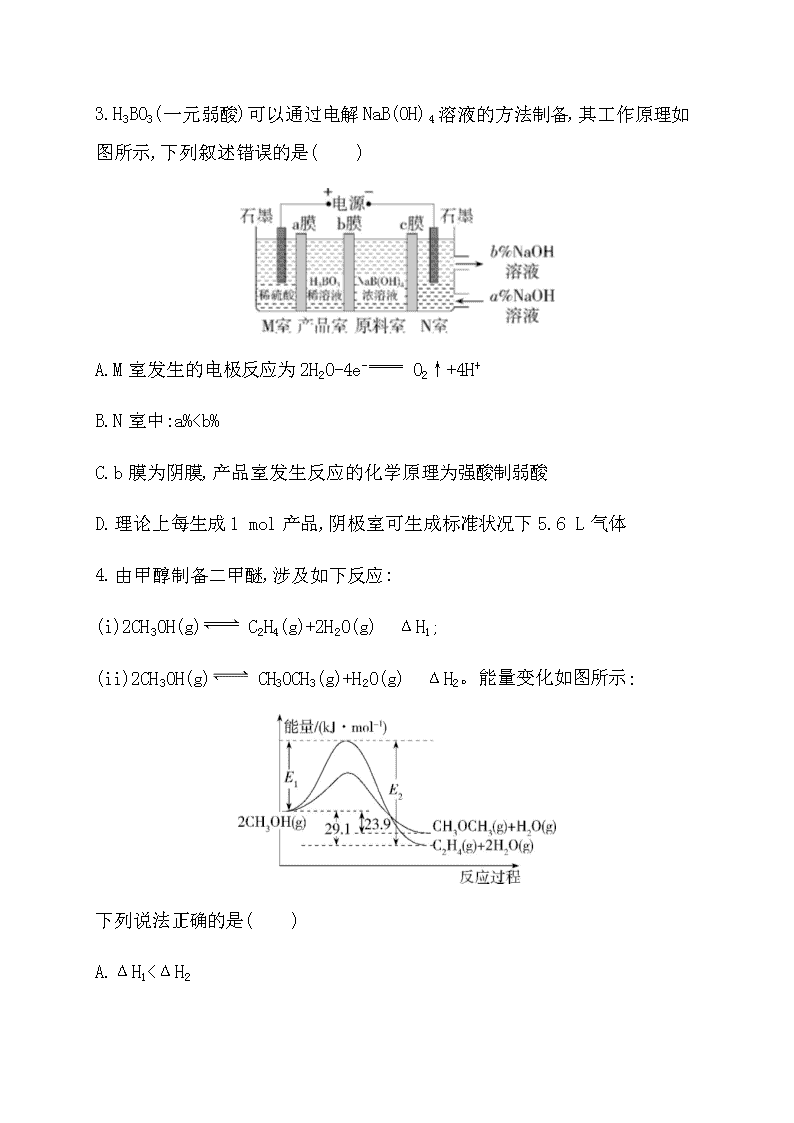
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
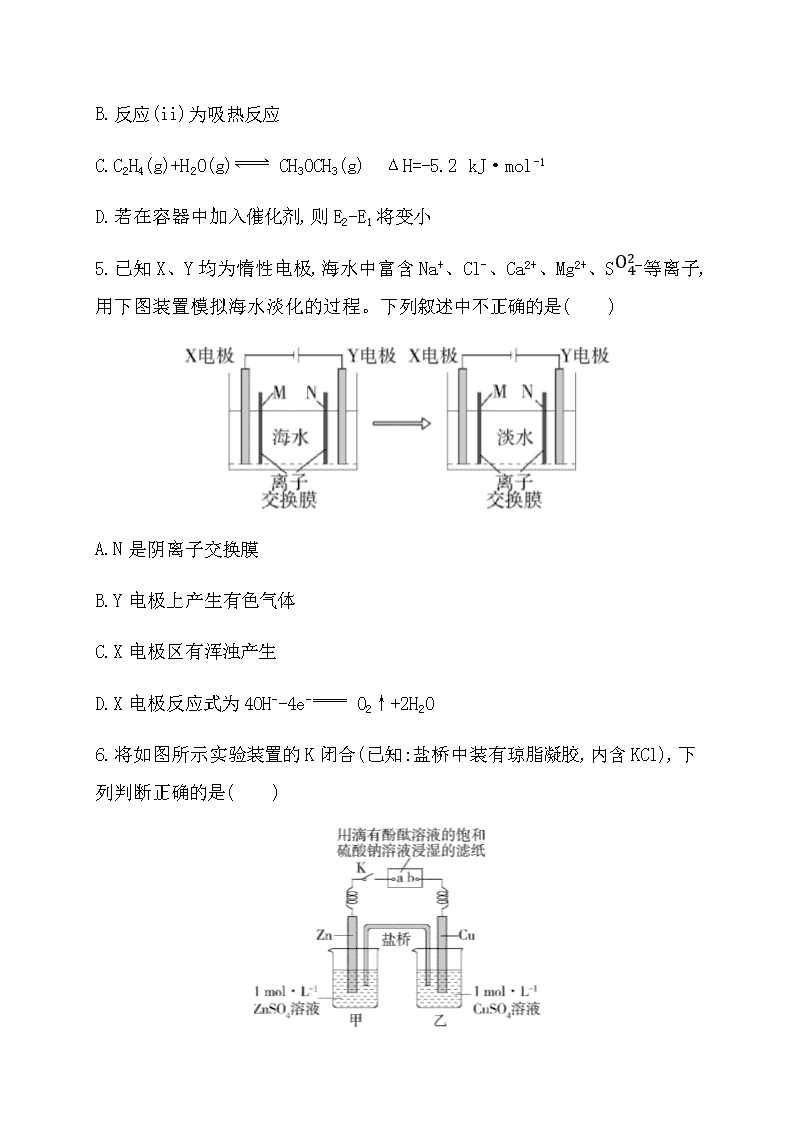
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(s,石墨) C(s,金刚石) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
2.下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq) ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E反应物
0
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则ΔH<0
C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,则该反应的ΔH>0
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0
10.甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法正确的是( )
A.装置乙中的b极要与装置甲的X极连接
B.装置乙中a极的电极反应式为2Cl--2e- Cl2↑
C.当N极消耗5.6 L(标准状况下)气体时,则有2NA个H+通过质子交换膜
D.若有机废水中主要含有葡萄糖(C6H12O6),则装置甲中M极发生的电极反应为C6H12O6+6H2O-24e- 6CO2↑+24H+
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.将KCl和CuSO4两种溶液等体积混合后,用石墨作电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是( )
A.整个过程中两电极反应2Cl--2e- Cl2↑、2H++2e- H2↑不可能同时发生
B.电解至C点时,往电解质溶液中加入适量CuCl2固体,即可使电解质溶液恢复至原来的浓度
C.AB段表示电解过程中H+被还原,pH增大
D.原混合溶液中KCl和CuSO4浓度之比恰好为2∶1
12.工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应为CH2CH2(g)+H2O(g) CH3CH2OH(g) ΔH。已知几种共价键的键能如下:
化学键
C—H
CC
H—O
C—C
C—O
键能/kJ·mol-1
413
615
463
348
351
下列说法错误的是( )
A.上述合成乙醇的反应中原子利用率为100%
B.相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C.碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D.上述反应式中,ΔH=+34 kJ·mol-1
13.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
A. A→F,ΔH=-ΔH6
B. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C. C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D. |ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
14.如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电时的电池反应为2K2S2+KI3 K2S4+3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
A.K+从左到右通过离子交换膜
B.电极A上发生的反应为I3-+2e- 3I-
C.电极Y上发生的反应为2Cl--2e- Cl2↑
D.当有0.1 mol K+通过离子交换膜时,X电极上产生1.12 L气体
15.一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的密闭刚性容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2 min末反应达到平衡,生成0.8 mol D,并测得C的物质的量浓度为0.4 mol·L-1,下列说法正确的是( )
A.x的值为2
B.A的平衡转化率为40%
C.此温度下该反应的平衡常数K等于0.5
D.A和B的平衡转化率相等
三、非选择题(本题共5小题,共60分)
16.(11分)将V1 mL 1.0 mol·L-1盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持V1+V2=50。
(1)下列叙述正确的是 。
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可转化为热能
C.NaOH溶液的浓度约为1.5 mol/L
D.该实验表明有水生成的反应都是放热反应。
(2)中和热的理论数值为57.3 kJ·mol-1,下列操作可能使测得的数值偏小的是 (填序号)。
①室温低于10 ℃时进行实验 ②在量取NaOH溶液的体积时仰视读数 ③分多次把NaOH溶液倒入盛有盐酸的小烧杯中 ④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒
在做测定中和反应的反应热实验时,应使用仪器的正确组合是( )
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A. ①②④⑤ B. ②③⑤ C.②③④⑦ D. 全部
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,则表示中和热的热化学方程式为 (填字母)。
A.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
B.NaOH(s)+HCl(l) NaCl(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
D.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(4)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_ _。
17.(6分)煤化工中常需研究不同温度下的平衡常数、产率及不同投料比对反应方向的影响等问题。已知反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
温度/℃
400
500
830
1 000
平衡常数K
10
9
1
0.6
试回答下列问题。
(1)该反应的化学平衡常数表达式为K=________。
(2)在相同条件下,为增大反应物的转化率,该反应应在________(填“高温”或“低温”)条件下进行。
(3)在830 ℃时发生上述反应,按下表中的物质的量将各物质投入恒容反应器中,其中向正反应方向进行的反应有________(填序号)。
选项
A
B
C
D
n(CO2)/mol
3
1
0
1
n(H2)/mol
2
1
0
1
n(CO)/mol
1
2
3
0.5
n(H2O)/mol
5
2
3
2
18.(9分)以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
已知:2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ·mol-1
CH3OCH3(g)+3O2(g) 2CO2(g)+3H2O(g) ΔH=-1 323 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ·mol-1
(1)反应室Ⅱ中发生反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH= 。
(2)以反应室Ⅰ出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3的熔融混合物为电解质构成的一种碳酸盐燃料电池如图所示。
①该电池的正极反应式为 。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为 L(标准状况)。
19.(22分)(1)2004年美国圣路易斯大学研制了一种新型乙醇电池,该电池采用磺酸类质子溶剂,在200 ℃左右时供电,电池示意图如下所示:
① 极(填“a”或“b”)为电池的正极,电池工作时电子的流向为 (填“a→b”或“b→a”)。
②写出该电池负极的电极反应式: 。
(2)图中X为电源,Y为浸透滴有酚酞试液的饱和食盐水的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
①Y中总反应的化学方程式为 ,滤纸上c点附近会变色。
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时Z中溶液的体积为500 mL,假设溶液中还有AgNO3存在,则溶液中氢离子的物质的量是 ,需加入 g的 (填化学式)可使溶液复原。
(3)氧化还原反应与生产、生活、科技密切相关。请回答下列问题:
①银制器皿久置表面变黑是因为表面生成了Ag2S,该现象属于 腐蚀。
②在如图1所示的原电池装置中,负极的电极反应为 ,电池总反应为 ,当电路中通过0.1 mol e-时,交换膜左侧溶液中离子减少的物质的量为 。
图1
20.(12分)装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
(1)B极是电源的 极,C极的电极反应式为 ,一段时间后丁中X极附近的颜色逐渐 (填“变深”或“变浅”)。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“铜”或“银”),电镀液是 溶液。常温下,当乙中溶液的c(OH-)为0.1mol/L时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 g,甲中溶液的pH (填“变大”“变小”或“不变”)。
(4)若甲烧杯是在铁件表面镀铜,已知电镀前两电极质量相同,电镀完成后将它们取出,洗净、烘干、称量,发现二者质量相差5.12 g,则电镀时电路中通过的电子为 mol。
高二化学单元检测(一)
姓名 班级 考号 。
答题纸
16. (1) (2) (3) ,
(4) 。
17 (1) (2) (3) 。
18. (1) (2)① 。
② 。
19. (1)① ② 。
(2)① 。
② 。
(3)① ② ;
。
20 (1) 。
(2) 。
(3) 。
(4) 。
高二化学单元检测(一)答案
1.D
2.B
3.D
4.A
5.D
6.A
7.B
8.D
9.B
10.D
11.A
12.D
13.B
14.BD
15.AC
16.答案 (1)BC (2)①②③④ B (3)D (4)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ·mol-1
17 答案(1) (2) 低温 (3)BC
18.答案 (1)-211 kJ·mol-1 (2)①O2+4e-+2CO2 2CO32- ②44.8
19.答案 (1)①b a→b ②C2H5OH-12e-+3H2O 12H++2CO2↑
(2)①2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 红 ②0.05 mol 5.8 Ag2O
(3)①化学 ②Ag-e-+Cl- AgCl 从左向右 2Ag+Cl2 2AgCl 0.2 mol ③X NO-3e-+2H2O NO3-+4H+ NH3或NH3·H2O
20.答案 (1)负 4OH--4e- O2↑+2H2O 变浅
(2)1∶2∶2∶2
(3)铜 AgNO3 5.4 变小
(4)0.08
答案
1.D 等量的水和冰相比较,冰的能量低,A错误;发生化学反应时能量的变化有多种形式,可以表现为热能,还可以表现为光能等,B错误;ΔH>0,说明反应吸热,石墨的能量较低,能量越低物质越稳定,故石墨更稳定,C错误;化学反应遵循质量守恒的同时,也遵循能量守恒,D正确。
2.B 当反应物总能量<生成物总能量时,反应吸热,故A错误,B正确;根据热化学方程式HCl(g) 12H2(g)+12Cl2(g) ΔH=+92.3 kJ·mol-1可知HCl(g)的分解反应是吸热反应,故C错误;反应N2(g)+3H2(g) 2NH3(g)是可逆反应,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成的NH3(g)小于1.0 mol,放热19.3 kJ,则N2(g)+3H2(g) 2NH3(g) ΔH<-38.6 kJ·mol-1,故D错误。
3.D M室为阳极室,发生氧化反应,电极反应为2H2O-4e- O2↑+4H+,A正确;N室为阴极室,溶液中水电离出的H+得电子发生还原反应,生成H2,促进水的电离,溶液中OH-浓度增大,则a%
查看更多