- 2021-07-08 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】湖北省武汉市2020届高三毕业生五月质量检测理综
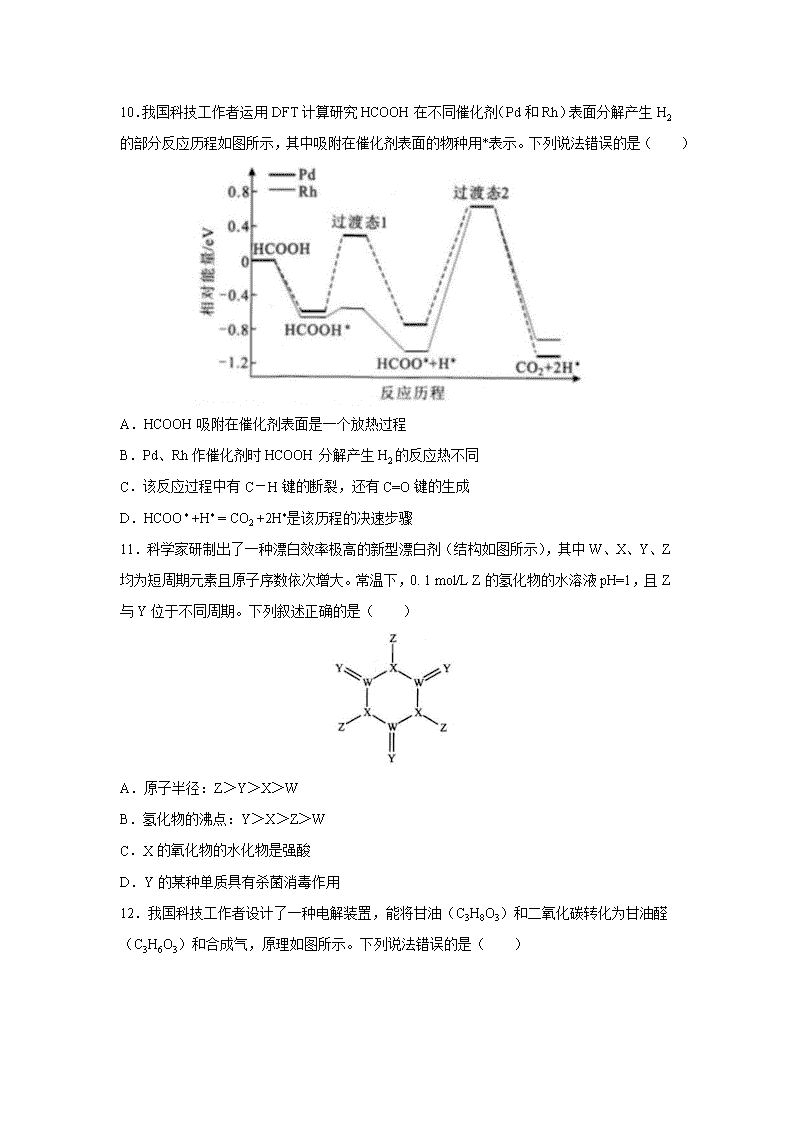
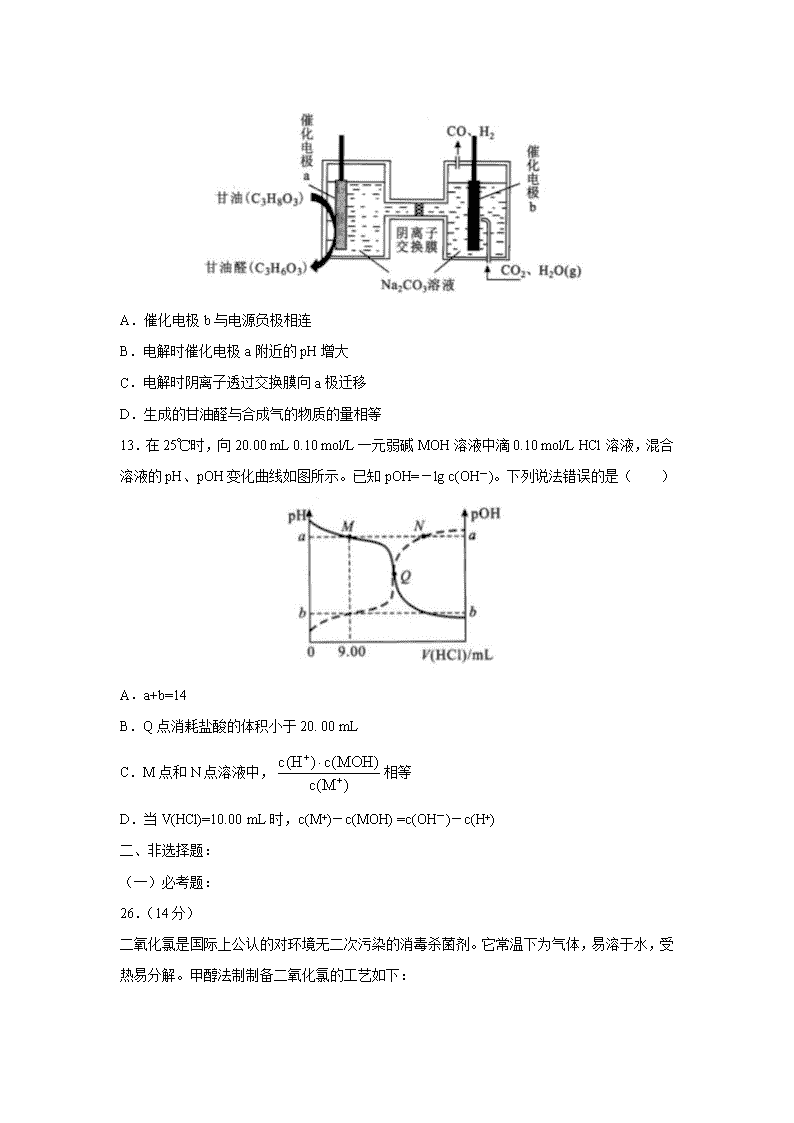
湖北省武汉市 2020 届高三毕业生五月质量检测理综 可能用到的相对原子质量:H 1 C 12 N 14 016 Cl 35.5 Ni 59 一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生产、生活密切相关。下列说法错误的是( ) A.燃煤中加入生石灰可减少温室气体的排放 B.用纯碱溶液除油污,加热可提高去污能力 C.我国北斗导航系统所用的芯片中含高纯硅 D.医用护目镜片的主要成分属于有机高分子材料 8.“连翘酯苷 A”是“连花清瘟胶囊”的有效成分。下图有机物是“连翘酯苷 A”的水解产物, 其结构简式如图所示。下列有关该有机物的说法错误的是( ) A.分子式为 C9H8O4 B.分子中所有原子可能处于同一平面 C.1 mol 该分子最多可与 5 mol H2 发生加成反应 D.能与 NaHCO3 溶液反应放出 CO2 9.探究 FeSO4 的热分解产物的实验装置如图所示,乙和丙中盛有检验相应物质的常用试剂, 实验完成后甲中残留固体为红棕色。下列有关实验操作或现象的叙述正确的是( ) A.实验过程中持续通氮气的目的是排除装置内空气 B.用盐酸和 K3[Fe(CN)6]溶液检验残留固体的主要成分 C.乙装置中生成白色沉淀、丙装置中溶液褪色 D.丁装置中所盛装的试剂可用澄清石灰水替代 10.我国科技工作者运用 DFT 计算研究 HCOOH 在不同催化剂(Pd 和 Rh)表面分解产生 H2 的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法错误的是( ) A.HCOOH 吸附在催化剂表面是一个放热过程 B.Pd、Rh 作催化剂时 HCOOH 分解产生 H2 的反应热不同 C.该反应过程中有 C-H 键的断裂,还有 C=O 键的生成 D.HCOO* +H* = CO2 +2H*是该历程的决速步骤 11.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中 W、X、Y、Z 均为短周期元素且原子序数依次增大。常温下,0. 1 mol/L Z 的氢化物的水溶液 pH=1,且 Z 与 Y 位于不同周期。下列叙述正确的是( ) A.原子半径:Z>Y>X>W B.氢化物的沸点:Y>X>Z>W C.X 的氧化物的水化物是强酸 D.Y 的某种单质具有杀菌消毒作用 12.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛 (C3H6O3)和合成气,原理如图所示。下列说法错误的是( ) A.催化电极 b 与电源负极相连 B.电解时催化电极 a 附近的 pH 增大 C.电解时阴离子透过交换膜向 a 极迁移 D.生成的甘油醛与合成气的物质的量相等 13.在 25℃时,向 20.00 mL 0.10 mol/L 一元弱碱 MOH 溶液中滴 0.10 mol/L HCl 溶液,混合 溶液的 pH、pOH 变化曲线如图所示。已知 pOH=-lg c(OH-)。下列说法错误的是( ) A.a+b=14 B.Q 点消耗盐酸的体积小于 20. 00 mL C.M 点和 N 点溶液中, 相等 D.当 V(HCl)=10.00 mL 时,c(M+)-c(MOH) =c(OH-)-c(H+) 二、非选择题: (一)必考题: 26.(14 分) 二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受 热易分解。甲醇法制制备二氧化氯的工艺如下: c(H ) c(MOH) c(M ) + + ⋅ 回答下列问题: (1)ClO2 可用于纸浆漂白、杀菌消毒是因其具有 性。 (2)加入“发生器”的浓硫酸先稀释为 63%H2SO4,冷却后加入反应器的原因是 。实际操作中再“发生器”中加入适量 NaCl 以加快反应速率,若 NaCl 过量会发生成污染环境的一种气体的分子式为 。 (3)若 1molCH3OH 反应时转移 6mole-,则“发生器”中发生反应的主要化学方程式 为 。 (4)Na2SO4·10H2O 和 Na2SO4 的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至 有大量晶体析出、 、经干燥得 Na2SO4 固体。 (5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的 电极反应式为 。 (6)与甲醇法制备二氧化氯相比,电解法的优点是 (写出 2 点)。 27.(15 分) 苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲 醇的反应原理和有关数据如下: 实验步骤:如图所示,在装有电动搅拌器的 250mL 三颈烧瓶里加入 9.0 g 碳酸钾(过量), 70.0 mL 水,加热溶解,再加入 2.0 mL 四乙基溴化铵[(CH3CH2)4NBr]溶液和 10.0 mL 氯 化苄。搅拌加热回流反应 1~1.5h。反应结束后冷却,并转入 125 mL 分液漏斗中,分出有 机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。 最后进行蒸馏纯化,收集 200 ~208 ℃的馏分,得 8.4 mL 苯甲醇。 回答下列问题: (1)仪器 X 的名称是 ,冷却水应从 (填“上口”或“下口”)通入。 由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是 (填字母)。 (2)本实验中加入无水硫酸镁的目的是 。从绿色 化学角度考虑,萃取剂宜采用 (填字母)。 A.乙醇 B.乙酸乙酯 C.苯 D.氯仿 (3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法 (填“是” 或“否”)正确,其理由是 。 (4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是 。 (5)本实验苯甲醇的产率为 % (计算结果保留一位小数)。 28.(14 分) CH4—CO2 催化重整不仅可以得到合成气(CO 和 H2),还对温室气体的减排具有重要意义。 (1)在标准状态下,由元素最稳定的单质生成 1 mol 纯化合物时的反应热称为该化合物的 标准摩尔生成焓。各物质的标准摩尔生成焓如下表: 则制备合成气的反应 CH4(g)+ CO2(g)⇌ 2CO(g) +2H2(g)在标准状态下的反应热 ΔH= kJ/mol。 (2)在刚性容器中,当投料比 n(CH4)/n(CO2)=1.0 时,CO2 的平衡转化率( )与温度 (T)、初始压强(p)的关系如图所示。 ①由图可知:压强 P1 2 MPa(填“>”、“<”或“=”),理由是 。 ②当温度为 T3、压强为 p1 时,a 点的 正_____ 逆(填“>”、“<”或“=”)。 ③若起始时提高投料比 n(CH4)/n(CO2),则 CO2 的平衡转化率将 (填“升高”或 “降低”)。 ④起始时向容器中加入 1mol CH4 和 1mol CO2,在温度为 T6。、初始压强为 2MPa 时反应, 该反应的 Kp= (MPa)2。 (3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组 计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的 关系如图。 α v v 当投料比 n(CO2)/n(CH4)=2.0 时,要使积碳量最小,应调节温度为 ℃。 (二)选考题: 35.[化学——选修 3:物质结构与性质](15 分) 镍及其化合物是重要的合金材料和催化剂。 (1)基态镍原子的价电子排布式为 ,它核外有 种运动状态 不同的电子。 (2)Ni2+可以形成多种配离子,比如[ Ni( NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化 方式为 ,与 CN-互为等电子体的一种分子是 。[Ni(NH3)4]2+ 中 H-N-H 键角比 NH3 分子中 H-N-H 键角 (填“大”、“小”或“相等”), 原因是 。 (3)元素铜与镍的第二电离能分别为:I2(Cu)= 1958 kJ/mol、I2(Ni) = 1753 kJ/mol ,铜的第 二电离能更大的原因是 。 (4)NiO 的晶体结构如图甲所示,其中离子坐标参数 A 为(0,0,0),B 为(1,1,0), 则 C 离子坐标参数为 。 (5)一定温度下,NiO 晶体可以自发地分散并形成“单分子层”,可以认为 O2-作密置单层 排列,Ni2+填充其中(如图乙),已知 O2-的半径为 a pm,设阿伏加德罗常数的值为 NA,每 平方米面积上分散的该晶体的质量为 g(用含 a、NA 的代数式表示)。 36.[化学——选修 5:有机化学基础](15 分) 化合物 M 是有机合成重要的中间体,其合成路线如下: 回答下列问题: (1)B 的名称为 。 (2)M 中的官能团名称是 ;④的反应类型为 。 (3)反应⑤所需的试剂和条件是 。 (4)反应⑥中的 C2H5ONa 仅提供碱性环境,则⑥的反应方程式为 。 (5)化合物 D 有多种同分异构体,符合下列条件的同分异构体共有 种(不考虑立体 异构)。 ①能与碳酸氢钠溶液反应放出气体; ②分子中含有六元环。 其中核磁共振氢谱有 5 组峰,且峰面积之比为 1:2:3:4:4 的结构简式为 。 (6)设计由乙烯和 为原料制备 的合成路线 (无机试剂任选)。 【参考答案】查看更多