- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
云南省大理市下关第一中学2019-2020学年高二上学期期末考试化学试题
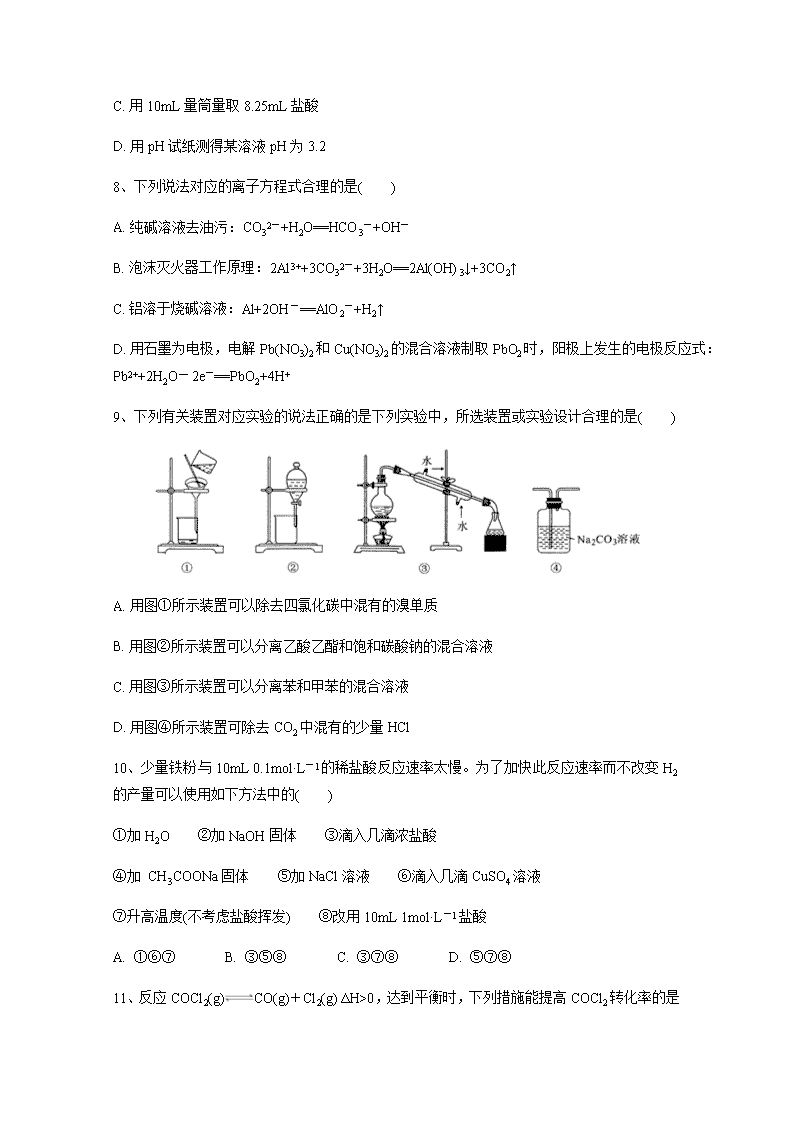
下关一中2019~2020学年高二上学期期末考试 化学试卷 试卷满分100分 考试时间90分钟 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Fe-56 Cu-64 Zn-65 第 Ⅰ 卷 选择题(共46分) 一、选择题(每小题只有一个选项符合题意,共23小题,每小题2分,共46分) 1、下列关于化学与生产、生活的认识不正确的是( ) A. 石油分馏得到的汽油是纯净物 B. 使用清洁能源是防止酸雨发生的重要措施之一 C. 燃料电池是将化学能直接转化为电能的装置,所以能量利用率高 D. 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 2、下列化学用语书写正确的是( ) A. 次氯酸的电离方程式:HClO=H++ClO- B. 硫化钠水解的离子方程式:S2-+2H2OH2S+2OH- C. 电解精炼铜的阴极反应式:Cu-2e-=Cu2+ D. 碳酸钙的溶解平衡:CaCO3(s)Ca2+(aq)+CO32-(aq) 3、设NA为阿伏加德罗常数的数值,下列说法正确的是 A. 标准状况下,2.24L CCl4中含有的氯原子数目为0.4mol B. 1mol甲基(-CH3)所含的电子数为9NA C. 16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA D. 2L 0.5mol·L-1碳酸钠溶液中CO32-数目为NA 4、常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A. c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN- B. 使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO4- C. 由水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、K+、CO32-、SO42- D. =10-12的溶液中:Mg2+、Al3+、NO3-、SO42- 5、如图是反应CO(g)+2H2(g)==CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是( ) A. 该反应是吸热反应 B. 使用催化剂后反应热减小 C. 热化学方程式为CO(g)+2H2(g)==CH3OH(g) ΔH=-510 kJ·mol-1 D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化 6、下列依据热化学方程式得出的结论正确的是( ) A. 已知NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ B. 已知2H2(g)+O2(g)==2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 C. 已知2C(s)+2O2(g)==2CO2(g) ΔH=a;2C(s)+O2(g)==2CO(g) ΔH=b,则a>b D. 已知P4(白磷,s)==4P(红磷,s) ΔH<0,则白磷比红磷稳定 7、下列实验操作和数据记录都正确的是( ) A. 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL C. 用10mL量筒量取8.25mL盐酸 D. 用pH试纸测得某溶液pH为3.2 8、下列说法对应的离子方程式合理的是( ) A. 纯碱溶液去油污:CO32-+H2O==HCO3-+OH- B. 泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑ C. 铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑ D. 用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+ 9、下列有关装置对应实验的说法正确的是下列实验中,所选装置或实验设计合理的是( ) A. 用图①所示装置可以除去四氯化碳中混有的溴单质 B. 用图②所示装置可以分离乙酸乙酯和饱和碳酸钠的混合溶液 C. 用图③所示装置可以分离苯和甲苯的混合溶液 D. 用图④所示装置可除去CO2中混有的少量HCl 10、少量铁粉与10mL 0.1mol·L-1的稀盐酸反应速率太慢。为了加快此反应速率而不改变H2的产量可以使用如下方法中的( ) ①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加 CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴CuSO4溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 1mol·L-1盐酸 A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ⑤⑦⑧ 11、反应COCl2(g)CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施能提高COCl2 转化率的是( ) ①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥ 12、25℃时,水的电离达到平衡:H2OH++ OH- ΔH > 0 ,下列叙述正确的是( ) A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B. 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 C. 向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D. 将水加热,Kw增大,pH不变 13、室温下,有下列四种溶液:①0.1mol·L-1 氨水 ②0.1mol·L-1 NH4Cl溶液 ③0.2mol·L-1盐酸与0.2mol·L-1 NH4Cl溶液等体积混合 ④0.2mol·L-1 NaOH溶液与0.2mol·L-1氨水 等体积混合,四种溶液中c(NH4+ )由大到小排列正确的是( ) A. ②③④① B. ④①②③ C. ③②①④ D. ①④②③ 14、下列实验过程可以达到实验目的的是( ) 编号 实验目的 实验过程 A 探究浓度对反应速率的影响 分别向2支盛有等体积、等浓度的FeCl3和CuCl2溶液的试管中同时加入2 mL5%H2O2溶液 B 制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液 C 探究温度对化学平衡的影响 将盛有NO2和N2O4平衡混合气体(常温下)的玻璃球浸于热水中,观察颜色的变化 D 比较金属的活泼性 向两只盛有稀硫酸的烧杯中分别投入铜丝和银丝 15、室温下,相同浓度和体积的盐酸和醋酸溶液,下列说法正确的( ) A. 两者水的电离程度相同 B. 与足量的锌反应盐酸产生的氢气多 C. 盐酸的c(H+)大于醋酸溶液的c(H+) D. 分别与物质的量浓度相同的NaOH溶液完全反应时,盐酸消耗NaOH溶液的体积多 16、常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( ) A. KW的比较:a点>b点 B. 水的电离程度:a>b>c>d C. b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) D. c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) 17、下列有关电解质溶液的说法正确的是( ) A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中减小 B. CH3COONa溶液从20℃升温至30℃,溶液中增大 C. 向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中增大 D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中不变 18、我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( ) A. 放电时,a电极反应 B. 放电时,溶液中离子的数目增大 C. 充电时,a电极接外电源负极 D. 充电时,b电极每增重0.65g,溶液中有0.02mol I-被氧化 19、下列有机物实际存在且命名正确的是( ) A. 2,2-二甲基丁烷 B. 2-甲基-5-乙基己烷 C. 3-甲基-2-丁烯 D. 3,3-二甲基-2-戊烯 20、下列烃进行一氯取代后,只生成三种沸点不同产物的是( ) A. (CH3)3CCH2CH3 B. (CH3CH2)2CHCH3 C. (CH3)2CHCH(CH3)2 D. (CH3)2CHCH2CH2CH3 21、下列有关除杂质(括号中为杂质)的试剂及操作中,不正确的是( ) A. 乙烷(乙烯):溴水,洗气 B. 乙醇(水):蒸馏 C. 乙酸乙酯(乙酸):饱和碳酸钠溶液,分液 D. 溴苯(溴):氢氧化钠溶液,分液 22、某有机物A用质谱仪测定如图1,核磁共振氢谱图如图2,则A的结构简式可能为( ) A. CH3OCH3 B. CH3CHO C. HCOOH D. CH3CH2OH 23、某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确的是 A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:8 C. 无法确定该化合物是否含有氧元素 D. 该化合物中一定含有氧元素 第 Ⅱ 卷 非选择题(共54分) 二、填空题(本题包括4个小题,共54分) 24、(11分)按要求完成下列各题。 (1)从下列物质中选择对应类型的物质的序号填空。 ① CH3OCH3 ② HCOOCH2CH3 ③CH3COCH3 ④ ⑤CH3CHO ⑥ ⑦ A. 属于羧酸的是________; (填序号,下同) B. 属于酯的是________ ; C. 属于醇的是__________; D. 属于酮的是________。 (2)下列各组物质: ① O2和O3 ;②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤和; ⑥和;⑦ CH3CH2NO2和 A.互为同系物的是_________;(填序号,下同) B.互为同分异构体的是________; C.属于同一种物质的是__________; D. 互为同素异形体的是________。 (3)为了测定芳香烃A的结构,做如下实验: ①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2gH2O; ②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,有机物A的分子式为_________。 ③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为_____________。 25、(14分)观察下列装置,回答下列问题。 (1) 甲装置中通入乙醇的电极反应式为_______________________________________。 (2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。 (3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。 (4) 丙装置中总反应的离子方程式为____________________________________________。 26、(13分)以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下: (1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。 (2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。 (3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5 mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,≈1.6 ]。 (4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。 (5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。 (6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。 27、(16分)火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。 (1)脱硝。利用甲烷催化还原NOx: CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol 写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_________________。 (2)脱碳。 方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ①下列条件可以判定该反应到达平衡状态的是_________(填字母)。 A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变 C.容器内压强不变 D.反应不再释放热量 方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g) ∆H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题: ② 图中p1、p2、p3的大小关系是_________________,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是____________。 ③ 900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为______(保留一位小数),该反应的平衡常数K=_________。 方法三:用NaOH溶液吸收CO2。 ④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=_______。(已知:室温下,H2CO3的K1=4×10-7,K2=5×10-11。lg2=0.3) (3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是_______________(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)____c(NH3·H2O)(填“>”、“<”或“=”)。 下关一中2019~2020学年高二上学期期末考试 化学参考答案 一、选择题(每小题2分,共46分) 题号 1 2 3 4 5 6 7 8 9 10 答案 A D B D D A B D B C 题号 11 12 13 14 15 16 17 18 19 20 答案 B B C C C D D C A A 题号 21 22 23 答案 B D D 二、填空题(本题包括4个小题,共54分) 24.(1)④;②;⑦;③ (2)④;②⑦;⑤;①; (3)92;C7H8, 25.(1) C2H5OH-12e-+16OH-==2CO32-+11H2O; (2) 4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;有红色固体(Cu)析出; (3) 1;CuO或CuCO3; 0.01mol; (4) Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。 26.(1)粉碎 / 加热 / 搅拌 / 适当增大硫酸浓度 (2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O (3)1.6×10-11 (4)静置,在上层清液中继续滴加NaOH溶液,无沉淀生成 (5)2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O (6)Fe-6e-+8OH-==FeO42-+4H2O;阴 27.(1)CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol (2)①CD ②p1<p2<p3 ;Ka=Kb<Kc ③ 66.7%; mol/L ④ 9.7 (3)NH4++H2ONH3·H2O+H+;=查看更多