- 2021-07-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省如皋中学2019-2020学年高二上学期期末教学质量调研化学试题
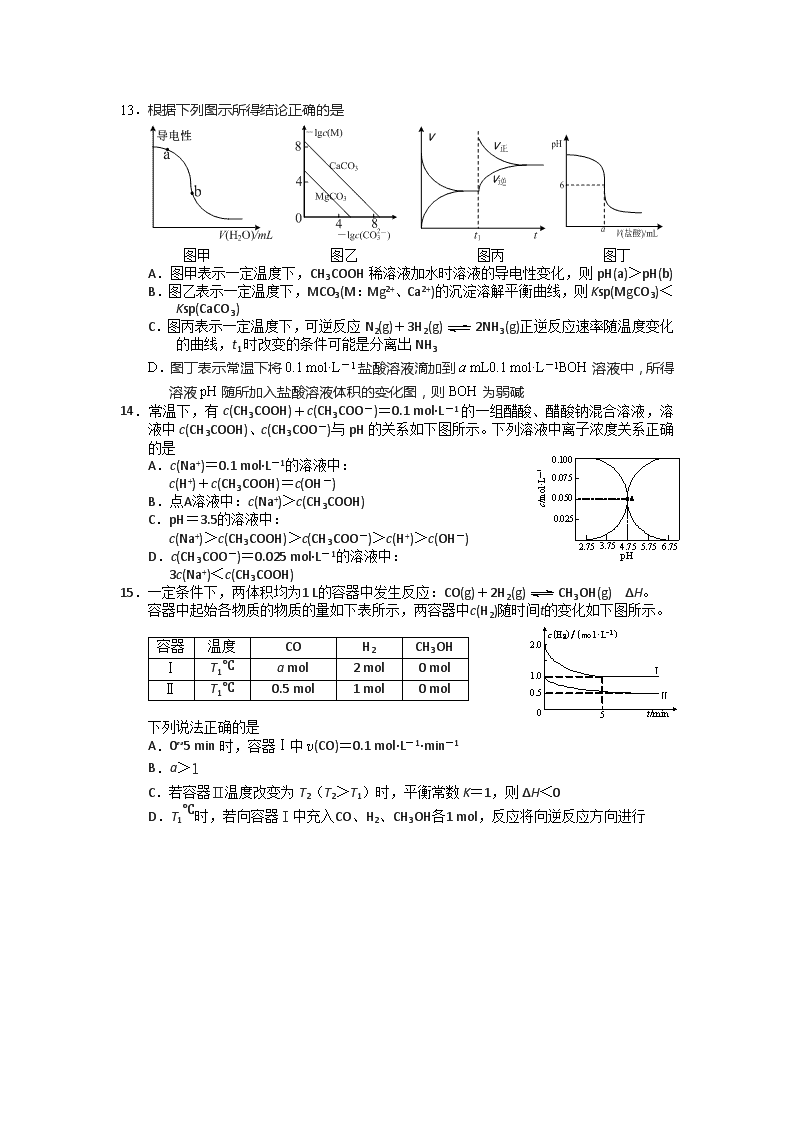
2019~2020学年度高二年级第一学期期末教学质量调研 化学试题(选修) 总分:100分 考试时间:90分钟 选择题 单项选择题:本题包括10 小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。 1.研究化学反应的热效应有利于更好的利用化学能。下列说法正确的是 A.升高温度可以增加分子的活化能 B.放热反应任何条件下一定能自发进行 C.生成物的键能总和大于反应物的键能总和的反应为放热反应 D.生成物总能量高于反应物总能量的反应为放热反应 2.下列表示反应NH3+HCl=NH4Cl中相关微粒的化学用语正确的是 A.NH3的电子式: B. Cl-的结构示意图: C.中子数为1的氢原子:H D.NH4Cl的水解方程式:NH+H2O=NH3·H2O+H+ 3.下列有关物质的性质与用途具有对应关系的是 A.纯碱溶液呈碱性,可用于去油污 B.SO2具有氧化性,可用于漂白纸浆 C.NH3具有还原性,可用作制冷剂 D.FeCl3溶液呈酸性,可用作印刷电路板的蚀刻剂 4.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.0.1 mol·L-1 CaCl2溶液中:Ag+、Cu2+、SCN-、NO B.能使甲基橙变红的溶液中:Na+、Mg2+、HCO、Cl- C.=1×10-12 mol·L-1的溶液:K+、Na+、AlO、SO D.0.1 mol·L-1 FeSO4溶液中:Na+、NH、ClO-、MnO 5.下列指定反应的离子方程式正确的是 A.Zn与稀醋酸反应:Zn+2H+=Zn2++H2↑ B.AlCl3溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH C.Cu与稀硝酸反应:Cu+4H++2NO=Cu2++2NO2↑+2H2O D.电解K2MnO4碱性溶液制KMnO4:2MnO+2H+2MnO+H2↑ 6.下列实验原理或操作正确,能达到实验目的的是 铁制品 铜 CuSO4溶液 A.测pH B.蒸发制无水MgCl2 C.滴定 D.铁制品镀铜 7.在给定条件下,下列选项所示的物质间转化均能实现的是 A.Cl2Ca(ClO)2(aq)HClO B.NH3NO2HNO3 C.BaCl2(aq)BaSO3BaSO4 D.Al NaAlO2(aq)Al2O3 8.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层有7个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列说法正确的是 A.原子半径:r(X)<r(Y)<r(Z)<r(W) B.X元素的最高正价为+7 C.最高价氧化物对应水化物的酸性:Z<W D.Y的简单阳离子和Z的简单阴离子的电子层结构相同 9.“锂—呼吸CO2电化学装置”放电时的原理如下图所示,下列说法正确的是 A.金属Li电极发生还原反应 B.多孔碳电极的电极反应式为: 2CO2+2e-=C2O C.每生成0.1 mol Li2C2O4,电路中有0.1 mol e-发生转移 D.电池“吸入”CO2时将电能转化为化学能 10.下列有关说法正确的是 A.将纯水加热后,水的电离程度增大,pH不变 B.反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是ΔS<0 C.常温下,向0.1 mol·L-1 NH4Cl溶液中通入少量HCl,溶液中增大 D.常温下,向CaCO3悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小 不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。 11.丹参醇是一种中药成分,结构简式如图所示。下列关于丹参醇的描述正确的是 A.能与浓硫酸共热后发生消去反应 B.能与NaHCO3溶液反应放出气体 C.分子中含有2个手性碳原子 D.1 mol丹参醇最多能与5 mol H2发生加成反应 12.根据下列实验操作和现象所得到的结论正确的是 选项 操作和现象 结论 A 向某黄色溶液中加入淀粉KI溶液,溶液变为蓝色 溶液中含Fe3+ B 等浓度的Na3PO4和NaCl溶液,Na3PO4溶液碱性强 非金属性:Cl>P C 等体积等pH的HA与HB两种酸溶液分别与足量的锌充分反应,HA放出的氢气多 酸性: HA<HB D 向浓度均为0.1 mol·L-1 Na2SO4和Na2CO3的混合溶液中加入过量BaCl2溶液,反应后过滤,向滤渣中加入盐酸,有气体生成 Ksp(BaCO3)< Ksp(BaSO4) 13.根据下列图示所得结论正确的是 图甲 图乙 图丙 图丁 A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b) B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3) C.图丙表示一定温度下,可逆反应N2(g)+3H2(g)2NH3(g)正逆反应速率随温度变化的曲线,t1时改变的条件可能是分离出NH3 D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱 14.常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是 A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-) B.点A溶液中:c(Na+)>c(CH3COOH) C.pH=3.5的溶液中: c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) D.c(CH3COO-)=0.025 mol·L-1的溶液中: 3c(Na+)<c(CH3COOH) 15.一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g)CH3OH(g) ΔH。 容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。 容器 温度 CO H2 CH3OH Ⅰ T1℃ a mol 2 mol 0 mol Ⅱ T1℃ 0.5 mol 1 mol 0 mol 下列说法正确的是 A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1 B.a>1 C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0 D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行 非选择题(共60分) 16.(10分)根据以下信息书写反应方程式: ⑴Co3O4被认为在替代贵金属基催化剂中具有良好前景,利用钴渣[含Co(OH)3、Fe(OH)3等]制备CoC2O4的工艺流程如下: ①写出“还原”中Co(OH)3反应的离子方程式: ▲ 。 ②写出“氧化”(ClO被还原为Cl-)中Fe2+反应的离子方程式: ▲ 。 ③写出“沉铁”反应的离子方程式: ▲ 。 ④NaClO3可以由惰性电极电解食盐水得到,写出该反应的化学方程式: ▲ 。 ⑵一种NH3催化还原NO的物质转化如右图所示。若参与反应的NH3和O2的物质的量之比为4∶1,写出转化时总反应的化学方程式: ▲ 。 17.(10分) 盐酸伊托必利属促胃肠动力药,主要用于治疗功能性消化不良。其合成路线如下: ⑴A→B的反应类型为 ▲ 。 ⑵X的分子式为C9H9O3Cl,则X的结构简式为 ▲ 。 ⑶写出同时满足下列条件的C的一种同分异构体的结构简式: ▲ 。 Ⅰ.既能发生银镜反应,也能发生水解反应,水解产物之一能与FeCl3溶液显紫色; Ⅱ.含有氨基,核磁共振氢谱图中有4个峰。 ⑷已知:(R表示烃基或氢原子)。请写出以和NH2OH为原料制备的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。 18.(10分)加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。 ⑴加碘食盐中KIO3的制备可以采用以下两种方法: 方法一:碘单质与KClO3溶液反应生成KIO3和Cl2; 方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3; 两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 ▲ 。 ⑵兴趣小组测定食用精制盐中碘元素含量的实验步骤为: 步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液; 步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应; 步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。 已知步骤3中所发生反应的离子方程式为I2+2S2O=2I-+S4O。 ①步骤3中滴定终点的现象是 ▲ 。 ②下列情况会使测定结果偏大的是 ▲ 。 A.装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗 B.装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡 C.滴定时未充分振荡,溶液局部变色就终止 D.若其他读数正确,滴定结束读数时俯视 ③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程。 19.(10分)用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下: ⑴“酸浸”时Fe3O4发生反应的离子反应方程式为 ▲ 。 ⑵“酸浸”过程中加入过量硫酸的目的是 ▲ 和 ▲ 。 ⑶当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 ▲ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32} ⑷“过滤1”所得滤渣除Fe、Al(OH)3外还有 ▲ 。 ⑸“沉铁”反应的离子方程式为: ▲ 。 ⑹若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 ▲ (填字母)。 A.向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌 B.向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌 C.“过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌 20.(10分)空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。 ⑴已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1 N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1 4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1 工业上合成氨反应N2(g)+3H2(g)2NH3(g) ΔH= ▲ kJ·mol-1 ⑵以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示: ①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH- 已知该反应分为两步,其中第二步的反应为 2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 ▲ 。 ②蒙乃尔筛网处发生的电极反应为: ▲ 。 ⑶NH3可以合成尿素,反应为2NH3(g)+CO2(g)CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如右图所示。 ①下列情况能说明反应达到平衡状态的是 ▲ 。 A.NH3和CO2的物质的量之比为2∶1 B.容器内气体的密度保持不变 C.2v正(NH3)=v逆(CO2) D.各气体的体积分数保持不变 ②起始时NH3和CO2的物质的量之比为 ▲ 。 ③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 ▲ 。 21.(10分)弱电解质在水溶液中的电离状况可以进行定量计算和推测。 ⑴25℃时两种酸的电离平衡常数如表所示。 Ka1 Ka2 HA 1×10-4 H2B 1×10-2 5×10-6 ①25℃时,0.100 mol·L-1的NaA溶液中H+、OH-、 Na+、A-、HA的物质的量浓度由大到小的顺序 是: ▲ 。pH=8的 NaA溶液中由水电离出 的c(OH-)= ▲ mol·L-1。 ②25℃时,0.100 mol·L-1的NaHB溶液pH ▲ 7,理由是 ▲ 。 ③25℃时,向0.100 mol·L-1的Na2B溶液中滴加足量0.100 mol·L-1的HA溶液,反应的离子方程式为 ▲ 。 ⑵已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。 ①25℃,pH=3时溶液中c(H3PO4)∶c(H2PO) = ▲ 。 ②当溶液pH由11到14时,所发生反应的离子方程式为: ▲ 。 答案 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1.C 2.B 3.A 4.C 5.B 6.D 7.A 8.C 9.B 10.C 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.AC 12.C 13.D 14.AD 15.AC 16.⑴①2Co(OH)3+SO+4H+=2Co2++SO+5H2O ②6Fe2++ClO+6H+=6Fe3++Cl-+3H2O ③2Na++4SO+6Fe3++6CO+6H2O=Na2Fe6(SO4)4(OH)12↓+6CO2↑ ④NaCl+3H2ONaClO3+3H2↑ ⑵4NH3+4NO+O24N2+6H2O (每空2分,共10分) 17.⑴取代反应 (1分) ⑵ (2分) ⑶或 (2分) ⑷ (5分) (共10分) 18.⑴2∶5 ⑵①溶液蓝色恰好褪去,且半分钟内不变色 ②AB ③n(Na2S2O3)= 1.0×10-3mol·L-1×12.00×10-3L=12.0×10-6mol 由关系式可知:I2~2Na2S2O3 n(I2)=6.0×10-6mol (1分) 根据方程式:IO+5I-+6H+=3I2+3H2O n(IO)= 2.0×10-6mol (1分) 20.00 g食盐中碘元素的物质的量n(I) =2.0×10-6mol×4=8.0×10-6mol 20.00 g食盐中碘元素的质量m(I) =8.0×10-6mol×127 g·mol-1=1.016×10-3g 碘元素的含量==40.64 mg·kg-1 (2分) (除第⑵③题4分外,其余每空2分,共10分) 19.⑴Fe3O4+8H+=Fe2++2Fe3++4H2O (2分) ⑵提高磁铁矿的浸取率 (1分) 抑制Fe3+等金属离子水解 (1分) ⑶5~6 (2分) ⑷SiO2 (1分) ⑸Fe2++2HCO=FeCO3↓+CO2↑+H2O (2分) ⑹A (1分) (共10分) 20.⑴①(b+-) (2分) ⑵①Fe2O3+6e-+3H2O=2Fe+6OH- (2分) ②4OH--4e-=2H2O+O2↑ (1分) ⑶①BD (2分) ②3∶1 (2分) ③52.94% (1分) (共10分) 21.⑴①Na+、A-、OH-、HA、H+ (2分) 10-6 (1分) ②< (1分) HB-的电离程度大于其水解程度 (1分) ③HA+B2-=A-+HB- (2分) ⑵①1∶10(或0.1) (2分) ②HPO+OH-=PO+H2O (1分) (共10分)查看更多