- 2021-07-07 发布 |
- 37.5 KB |
- 10页

文档介绍
化学卷·2019届河北省大名县第一中学高二上学期第二次月考(2017
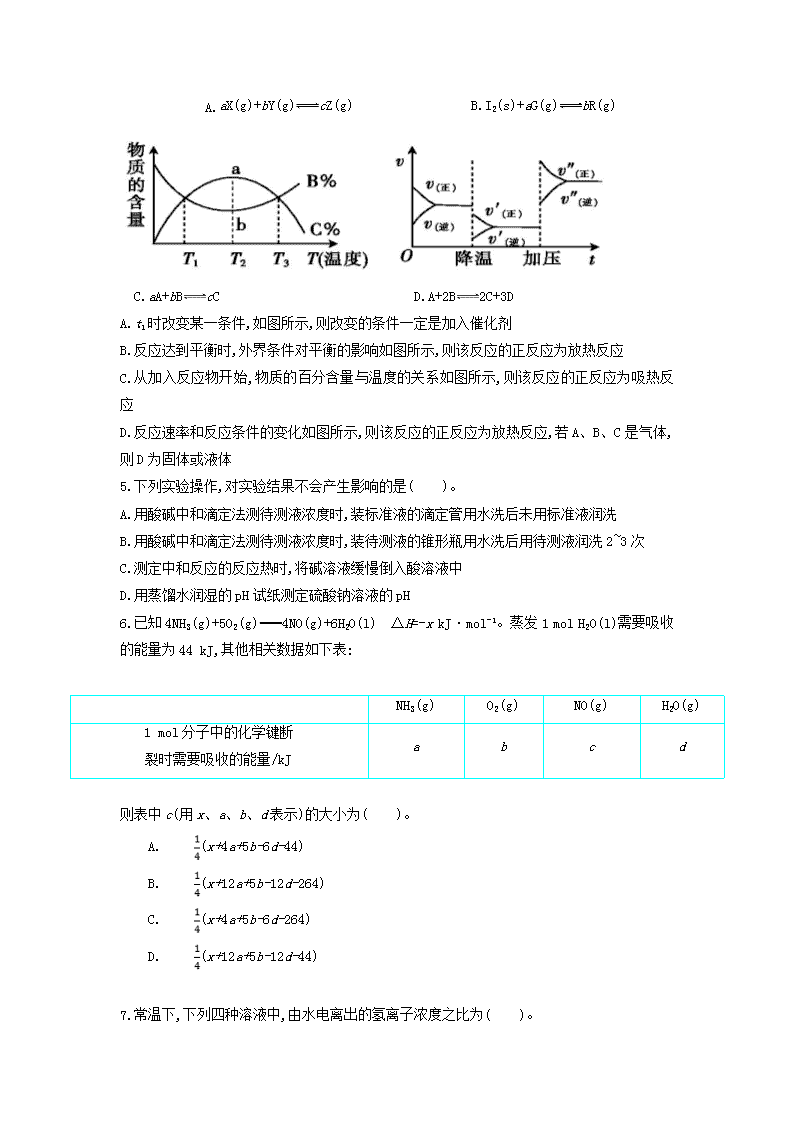
高二月考化学试卷 命题人: 时间:90分钟 满分:100分 第I卷(选择题) 一 选择题:(本题共18小题,每小题3分,共54分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 1.下列叙述正确的是( )。 A.生成物总能量一定低于反应物总能量 B.酒精可用作燃料,说明酒精燃烧是放热反应 C.硝酸铵溶于水时温度降低,这个变化是吸热反应 D.同温同压下,H2和Cl2在光照和点燃条件下反应的ΔH不同 2.某化学反应的能量变化如图所示。下列有关叙述正确的是( )。 A.该反应为放热反应 B.E2可表示形成新的化学键所释放的能量 C.该反应的反应热ΔH=E1-E2 D.加入催化剂可同等程度地降低E1、E2 3.对于反应:A(g)+3B(g)2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )。 A.v(A)=0.01 mol·L-1·s-1 B.v(B)=0.02 mol·L-1·s-1 C.v(B)=0.60 mol·L-1·min-1 D.v(C)=1.00 mol·L-1·min-1 4.根据相应的图像,判断下列相关说法正确的是( )。 A. aX(g)+bY(g)cZ(g) B.I2(s)+aG(g)bR(g) C.aA+bBcC D.A+2B2C+3D A.t1时改变某一条件,如图所示,则改变的条件一定是加入催化剂 B.反应达到平衡时,外界条件对平衡的影响如图所示,则该反应的正反应为放热反应 C.从加入反应物开始,物质的百分含量与温度的关系如图所示,则该反应的正反应为吸热反应 D.反应速率和反应条件的变化如图所示,则该反应的正反应为放热反应,若A、B、C是气体,则D为固体或液体 5.下列实验操作,对实验结果不会产生影响的是( )。 A.用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 B.用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 C.测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 D.用蒸馏水润湿的pH试纸测定硫酸钠溶液的pH 6.已知4NH3(g)+5O2(g)4NO(g)+6H2O(l) ΔH=-x kJ·mol-1。蒸发1 mol H2O(l)需要吸收的能量为44 kJ,其他相关数据如下表: NH3(g) O2(g) NO(g) H2O(g) 1 mol分子中的化学键断 裂时需要吸收的能量/kJ a b c d 则表中c(用x、a、b、d表示)的大小为( )。 A.(x+4a+5b-6d-44) B.(x+12a+5b-12d-264) C.(x+4a+5b-6d-264) D.(x+12a+5b-12d-44) 7.常温下,下列四种溶液中,由水电离出的氢离子浓度之比为( )。 ①pH=0的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液 A.1∶10∶100∶1000 B.0∶1∶12∶11 C.14∶13∶12∶11 D.14∶13∶2∶3 8.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)pC(g),该反应达到平衡时,维持温度不变,将容器体积缩小到原来的,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )。 A.m+n>p B.m+n0,ΔS>0 D.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0 10.在一个不传热的固定容积的密闭容器中,发生可逆反应:mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )。 ①体系压强不再改变 ②体系温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内有m mol A发生断键反应,同时有p mol C也发生断键反应 ⑦体系的密度不再变化 A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.③④⑥⑦ 11.下列说法不正确的是( )。 A.强电解质在溶液中完全电离,不存在电离平衡 B.导电能力强的溶液其溶质是强电解质 C.溶质为同一弱电解质的溶液,当温度不同时,其导电能力也不相同 D.强电解质为液态时,有的导电,有的不导电 12.肼(H2NNH2 )是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(kJ)是 A.194 B.391 C.516 D.658 △H2= -2752KJ/mol △H3 △H1=-534KJ/mol 2N(g)+4H(g)+2O(g) N2H4(g)+O2(g) N2(g)+2H2O(g) 生成物的总能量 反应物的总能量 假想中间物质的总能量 能量 13.下列有关能量的判断和表示方法正确的是( )。 A.由C(s,石墨)C(s,金刚石) ΔH=+1.9 kJ·mol-1可知,石墨比金刚石更稳定 B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 C.由H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1可知,含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)2H2O(l) ΔH=-285.8 kJ·mol-1 14.能证明乙酸是弱酸的实验事实是( )。 A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol·L-1 CH3COOH溶液的pH=2 C.CH3COOH溶液与Na2CO3反应生成CO2 D.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红 15.在淀粉-KI溶液中存在下列平衡:I2(aq)+I-(aq)(aq)。测得不同温度下该反应的平衡常数K如表所示: t/℃ 5 15 25 35 50 K 1100 841 689 533 409 下列说法正确的是( )。 A.反应I2(aq)+I-(aq)(aq)的ΔH>0 B.其他条件不变,升高温度,溶液中c()减小 C.该反应的平衡常数表达式为K= D.25 ℃时,向溶液中加入少量KI固体,平衡常数K<689 16.下列关于一定温度、一定浓度的氨水的说法正确的是( )。 A.NH3·H2O的电离达到平衡的标志是溶液呈电中性 B.是个常数 C.氨水促进了水的电离 D.c(N)+c(H+)=c(NH3·H2O)+c(OH-) 17.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合。可判定该溶液呈中性的依据是( )。 A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)= mol·L-1 D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 18.将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是 A. c(H+) B. Ka(HF) C. D. 第Ⅱ卷(共46分) 19.现有常温下的六种溶液: ①0.01 mol·L-1 CH3COOH溶液; ②0.01 mol·L-1 HCl溶液; ③pH=12的氨水; ④pH=12的NaOH溶液; ⑤0.01 mol·L-1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液; ⑥0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合后所得溶液。 (1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 。 (2)若将②③混合后所得溶液pH=7,则消耗溶液的体积:② _______________(填“>”“<”或“=”,下同)③。 (3)将六种溶液同等程度稀释10倍后,溶液的pH:①_______________②,③ ______________④,⑤______________⑥ (4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈 _______________ (填字母)。 A.酸性 B.碱性 C.中性 20.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g) W (s) + 3H2O (g) 请回答下列问题: ⑴ 上述反应的化学平衡常数表达式为___________________________。 ⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。 ⑶ 上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示: 温度 25℃ ~ 550℃ ~ 600℃ ~ 700℃ 主要成份 WO3 W2O5 WO2 W 第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。 ⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g); WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s) WO2 (g) 的ΔH = ______________________。 ⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为: W (s) +2I2 (g) WI4 (g)。下列说法正确的有________________。 a.灯管内的I2可循环使用 b.WI4在灯丝上分解,产生的W又沉积在灯丝上 c.WI4在灯管壁上分解,使灯管的寿命延长 d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢 21.实验室有一瓶失去标签的某白色固体X,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一。 Ⅰ.现某化学小组通过如下步骤来确定其成分: (1)阳离子的确定: 实验方法及现象: 。 结论:此白色固体是钠盐。 (2)阴离子的确定: ①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。 ②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。 Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下: 步骤i:称取样品1.000 g。 步骤ii:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。 步骤iii:移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。 按上述操作方法再重复2次。 (1)写出步骤ⅲ所发生反应的离子方程式: 。 (2)在配制0.01 mol·L-1 的KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”“偏小”或“无影响”)。 (3)滴定结果如下表所示: 滴定 次数 待测溶液 的体积/mL 标准溶液的体积 滴定前刻度/mL 滴定后刻度/mL 1 25.00 1.02 21.03 2 25.00 2.00 21.99 3 25.00 2.20 20.20 则该变质固体中X的质量分数为 。 22.(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知: ①CO(g)+ O2(g)CO2(g) ΔH=-283.0 kJ·mol-1 ②S(s)+O2(g)SO2(g) ΔH=-296.0 kJ·mol-1 则处理CO、SO2的方法的热化学方程式是 。 (2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知: CO(g)+NO2(g)NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0) 2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0) 若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为 mol,放出的热量为 (用含有a和b的代数式表示)kJ。 (3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ① CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH2 ② 若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2= 。 (4)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O 的形式存在,该废水的处理流程中,NH4+在微生物的作用条件下经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下: 1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 高二月考化学参考答案 BDADB CABBB DBABB BCD 19.【答案】(1)⑥;②③④ (2)> (3)>;>;> (4)ABC 20【答案】(1) (2)60% 吸热反应 (3)2WO3+H2=W2O5+H2O W2O5 WO2 1∶1∶4 (4) (5)ab 21.【答案】Ⅰ.(1)取固体少许,进行焰色反应实验,焰色为黄色 Ⅱ.(1)2MnO4-+5S32-+6H+2Mn2++5S+3H2O (2)偏大 (3)63% 22.【答案】(1)2CO(g)+SO2(g)S(s)+2CO2(g) ΔH=-270 kJ·mol-1 (2)0.3;3(2a+b)╱80 (3)-1160 kJ·mol-1 (4)N(aq)+2O2(g)N(aq)+H2O(l)+2H+(aq) ΔH=-346 kJ·mol-1