- 2021-07-07 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省高安中学2019-2020学年高二上学期期末考试化学试题(A卷)
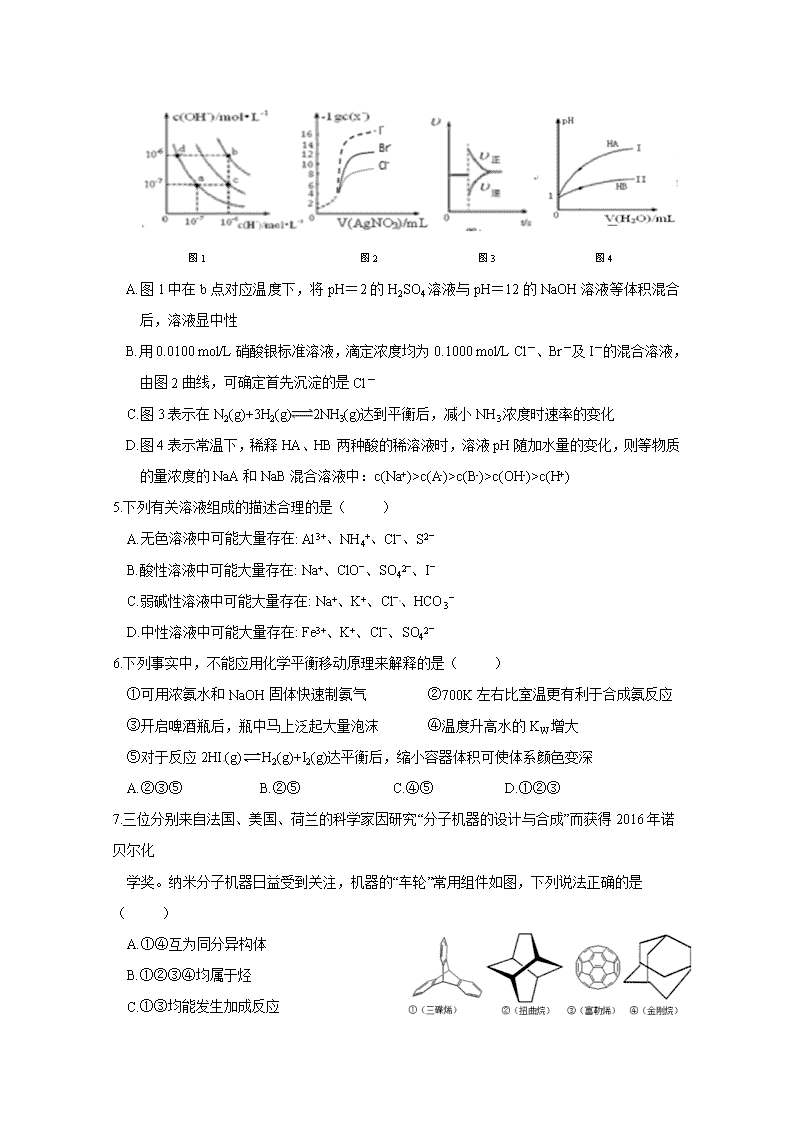
江西省高安中学2019-2020学年上学期期末考试 高二年级化学试题(A卷) 可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 一、选择题(每小题只有一个正确答案,每题3分,共48分) 1.化学与社会、生产、生活密切相关,下列说法不正确的是( ) A.海水淡化可以解决淡水危机,用光催化分解代替电解水制氢气可实现节能环保 B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量 C.普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液 D.用于3D打印材料的光敏树脂是纯净物 2.设NA表示阿伏加德罗常数值,下列说法正确的是( ) A.含NA个CO32-的Na2CO3溶液中,Na+数目小于2 NA B.100g质量分数为46%的乙醇水溶液中氧原子数为4NA C.常温下,1L pH=3的醋酸溶液稀释到10 L时,溶液中H+的数目大于0.01NA D.用惰性电极电解KOH溶液,若阳极产生5.6 L气体,则电路中通过0.5NA电子 3.聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构 表示如下,下列说法不正确的是( ) A.聚维酮的单体是 B.聚维酮分子由(m+n)个单体聚合而成 C.聚维酮碘是一种水溶性物质 D.聚维酮在一定条件下能发生水解反应 4.下列图示与对应的叙述相符的是( ) 图1 图2 图3 图4 A.图1中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性 B.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- C.图3表示在N2(g)+3H2(g)2NH3(g)达到平衡后,减小NH3浓度时速率的变化 D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+) 5.下列有关溶液组成的描述合理的是( ) A.无色溶液中可能大量存在: Al3+、NH4+、Cl‾、S2‾ B.酸性溶液中可能大量存在: Na+、ClO‾、SO42‾、I‾ C.弱碱性溶液中可能大量存在: Na+、K+、Cl‾、HCO3‾ D.中性溶液中可能大量存在: Fe3+、K+、Cl‾、SO42‾ 6.下列事实中,不能应用化学平衡移动原理来解释的是( ) ①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应 ③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大 ⑤对于反应2HI(g)H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深 A.②③⑤ B.②⑤ C.④⑤ D.①②③ 7.三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化 学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如图,下列说法正确的是( ) A.①④互为同分异构体 B.①②③④均属于烃 C.①③均能发生加成反应 D.①②③④的一氯代物均只有1种 8.在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( ) A.反应CO2(g)+C(s)2CO(g)的ΔS>0、ΔH<0 B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ ) 9.下列说法正确的是( ) A.向0.1 mol·L-1氨水中加入少量水,pH减小, 减小 B.同浓度的下列溶液中,① NH4HSO4 ②NH4Cl ③NH3·H2O ④CH3COONH4 ⑤NH4ClO, c(NH4+)由大到小的顺序是:①>②>④>⑤>③ C. 0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) D.常温下,浓度均为0.1 mol·L-1L NaA和HA溶液中pH=9,则c (HA)>c(A-)>c(Na+)>c(OH-)>c(H+) 10.红色基B(2-氨基-5-硝基苯甲醚)的结构简式如图所示,它主要用于棉纤维织物 的染色,也用于制一些有机颜料,若分子式与红色基B相同,且氨基(-NH2)与 硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)为( ) A.10种 B.9种 C.8种 D.7种 11.T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)Z(g)(未配平),各物质的物质的量随时间 变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间 变化的关系如图b所示。下列叙述正确的是( ) A.该反应的正反应是吸热反应 B.T1℃时,若该反应的平衡常数K=50,则T1<T0 C.图a中反应达到平衡时,Y的转化率为37.5 % D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1 12.以下实验操作方法以及结论错误的是( ) ①用燃烧的方法鉴别乙醇、四氯化碳、苯 ②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去 ③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸) 为:中和滴定实验、PH试纸、氢氧化钠、酸碱指示剂。 ④向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则 Ksp(BaCO3)﹤Ksp(BaSO4)源 ⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。 ⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加 AgNO3溶液。 ⑦用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。 A.②③④⑤⑥ B.①②⑥⑦ C.③④⑤⑥ D.②④⑤⑥ 13.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。 下列说法正确的是( ) A.电子流向:A电极→用电器→B电极→电解质→A 电极 B.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g C.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS D.若用该电池在铁器上镀锌,则铁器应与B电极相连接 14.阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成: [来源:学科网] 下列说法正确的是( ) A.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共 有4种 B.邻羟基苯甲醛分子中所有的原子不可能在同一平面[来源:学_科_网Z_X_X_K] C.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① D.反应②中加入适量的NaHCO3可提高阿司匹林的产率[来源:学科网ZXXK] 15. 2L甲醛气体与xL的氧气混合点燃,反应后甲醛和氧气均无剩余,生成的混合气体的体积为 aL(气体体积均在120°C,101kPa时测定)。将aL混合气体通过足量的碱石灰后,测得剩余气体 的体积为bL。若a-b=3.5,则x的值为( ) A. 2 B. 4 C.3.5 D.1.75 16. 25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示, 其中或。下列叙述不正确的是( ) A.曲线m表示与pH的变化关系 B. Ka1(H2X)的数量级为10-7 C.当溶液呈中性时,C(HX-)>C(X2-)>C(H2X) D.25℃时,NaHX溶液中:C(OH-)>C(H+) 二、填空题(共52分) 17.(10分)(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) ==2NO(g) △H=+180.5kJ·mol-1, 汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热 化学方程式______________。 (2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应: (g)+ I2(g)(g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%, 环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。 A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 (3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。 (4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表: n(SO32-):n(HSO3-) 99:1 1:1 1:99 pH 8.2 7.2 6.2 当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。 18.(8分)乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示: 实验步骤: (Ⅰ)合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液, 缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。 (Ⅱ)分离与提纯: ①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。 ②水层用5ml无水乙酸乙酯萃取,分液。 ③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。 ④蒸馏粗产品得到乙酰乙酸乙酯3.9g。 (1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。 (2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。 (3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。 (4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。 (5)本实验的产率为_______ %(结果保留两位有效数字)。 19.(13分)电化学在生产生活中都具有重要的作用和意义。 (1)图1为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图,该电池的负极反应式 为_________。 图1 图2 (2)制备焦亚硫酸钠(Na2S2O5)可采用三室膜电解技术,装置如图2所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_______。电解后,____室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。 (3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题: 实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,电解时发生反应 的化学方程式为________________。溶液X中大量存在的阴离子有________________。 (4)测定混合气中ClO2的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸。将一定量的混合气 体通入混合溶液中充分吸收。 Ⅱ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),以淀粉 溶液为指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。 ①锥形瓶内ClO2与碘化钾反应的离子方程式为 。 ②测得混合气中ClO2的质量为______。 ③测定混合气中ClO2的含量的操作中可能使测定结果偏低的是____(填字母)。 a.滴定管未润洗就直接注入硫代硫酸钠标准液 b.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数 c.锥形瓶用蒸馏水洗净后没有干燥 20.(8分)已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示: 已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据: 金属离子 Fe3+ Fe2+ Al3+ Ni2+ 开始沉淀的pH 1.1 5.8 3.0 6.8 完全沉淀的pH 3.2 8.8 5.0 9.5 ②Ksp(CaF2)=1.46×10-10; ③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。 请回答下列问题: (1)请写出一种能提高“酸浸”速率的措施:______________。 (2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。 (3)“调pH”时pH的调控范围为__________________。 (4)写出“沉镍”时发生反应的离子方程式:__________,当Ca2+沉淀完全时,溶液中 c(F-)>________mol·L-1(写出计算式即可)。 (5)操作a的内容是____________________。 21.(13分)某研究小组按下列路线合成抗抑郁药物吗氯贝胺 请回答: (1)化合物B的官能团名称___________,→A的反应试剂和条件是__________ (2)化合物F的结构简式是______________________ (3)写出C+D→E的化学方程式____________________________________________ (4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关 信息及知识,设计以环氧乙烷( )和化合物F为原料合成X的合成路线 (用流程图表示,无机试 剂任选)。 (5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同 分异构体的结构简式为________________ ①分子中有一个六元环,且成环原子中最多含一个非碳原子。 ②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。 化学参考答案(A卷)[来源:Zxxk.Com] 1-5 DBBDC 6-10BCCBA 11-16 BDCDDC 17.(10分)(1)2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= -746.5 kJ·mol-1 (2分) (2)40%(1分) 3.56×104或3.6×104 (2分) BD(1分) (3)2.2 (2分) (4) c(H+)=c(OH-)<c(SO32-)<c(HSO3-)<c(Na+)(2分) 18. (8分)(1)下(1分); 防止空气中的水蒸气进入反应装置(1分) (2)乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率(1分) (3)分液漏斗(1分); 盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层(1分) (4)除去乙酸(1分) (5)60(2分) 19.(13分)(1) CH3OCH3-12e-+3H2O=2CO2+12H+ (2分) (2)2H2O-4e-=4H++O2↑或4OH--4e- =O2↑+2H2O (1分) a (1分) (3)NH4Cl+2HCl3H2↑+NCl3 (2分) Cl-、OH- (2分) (4) 2ClO2+10I-+8H+=2Cl-+5I2+4H2O(2分) 0.02700g (2分) b(1分) 20.(8分) (1)把废镍催化剂粉碎(或适当加热、适当增大酸的浓度或提高搅拌速率等)(1分) (2)2Fe2++2H++H2O2=2Fe3++2H2O (1分) (3) 5.0≤pH<6.8 (2分) (4)Ni2++C2O42-+2H2O=NiC2O4·2H2O↓ (2分) (1分) (5)过滤、洗涤、干燥(1分) 21.(13分) (1)氯原子 羧基(1分) Cl2 Fe (或FeCl3)(1分) (2)(2分)[来源:学科网] (3)(2分) (4)(3分) (5)4 ()(2分) (2分)查看更多