2017-2018学年河南省中原名校(即豫南九校)高二下学期第一次联考化学试题 Word版
(考试时间:90分钟 试卷满分:100分)
可能用到的相对额子质量: H-1 C-12 O-16 N-14 Na-23 Mg-24 S-32 Fe-56 Zn-65
一、选择题(每个小题只有一个选项符合题意,选对得3分,共42分)
1.《本草纲目》中载有一药物,名“铜青”.藏器日:生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也.铜青则是铜器上绿色者,淘洗用之.时珍曰:近时人以醋制钢生绿,取收晒干货之.后者的反应原理为
A.析氢腐蚀 B.吸氧腐蚀 C. 化学腐蚀 D.置换反应
2.在蒸发皿中加热燕干并灼烧下列物质的溶液,可以得到该溶质的固体物质的是
A.碳酸氢钠 B.硫酸镁 C.氯化铝 D.高锰酸钾
3.常温下,某溶液中由水电高出宋的c(OH-)=1×10-11mol/L,若向该溶液中滴入2-3滴酚酞,溶液的颜色可能是
A.只显红色 B.呈无色 C.无色或蓝色 D.红色或无色
4.下列各组离子在济液中能大量共存的是
A.Na+、OH-、S2O32-、Cl- B.Fe3+、K+、,AlO2-、HCO3-
C.H+、Al3+、CO32-、SO42- D.H+、Na+、HCO3-、Cl-
5.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaC1溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,“溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的
6.下列实验装置或操作设计正确,且能达到目的的是
A.实验①,设计铜锌双液原电池
B.实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀
C.实验③,准确量取一定体积K2CrO7标准溶液
D.实验④,可用于龄证酸性:H2SO4>H2CO3>HClO
7.相同体移的c(H+)=10-2mol/L的盐酸溶液和醋酸溶液分别跟等质量的锌充分反应,下列说法错误的是
A.刚开始时两种溶液中产生H2的速率相同
B.若有一种溶液中锌有剩余,则有剩余的是盐酸溶液
C.若两种溶液中锌均有剩余。则两者产生等量的氢气
D.若两种溶液中锌均无剩余,则两者产生等量的氢气
8.向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
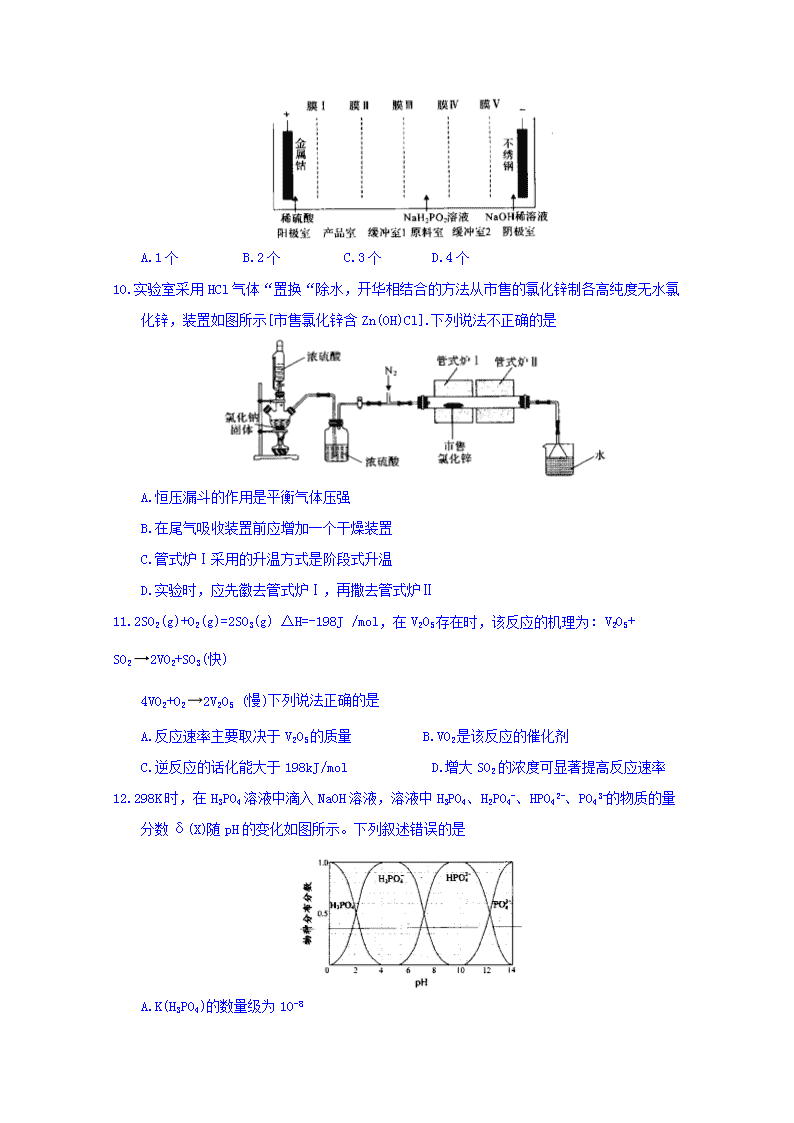
9.次磷酸钴[Co(H2PO2)2·6H2O]可用于化学电镀,共饱和溶液的pH约为6;利用电渗析法可在产品室析出高纯[Co(H2PO2)2·6H2O]电渗析原理如图所示。则阳窝子交换膜有
A.1个 B.2个 C.3个 D.4个
10.实验室采用HCl气体“置换“除水,开华相结合的方法从市售的氯化锌制各高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl].下列说法不正确的是
A.恒压漏斗的作用是平衡气体压强
B.在尾气吸收装置前应增加一个干燥装置
C.管式炉Ⅰ采用的升温方式是阶段式升温
D.实验时,应先徽去管式炉Ⅰ,再撒去管式炉Ⅱ
11.2SO2(g)+O2(g)=2SO3(g) ΔH=-198J /mol,在V2O5存在时,该反应的机理为: V2O5+ SO22VO2+SO3(快)
4VO2+O22V2O5 (慢)下列说法正确的是
A.反应速率主要取决于V2O5的质量 B.VO2是该反应的催化剂
C.逆反应的话化能大于198kJ/mol D.增大SO2的浓度可显著提高反应速率
12.298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
A.K(H3PO4)的数量级为10-8
B.Na2HPO4溶液中:c(PO43-)
c(HPO42-)
D.NaH2PO4溶液显碱性
13.现有的氦合成气,液休燃料合成气制各工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备复合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是
A.O2和H2O均发生还原反应
B.膜Ⅰ侧相当于原电池的正极
C.膜Ⅱ侧发生的反应为; CH4+O2--2e-=2H2+CO
D.膜Ⅱ侧消耗CH4与膜Ⅰ侧生成H的物质的量之比为12
14.在一固定休积的密闭容器中,充入2molA和1molB,发生如下反应2A(g)+B(g)xC(g) 平衡后,C的体积分数为W%,若维持容器容君和温度不变,0.6molA、0.3molB和1.4molC为起始物质。达到平衡后,C的体形分數也为W%。平衡后若缩小容器体积,C的体和分数C%、混合气体平均相对分子质量(M)、平衡常数(K)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
二、(本大题为必答题,包含4个小题,共38分)
15.(10分)
(1) 在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为 ,(填“吸热”或“放热”)反应。
②已知拆开1molH-H键,1molN-H键,1mol
N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(2) N2H4和H2O2混合可作火箭推进剂,已知: 16g液态N2H4和足量氧气反应生成N2(g)和H2O(1),放出310.6 kJ的热量;
2H2O2(1)=O2(g)+2H2O(1) ΔH=-196.4kJ/mol.反应N2H4(1)+2H2O2(g)=N2(g)+4H2O(l)的△H= kJ•mol-1.
(3)实验室用50mL 0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为 ;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液。应选择 mol/L的溶液进行实验。
16.(8分) 某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
(1)电锻名称,铜电极 (填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极 。
(2)两池石墨电板上发生的电极反应式为 ,丁池中发生反应的离子方程式为 。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生 g固体。
17.(6分)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质
H2CO3
NH3·H2O
电离平衡常数
Ka1=4.30×10-7 Ka2=5.61x10-11
1.77 ×10-5
现有常温下0.1mol/L的(NH4)2CO3溶液.
(1)认为该溶液里 性(填“酸”、“中”,“碱”),原因是 。
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是 (填标号)。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
18.(14分) 钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子
Fe3+
Al3+
Fe2+
Co2+
溶液pH
3.2
4.7
9.0
9.2
回答下列问题:
(1) LiCoO2中,Co 元素的化合价为 ,滤液I的主要成分是 。
(2) 已知: 氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是 。“调节pH”除去的离子主要有Al3+和 。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是 。
(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+则反萃取过程加入的试剂X是 。
(5) 向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为 。
三、本大题为选做题,请在下列两个考试模块中任选一个模块作答,请先把要选择答题的模块涂黑,20分)
〇物质结构与性质部分 〇有机化学基础部分
选作(一)[物质结构与性质部分]
19.(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是 (填标号,3分)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是 (填标号,3分)
A.共价键的键能越大,共价键越牢固,由该键开成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____(填标号,3分)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
20.(11分) 据《朝闻天下》报道,河南驻马店发现特大天然碱,铅锌矿产资源。
试回答下列问题:
(l)在元素周期表中,铅与锗同主族,铅的周期数比锗大2。基态铅原子的价层电子排布式 ,有 个未成对电子。
(2)镓与锌同周期,原子序数比锌大1,锌的第一电离能大于镓的第一电离能。其原因是 。
(3)天然碱的化学式Na2CO3·NaHCO3·2H2O。
CO32-的立体构型是 ;H2O中O原子采取 杂化。
(4) 金是贵重金属。冶企工业上,提取企的原理是2[Au(CN)2]+ Zn=2Au+[Zn(CN)4]2-。
①与CN-互为等电子体的离子有 (任写一种); HCN分子中σ键与π键数目之比为 。
②[Zn(CN)4]2-的配体是 。
选作(二) [有机化学基础部分]
21.(1) 共建“带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。
下列贸易商品中,主要成分属于无机物的是 (填标号,3分)
(2)下列有关有机化合物的说法正确的是 (填标号,3分)
A.棱晶烷()与苯互为同分异构体
B.分子式为C8H10的芳吞烃有3种不同的线构
C. 能发生取代、加成、氧化、水解等反应
D.丙烯酸(CH2=CHCOOH) 与山梨酸(CH3CH=CHCH=CHCOOH) 为同系物
(3) 完全燃烧甲烷和乙烯的混合气体1.12L (标准状况下),生成气体进入足量澄清石灰水中,得到6g沉淀。则混合气体中甲烷和乙烯的体积比为 (填标号,3分)
A.1:1 B.1:2 C.2:1 D.4 :1
22.(11分) 烃A在一定条件下可以转化为有机物E,其转化关系如下图。已如烃A在标准状况下的密度为1.16g/L,加热时B与新制氢氧化铜产生砖红色沉淀。E为有浓郁香味、不易溶于水的油状液体。
请回答:
(1) B中官能团的结构简式为 ,C中官能团的名称为 ,E的核磁共振氢谱图中有 组峰。
(2) 写出化学方程式:
② ;③ 。
(3) 下列说法正确的是 (填标号)。
a.C物质与金属制反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制各E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
一、选择题(每个小题只有一个选项符合题意,选对得3分,共42分。)
1—5CBDAD 6—10BCCCD 11—14CDDD
15.(10分)
(1)① 放热(2分) ②N2(g)+3H2(g)2NH3(g) △H=-92kJ/mol(2分)
(2)-817.6(2分)
(3)环形玻璃搅拌棒(2分) 0.55(2分)
16.(8分)
(1)正极(1分) 阴极(1分)
(2)(2分)
(2分)
(3)2.9(2分)
17.(6分)
(1)碱(1分);由于NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性(2分)
(2)a c d(3分)
18.(14分)
(1)+3(2分) NaAlO2、NaOH(2分)
(2)将Co3+还原为Co2+(2分) Fe3+(2分)
(3)温度升高,H2O2分解速率加快,参与酸浸反应的H2O2的量减少,导致浸出率下降(2分)
(4)H2SO4溶液(2分)
(5)Co2++2HCO==CoCO3↓+CO2↑+H2O(2分)
19.(1)B(2)A(3)D
20.(11分)
(1)6s26p2 (1分) 2 (1分)
(2)基态锌原子的价层电子达到全充满的稳定结构(2分)
(3)平面三角形 (2分) sp3 (2分)
(4)①(或)(1分) 1:1 (1分)
②CN- (1分)
21.(1)B(2)A(3)D
22.(11分)
(1) —CHO(1分) 羟基(1分) 3 (1分)
(2)②2CH3CHO +O2 2CH3COOH (3分)
③CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O (3分)
(3)bd(2分)