- 2021-07-07 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省内江市第六中学2020届高三强化训练(二)理综-化学试题
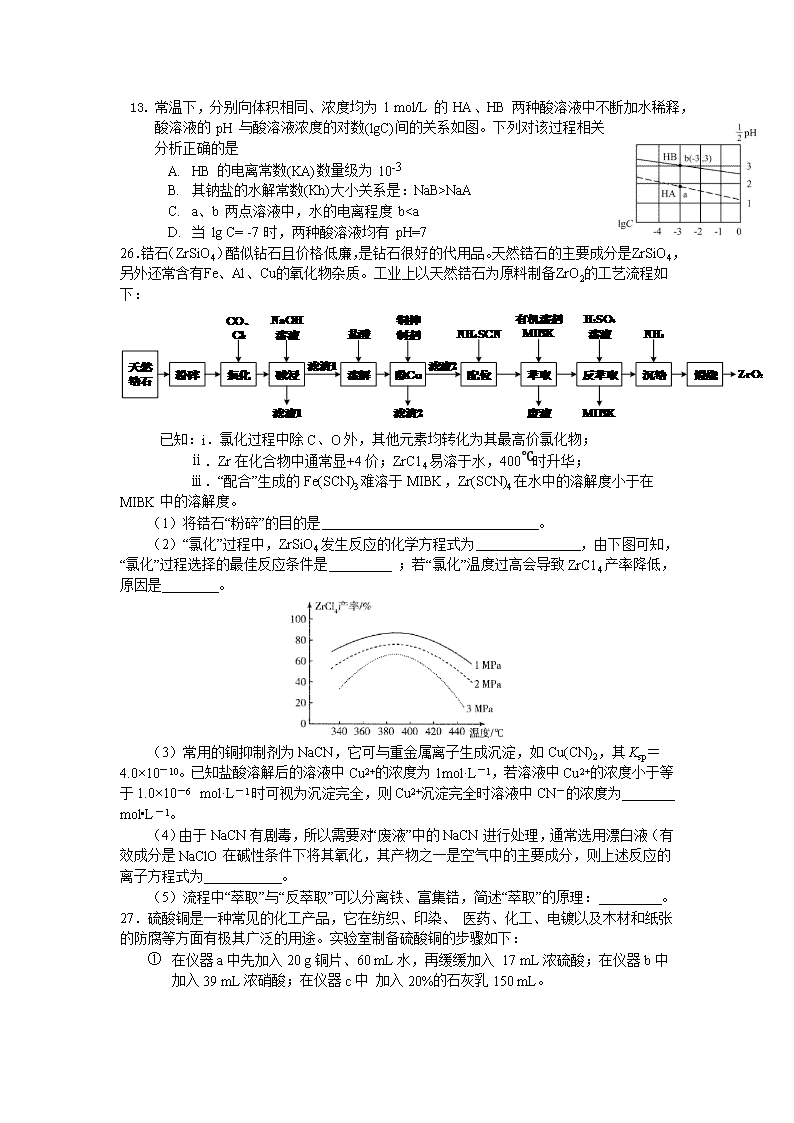
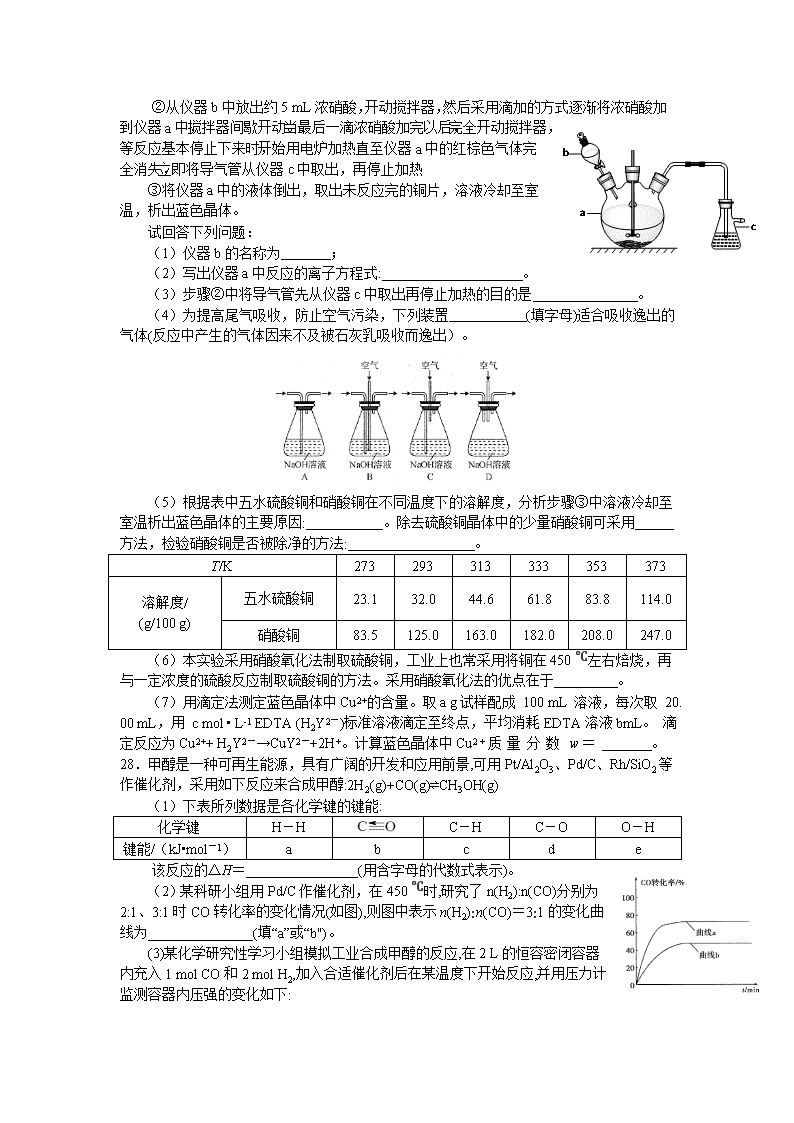
7.在2019年9月25日,北京大兴国际机场正式投运。下列说法不正确的是( ) A. 机场航站楼使用的玻璃为无机非金属材料 B. 机场航站楼使用的隔震支座由橡胶和钢板相互粘结而成,属于新型无机材料 C. 机场航站楼采用的钢铁属于合金材料 D. 机场高速采用了新型自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构所造成的破坏 8. 设 NA 为阿伏加德罗常数的值。下列有关叙述正确的是( ) A.常温下,pH=2 的 H2SO4 溶液 1L 中,硫酸和水电离的 H+总数为0.01NA B.1mol H2O 最多可形成 4NA 个氢键 C.用浓盐酸分别和 MnO2、KClO3 反应制备 1mol 氯气,转移的电子数均为2NA D.常温常压下, O2 与 O3 的混合气体 16g,分子总数为NA 9.有机物 X 分子式为 C3H6O,有多种同分异构体。其中之一丙醛(液态)的燃烧热为1815kJ/mol。下列说法不正确的是( ) A.X的同分异构体中,含单官能团的共5种 B.1mol X 最多能和 1mol H2 加成 C.表示丙醛燃烧热的热化学方程式为:C3H6O(l)+4O2(g) = 3CO2(g)+3H2O(l)△H=+1815kJ/mol D.X的同分异构体其中之一CH2=CHCH2OH可以发生取代反应、加成反应、加聚反应、氧化反应 10.为实现下列实验目的,下表所提供的仪器和试剂都会用到且都正确的是( ) 选项 实验目的 仪器 试剂 A 测定中和热 量筒、温度计、酒精灯 盐酸、NaOH溶液 B 制备氢氧化铁胶体 烧杯、胶头滴管 饱和FeCl3溶液 C 配制10% CuSO4 溶液100 g 100 mL容量瓶、玻璃棒 胆矾 D 实验室制取、收集干 燥的氨气 大试管、酒精灯 氯化铵、消石灰、 无水CaCl2 11. 已知 X、Y、Z、W 是原子序数依次增大的四种短周期主族元素,X 与 Z 同主族,X 为非金属元素,Y 的原子半径在第三周期中最大,Y 与 W 形成的离子化合物对水的电离无影响。下列说法正确的是( ) A. 常温下,X 的单质一定呈气态 B. 非金属性由强到弱的顺序为:X>Z>W C. X 与 W 形成的化合物中各原子均达到 8 电子稳定结构 D. Y、Z、W 的最高价氧化物对应的水化物可能相互反应 12.氧电化学传感器可用于测定O2含量,右图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了b g。下列说法正确的是( ) A.Pt上发生氧化反应 B.Pb上的电极反应式为4OH--4e-===O2↑+2H2O C.反应过程中转移OH-的物质的量为0.25b mol D.待测气体中氧气的体积分数为 13. 常温下,分别向体积相同、浓度均为 1 mol/L 的 HA、HB 两种酸溶液中不断加水稀释,酸溶液的 pH 与酸溶液浓度的对数(lgC)间的关系如图。下列对该过程相关分析正确的是 A. HB 的电离常数(KA)数量级为 10-3 B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA C. a、b 两点溶液中,水的电离程度 b”或“<” ) ,原因是_____________。 (3)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249 ℃,易升华,难溶于水,易溶于有机溶剂,它属于_____________晶体。 (4)环戊二烯(C5H6)结构如图(a),可用于制二茂铁。环戊二烯中碳原子的杂化方式为________。分子中的大π键可用符号表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。 (5)某普鲁士蓝类配合物可作为新型钠离子电池电极材料。它由Na+、Ni2+、Fe3+和CN―构成,其晶胞结构如图(c)。该物质中,不存在________(填标号)。 A.离子键 B. σ键 C. π键 D. 氢键 E. 金属键 (6)该晶胞中Fe3+采用的堆积方式与_______(选填Po、Na、Mg、Cu)相同,单个晶胞的配位空隙中共容纳_____个 Na+。 36.化合物I(4-对羟基苯基-2-丁酮)是国际公认的既安全又获广泛应用的合成香料。由化合物A制备I的一种合成路线如下: 回答下列问题: (1)A的化学名称为________________。 (2)B中的官E团名称是_________________。 (3)F的结构简式为_______________。 (4)⑤的反应类型是________________。 (5)写出满足下列条件的G的同分异构体的结构简式:______________。 i.属于芳香族化合物; ii.既能发生银镜反应,又能发生水解反应; iii.核磁共振氢谱为三组峰,峰面积比为6︰2︰1。 (6)设计由氯乙烷和丙二酸制备的合成路线:______(无机试剂任选)。 强化训练二 化学参考答案 选择题BACBDDB 26. (14分,每空两分) (1)增大反应物的接触面积,加快反应速率,提高原料利用率 (2)ZrSiO4+4Cl2+4CO==ZrC14+SiCl4+4CO2 1MPa、380~400℃(在该区间中的具体数值都可以,给380℃给分,给400℃不给分);高于400℃时ZrCl4升华,产率降低 (3)0.02 (4)2CN-+5C1O-+2OH-==2+5Cl-+N2↑+H2O (5)Fe(SCN)3难溶于MIBK,则Zr(SCN)4被MIBK萃取进入有机层 27.(15分,除标注以外每空2分) (1)分液漏斗;(1分) (2)Cu+4H++2NO3- ==Cu2++2NO2 ↑+2H2O (3)防倒吸 (1分) (4)B (5)五水硫酸铜在室温下的溶解度明显小于硝酸铜的溶解度,易冷却结晶析出; 重结晶;(1分)取少量除杂后的样品,溶于适量稀硫酸中,加入铜片,若不产生无色且遇空气变为红棕色的气体,说明硝酸铜已被除净(或答无明显现象也给分) (6)能耗低,且生成的NO2可以被碱液吸收制取硝酸盐或亚硝酸盐副产品 (7) 28.(14分)(1)(2a+b-3e-d-e)kJ•mol-1 (2)a(1分) (3)0.0125 mol•L-1•min-1; 4 (4)T3>T2>T1;压强越大,CO的体积分数越小,T1、T2、T3对应的CO的体积分数逐渐增大,该反应为放热反应,温度升高,反应向左移动,则T3>T2>T1 (5)①正;(1分)②CH3OH+H2O-6e-=CO2 ↑+6H+ 35 (15分)(1)(2分) 光谱仪(1分) (2)<(1分) 铁失去的是处于半充满状态的3d5的一个电子,相对较难;钴失去3d6上的一个电子后形成稳定的半充满状态,相对容易(2分) (3)分子(1分) (4)sp2和 sp3(2分) (1分) (5)DE(2分) (6)Cu(1分) 4(2分) 36.(15分) (1)对甲基苯酚(2分) (2)(酚)羟基、醛基(2分) (3)(2分) (4)取代反应(2分)(5)(各2分) (6)(3分)查看更多