2017-2018学年湖北省公安县车胤中学高二3月月考化学试题 解析版
湖北省公安县车胤中学2017-2018学年高二3月月考化学试题
考试时间:90分钟 试卷分值:100分
可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Br-80
第Ⅰ卷(单项选择题,16小题。共48分。注意内容1-5题选修4, 6-16题选修5)
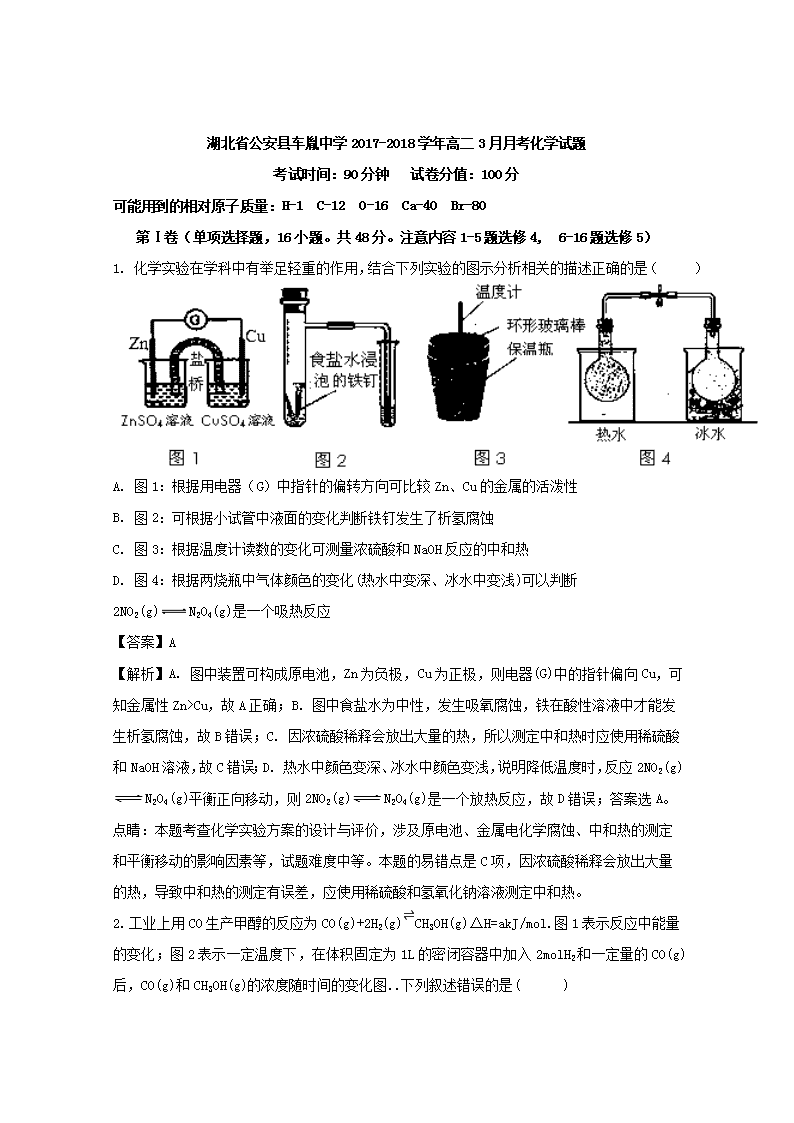
1. 化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
A. 图1:根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的活泼性
B. 图2:可根据小试管中液面的变化判断铁钉发生了析氢腐蚀
C. 图3:根据温度计读数的变化可测量浓硫酸和NaOH反应的中和热
D. 图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)N2O4(g)是一个吸热反应
【答案】A
【解析】A. 图中装置可构成原电池,Zn为负极,Cu为正极,则电器(G)中的指针偏向Cu,可知金属性Zn>Cu,故A正确;B. 图中食盐水为中性,发生吸氧腐蚀,铁在酸性溶液中才能发生析氢腐蚀,故B错误;C. 因浓硫酸稀释会放出大量的热,所以测定中和热时应使用稀硫酸和NaOH溶液,故C错误;D. 热水中颜色变深、冰水中颜色变浅,说明降低温度时,反应2NO2(g)N2O4(g)平衡正向移动,则2NO2(g)N2O4(g)是一个放热反应,故D错误;答案选A。
点睛:本题考查化学实验方案的设计与评价,涉及原电池、金属电化学腐蚀、中和热的测定和平衡移动的影响因素等,试题难度中等。本题的易错点是C项,因浓硫酸稀释会放出大量的热,导致中和热的测定有误差,应使用稀硫酸和氢氧化钠溶液测定中和热。
2. 工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )
A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1
c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
【答案】B
【解析】A. 据图可知,当V(NaOH)=20mL时,发生的反应为:NaOH+H2A=NaHA+H2O,溶质主要为NaHA,此时溶液中同时存在HA−、A2−和H2A,说明H2A是一种二元弱酸,则H2A在水中的电离方程式为:H2AH++HA−、HA−H++A2−,故A错误;B. 当V(NaOH)=20mL时,发生的反应为:NaOH+H2A=NaHA+H2O,溶质主要为NaHA,据图可知,此时溶液中c(A2−)>c(H2A),说明HA−的电离程度大于水解程度,溶液显酸性,则c(Na+)>c(HA−)>c(H+)>c(A2−)>c(OH−),故B正确;C. 当V(NaOH)=30mL时,发生的反应为:NaOH+H2A=NaHA+H2O、NaHA+NaOH=Na2A+H2O,溶液为等物质的量浓度的NaHA和Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA−)+2c(A2−)+c(OH−),根据物料守恒得:3c(HA−)+3c(A2−)+3c(H2A)=2c(Na+),联立两式得:2c(H+)+c(HA−)+3c(H2A)=c(A2−)+2c(OH−),故C错误;D. 由图示关系可知,等体积等浓度的NaOH溶液与H2A溶液混合后得到NaHA溶液,此时溶液中的c(A2−)>c(H2A),说明HA−的电离程度大于水解程度,溶液显酸性,水的电离受到抑制,所以等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小,故D错误;答案选B。
点睛:本题考查酸碱混合溶液的定性判断,利用图象分析酸碱混合时溶液中的溶质是解题的关键,试题难度中等。本题的易错点是B项,当加入NaOH溶液20mL时,所得溶液的溶质为NaHA,再根据图象中c(A2−)>c(H2A),说明HA−的电离程度大于水解程度、溶液呈酸性。
6.
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( )
A. 蒸馏 B. 干馏 C. 升华 D. 萃取
【答案】C
【解析】“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”,涉及到用加热的方法,将被提纯物质气化、冷凝为固体的过程,为升华操作,故答案选C。
7. 当前在人类已知的化合物中,种类最多的是( )
A. ⅠA族元素的化合物 B. ⅣA族元素的化合物
C. ⅥA族元素的化合物 D. ⅥB族元素的化合物
【答案】B
【解析】试题分析:第ⅣA族元素的化合物为碳族元素,主要为氧化物、酸、盐及某些氢化物,形成的有机化合物已超过3000万种,化合物品种最多。故选B。
考点:元素周期律和元素周期表的综合应用
点评:本题考查常见的化合物的种类,明确有机物在人类生活、生产中的重要应用是解答本题的关键,较简单。
8. 相同质量的下列各种烃,完全燃烧消耗V(O2)【同温同压】最多的是( )
A. CH4 B. C2H4 C. C2H2 D. C6H6
【答案】A
【解析】由C~O2~CO2、4H~O2~2H2O进行比较可知,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,则烃中氢的质量分数越大,等质量时消耗的O2越多,四个选项中C、H原子个数比分别为1:4、1:2、1:1、1:1,显然CH4中氢的质量分数最大,则等质量时甲烷消耗的氧气最多,故答案选A。
9. 烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是( )
A. 4−甲基−3−丙基戊烷 B. 3−异丙基己烷
C. 2−甲基−3−丙基戊烷 D. 2−甲基−3−乙基己烷
【答案】D
【解析】选择分子中含有碳原子数最多的碳链为主链,并从离支链较近的一端给主链的碳原子编号,该物质的名称是2-甲基-3-乙基己烷,故D正确,故选D。
点睛:本题考查了烷烃的命名,为高频考点。该题的关键是明确有机物的命名原则,选择分子中含有碳原子数最多的碳链为主链,从离支链较近的一端给主链的碳原子编号。
10. 不能直接用乙烯为原料制取的物质是( )
A. CH3CH2Cl B. CH2Cl-CH2Cl C. D.
【答案】D
【解析】A、乙烯和氯化氢加成生成氯乙烷,A不符合题意;B、乙烯和氯气加成生成CH2ClCH2Cl,B不符合题意;C、乙烯发生加聚反应生成聚乙烯,C不符合题意;D、乙烯不能直接转化为聚氯乙烯,D符合题意,答案选D。
11. 某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
① 分子中具有7个碳原子的芳香烃 ② 分子中具有4个碳原子的烷烃
③ 分子中具有l2个氢原子的烷烃 ④ 分子中具有6个碳原子的烷烃
⑤ 分子中具有8个碳原子的烷烃
A. ①②③ B. ③⑤ C. ③④⑤ D. ②③④⑤
【答案】B
【解析】分子中含7个碳原子的芳香烃只能是甲苯,没有同分异构体,不符合;此题有两个限制条件,满足第一个条件只要是含4个碳原子及其以上的烷烃即可,满足第二个条件的烷烃分子中,连在同一个碳原子上的氢原子等效、连在同一个碳原子上的甲基上的氢原子等效、具有镜面对称的碳原子上的氢原子等效,烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,符合这些条件的烷烃有:新戊烷、2,2,3,3−四甲基丁烷等,综上所述,,③⑤正确,答案选B。
12. 已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮.如: ,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构共有( )种
A. 4 B. 5 C. 6 D. 7
【答案】D
【解析】化学式为C10H20的烯烃经臭氧氧化后在Zn存在下水解只生成一种有机物,说明该烯烃为完全对称的结构,也就是碳碳双键的两侧各有一个4个碳原子的烃基与不饱和碳原子相连,具体连接方式有:①.C4H9-CH=CH-C4H9,-C4H9有四种结构;②.C3H7-C(CH3)=C(CH3)-(C3H7),丙基有二种结构;③.(CH3CH2)2-C=C-(CH3CH2)2
,乙基只有一种结构,则符合条件的结构共有7种,答案选D。
13. 已知甲苯的结构简式为 ,其二氯代物的同分异构体有( )
A. 7种 B. 8种 C. 9种 D. 10种
【答案】D
【解析】甲苯分子中的氢原子均可以被氯原子取代,发生二元取代时,可以取代甲基上的2个H原子,也可以取代甲基上1个H原子、苯环上1个H原子,还可以全部取代苯环上的2个H原子,若取代甲基上的2个H原子,有1种结构;若取代甲基上1个H原子、苯环上1个H原子,则苯环上的Cl原子相对于甲基有邻、间、对3种结构;全部取代苯环上的2个H原子,若其中1个Cl原子与甲基相邻,另一个Cl原子有如图所示四种取代位置,有4种结构,若其中1个Cl原子处于甲基的间位位置,另一个Cl原子有如图所示2种取代位置,有2种结构,则甲苯的二氯代物共有1+3+4+2=10种,故答案选D。
点睛:本题考查同分异构体的判断,难点是判断甲苯的二氯代物时氯原子位置的确定,从甲苯的结构可知,甲基上的氢原子和苯环上的氢原子均可被取代,先确定一个氯原子的位置,再采用“定一移一”的方法写出相应的结构即可,试题难度中等。
14. X、Y两种有机物的分子式不同,但均含有C、H或C、H、O元素,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时耗氧量和生成水的物质的量也不变.则下列有关判断正确的是( )
A. X、Y分子式中氢原子数不一定相同,碳原子数一定不同
B. X、Y分子式中碳原子数一定相同,氢原子数一定不同
C. 若X为CH4,则相对分子质量最小的Y是乙酸或甲酸甲酯
D. 若X为C2H6,则相对分子质量最小的Y的同分异构体只有2种
【答案】C
【解析】总物质的量一定的有机物X、Y以任意比例混合,完全燃烧时生成水的物质的量不变,则两种有机物的分子式中氢原子的个数相同,耗氧量不变,说明X、Y两种有机物的分子式应相差若干个“CO2”基团,A. 由上述分析可知,X、Y分子式中氢原子数一定相同,故A错误;B. 同理,X、Y分子式中氢原子数一定相同,故B错误;C. 若X为甲烷,则相对分子质量最小的Y的分子式为C2H4O2,分子式为C2H4O2
的有机物可以是乙酸也可以是甲酸甲酯,故C正确;D. 若X为C2H6,则相对分子质量最小的Y的分子式为C3H6O2,分子式为C3H6O2的有机物可以是甲酸乙酯、乙酸甲酯、丙酸等,同分异构体数目多于2种,故D错误;答案选C。
15. 有三种有机物的分子式均为C8H8,其键线式分别表示为 X:,Y:,Z:。下列说法正确的是:
A. X、Y、Z都能发生氧化反应,X和Z还能发生加聚反应
B. X、Z分子中所有原子一定在同一平面内
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目相同
D. X、Y、Z都能使溴的四氯化碳溶液褪色
【答案】A
...............
16. 现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图.下列有关说法错误的是( )
A. 操作①用到的玻璃仪器主要有分液漏斗、烧杯
B. 工业制备无水E物质的方法是在E中加生石灰后进行操作②
C. 试剂b可用硫酸
D. 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸
【答案】D
【解析】分离乙酸乙酯、乙酸、乙醇的混合物,加入的试剂a为饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠溶液,要实现乙酸乙酯与乙酸、乙醇的分离,操作①为分液,可分离出有机层和水层;对水层中的乙酸钠和乙醇进一步分离时,应采取的操作②为蒸馏,分离出乙醇;根据强酸制弱酸的原理,向乙酸钠溶液中加入的试剂b可以为硫酸,和乙酸钠反应得到乙酸,再进行操作③蒸馏即可分离出乙酸。A. 操作①为分液,用到的玻璃仪器主要有分液漏斗、烧杯,故A正确;B. 由上述分析可知,E为乙醇,在E中加生石灰后进行操作②蒸馏即可,故B正确;C. 由上述分析可知,试剂b可用硫酸,故C正确;D. 操作③为蒸馏,不需要漏斗等仪器,故D错误;答案选D。
点睛:本题主要考查混合物的分离和提纯,掌握物质性质的异同及流程中混合物的分离方法为解题的关键,试题难度中等。本题的易错点是D项,从乙酸的水溶液中分离乙酸时,采用的是蒸馏操作,而漏斗、烧杯、玻璃棒、滤纸等是过滤时使用的实验仪器,应选用蒸馏烧瓶、酒精灯、冷凝管等仪器。
第Ⅱ卷(5大题,共52分)
17. 按要求完成下列问题:
(1)甲基的电子式___________。
(2)写出由丙烯制备聚丙烯的化学反应方程式_______________________。
(3)反式2 -丁烯的结构简式______________________________
(4)与H2加成生成2,5 - 二甲基己烷的炔烃的系统命名___________________________
(5)的系统命名_____________________________________。
【答案】 (1). (2). (3). (4). 2,5-二甲基-3-己炔 (5). 4-甲基-2-乙基-1-戊烯
【解析】(1). 甲基中的3个氢原子和碳原子以共价键相结合,甲基的电子式为,故答案为:;
(2). 在催化剂作用下,丙烯发生加聚反应生成聚丙烯,化学方程式为:
,故答案为:;
(3). 反式2-丁烯中2个甲基在碳碳双键的两侧,其结构简式为,故答案为:;
(4). 2,5-二甲基己烷的结构简式为:,能与H2发生加成反应生成2,5-二甲基己烷的炔烃,因碳链骨架不变,则只有3、4号C上可存在三键,该炔烃的结构简式为:,名称为2,5-二甲基-3-己炔,故答案为:2,5-二甲基-3-己炔;
(5). 该有机物中含碳碳双键的最长碳链有5个C原子,2号C上有乙基,4号C上有甲基,根据系统命名法,该有机物的名称为4-甲基-2-乙基-1-戊烯,故答案为:4-甲基-2-乙基-1-戊烯。
18. 如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)有机物(a)有一种同分异构体,试写出其结构简式 ______ .
(2)上述有机物中与(c)互为同分异构体的是 ______ (填代号).
(3)任写一种与(e)互为同系物的最简单有机物的结构简式 ______ .
(4)上述有机物中不能使酸性高锰酸钾溶液褪色的有 ______ (填代号).
(5)(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有 ______ (填代号).
【答案】 (1). CH3CH2CH2CH3 (2). (b)、(f) (3). CH≡CH (4). (a)(f) (5). (b)、(c)、(d)
【解析】(1). 据图可知,有机物(a)为2−甲基丙烷,该有机物的同分异构体是正丁烷,结构简式为CH3CH2CH2CH3,故答案为:CH3CH2CH2CH3;
(2).
c为2−丁烯,与其分子式相同而结构不同的是有机物(f)环丁烷、有机物(b)2−甲基−1−丙烯,故答案为:(b)、(f);
(3). (e)是1-丁炔,与其互为同系物的最简单有机物是乙炔,结构简式为:CH≡CH,故答案为:CH≡CH;
(4). 上述有机物中,(b)、(c)、(d)含有碳碳双键、(e)含有碳碳三键,碳碳双键和碳碳三键能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,而(a)、(f)中只有饱和的碳碳单键,不能与酸性高锰酸钾溶液反应,故答案为:(a)、(f);
(5). (a)为2−甲基丙烷,4个碳原子均为饱和碳原子,和甲烷的正四面体结构相似,则2−甲基丙烷中4个碳原子一定不共平面;(b)为2−甲基−1−丙烯,可以看作两个甲基取代乙烯中一个C原子上的两个氢原子,乙烯为平面结构,则2−甲基−1−丙烯中的4个碳原子一定共平面;(c)为2−丁烯,可以看作两个甲基分别取代乙烯中两个C原子上的1个H,乙烯为平面结构,则2−丁烯中的4个碳原子一定共平面;(d)为1,3−丁二烯,因4个碳原子之间形成一个共轭π键,所以4个C原子一定在同一平面;故答案为:(b)、(c)、(d)。
19. 已知CO是工业上重要的原料,可作燃料、冶炼金属、合成液体酒精等。
(1)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g) ⊿H = ?
平衡常数随温度的变化如下表所示:
温度/℃
400
500
800
平衡常数K
9.94
9
1
Ⅰ.通过平衡常数随温度的变化情况,推断反应热⊿H________ 0 (填>、<、﹦ )
Ⅱ.若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为________。
(2)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D 均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①甲中通入CO的电极为______(填“正”、“负”、“阴”、“阳”)极,该电极反应方程式为__________。
②若乙中A极析出的气体在标准状况下的体积为2.24L,此时要使乙中CuSO4溶液恢复到原来的浓度,需要加入的物质及其物质的量是(___________)。
A.0.1molCuO B.0.1molCu(OH)2 C.0.1molCu2(OH)2CO3
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示。完成丙装置C、D电极反应式:C:____________________________;D:________________________________;丙装置溶液中 c(Cl-)= _______________ mol/L 。
【答案】 (1). < (2). 75﹪ (3). 负 (4). CO – 2e- +4OH- =CO32- + 2H2O (5). B (6). Cu – 2e- = Cu2+ (7). 2Fe3+ +2e- =2Fe2+ (8). 14
【解析】(1).I. 由表中数据可知,升高温度,平衡常数K减小,说明升高温度平衡逆向移动,该反应的正反应为放热反应,△H<0,故答案为:<;
Ⅱ. 若反应在500℃时进行,起始CO和H2O的浓度均为0.02mol/L,根据平衡三段式法有:
CO(g)+H2O(g) H2(g)+CO2(g)
起始浓度(mol/L): 0.02 0.02 0 0
转化浓度(mol/L): x x x x
平衡浓度(mol/L): 0.02-x 0.02-x x x
则K==9,解得x=0.015mol/L,则CO的平衡转化率为:×100%=75%,故答案为:75%;
(2). ①. 根据题意可知,CO、O2和KOH溶液构成燃料电池,通入燃料的电极为负极,则甲中通入CO的电极为负极,在负极上CO失电子生成碳酸根离子,负极的电极反应式为:CO – 2e- +4OH- =CO32- + 2H2O,故答案为:CO – 2e- +4OH- =CO32- + 2H2O;
②. 由图可知,A电极连接燃料电池的正极,A为阳极,A极上发生的电极反应式为:4OH-– 4e- =O2↑ + 2H2O,析出的O2在标准状况下的体积为2.24L,则O2的物质的量为0.1mol,转移电子0.4mol,B为阴极,断开K后,A、B两极上产生的气体体积相同,则B极上发生的电极反应式依次为:Cu2++2e-= Cu、2H++2e-=H2↑,H2的物质的量为0.1mol,对应转移电子0.2mol,则生成Cu时转移的电子为0.4mol-0.2mol=0.2mol,根据Cu2++2e-= Cu可知,此时生成0.1molCu,要使乙中CuSO4溶液恢复到原来的浓度,此时需要加入的物质中应含有0.1molCu、0.2molH和0.2molO,故答案为:B;
③. 据图1可知,C是阳极,电极材料为Cu,Cu是活性电极,则C的电极反应式为:Cu – 2e-= Cu2+,D是阴极,电极材料为石墨,D的电极反应式为:2Fe3+ +2e- =2Fe2+,结合图2可知,曲线1代表Fe3+、曲线2代表Fe2+、曲线3代表Cu2+,电解前溶液中Fe3+的物质的量为0.4mol,Fe2+的物质的量为0.1mol,则n(Cl-)=0.4mol×3+0.1mol×2=1.4mol,c(Cl-)=1.4mol÷0.1L=14mol/L,故答案为:Cu – 2e-= Cu2+;2Fe3+ +2e- =2Fe2+;14。
点睛:本题综合考查平衡常数的应用、平衡转化率的计算、原电池和电解池原理等,试题难度中等。本题的难点是第(2)题的第③问,计算溶液中的氯离子浓度时,要先根据电极反应式并结合图2判断溶液中离子物质的量的变化,得出曲线1代表Fe3+、曲线2代表Fe2+,再根据氯化铁和氯化亚铁的化学式计算氯离子的浓度即可。
20. 用电石(CaC2)制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量, 从而计算电石(CaC2)的纯度。
(1)完成甲装置发生的化学反应方程式______________。
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用____________________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________________;
⑸若没有除H2S的装置,测定结果将会________(填“偏高”、“偏低”或“不变”),理由是_________________________________ (用化学方程式表示)。
【答案】 (1). (2). AHGEFDCB (3). 饱和食盐水 (4). % (5). 偏高 (6). H2S+Br2===S↓+2HBr
【解析】(1). 甲是制取乙炔的实验装置,电石与水反应生成乙炔和氢氧化钙,化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2). 电石与足量水反应生成乙炔,其中混有的H2S气体可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所以正确的连接顺序为:AHGEFDCB,故答案为:AHGEFDCB;
(3). 实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流,故答案为:饱和食盐水;
(4). 在标准状况下溴水与乙炔完全反应生成C2H2Br4,化学方程式为:C2H2+2Br2= C2H2Br4,溴单质的物质的量为n(Br2)=0.1mol/L×0.02L=0.002mol,消耗乙炔的物质的量为:0.002mol÷2=0.001mol,测得量筒内液体体积为VmL,则与溴水反应后剩余乙炔的体积为VmL,物质的量为V×10-3L÷22.4L/mol=mol,由CaC2+2H2O→Ca(OH)2+C2H2↑可知,CaC2
的物质的量为(0.001+)mol,质量为(0.001+)×64g,则电石纯度可表示为×100%=%,故答案为:%;
(5). 硫化氢具有还原性,能与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,硫化氢和溴反应生成溴化氢和单质硫,化学方程式为:H2S+Br2=S↓+2HBr,故答案为:偏高;H2S+Br2=S↓+2HBr。
21. (1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为________________ 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
试推测有机物A的结构简式为____________________________ 。
(3)与A属于同类有机物的同分异构体共_____ 种,其结构简式分别为(不一定填满空格)
①________________ ② ③
④ ⑤ ⑥ ……
【答案】 (1). C8H8O2 (2). (3). 5 (4). 其它同分异构体(、、 、、)
(2). 由核磁共振氢谱可知,有机物A中含有四种不同化学环境的氢原子,由红外光谱可知,有机物A中含有苯环且苯环上只有1个取代基,该取代基由甲基、酯基构成,再结合A的分子式C8H8O2,A的结构简式应为:,故答案为:;
(3). 与A属于同类有机物的同分异构体有:、、 、、共5种,故答案为:5;其它同分异构体(、、 、、)。