- 2021-07-07 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【推荐】专题1-3-2 反应热的计算(教学案)-2017-2018学年高二化学同步精品课堂(新人教版选修4)
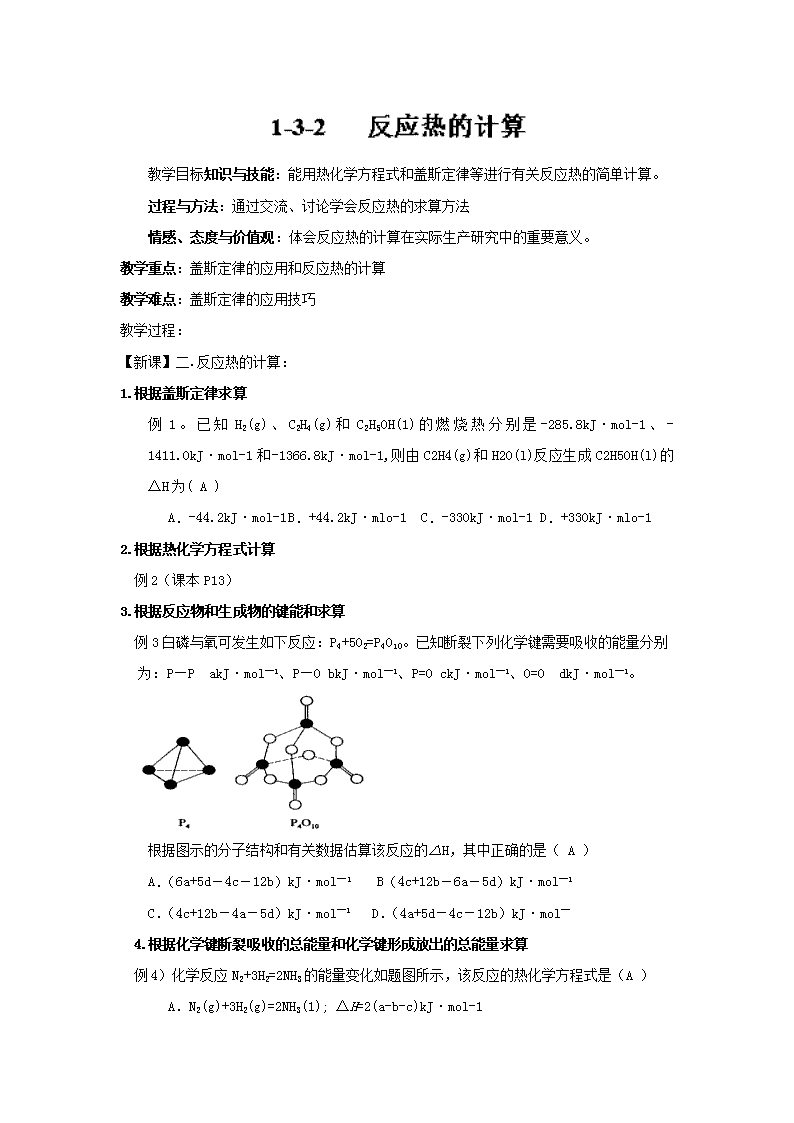
教学目标知识与技能:能用热化学方程式和盖斯定律等进行有关反应热的简单计算。 过程与方法:通过交流、讨论学会反应热的求算方法 情感、态度与价值观:体会反应热的计算在实际生产研究中的重要意义。 教学重点:盖斯定律的应用和反应热的计算 教学难点:盖斯定律的应用技巧 教学过程: 【新课】二.反应热的计算: 1.根据盖斯定律求算 例1。已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( A ) A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1 C.-330kJ·mol-1 D.+330kJ·mlo-1 2.根据热化学方程式计算 例2(课本P13) 3.根据反应物和生成物的键能和求算 例3白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( A ) A.(6a+5d-4c-12b)kJ·mol—1 B(4c+12b-6a-5d)kJ·mol—1 C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol— 4.根据化学键断裂吸收的总能量和化学键形成放出的总能量求算 例4)化学反应N2+3H2=2NH3的能量变化如题图所示,该反应的热化学方程式是(A ) A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 B.N2(g)+3H2(g)=2NH3 (g); △H=2(b-a)kJ·mol-1 C.N2(g)+H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 D.N2(g)+H2(g)=NH3(g); △H=(a+b)kJ·mol-1 【总结】 ①根据热化学方程式计算,反应热与反应物各物质的量成正比; ②根据反应物和生成物的键能和求算: △H=∑E反应物键能和— ∑E生成物键能和 ③根据化学键断裂吸收的总能量和化学键形成放出的总能量求算:△H=∑E吸— ∑E放 ④根据盖斯定律求算:例如:有右图可得△H1、△H2、△H3 的数量关系为 ΔH1 + ΔH2 =ΔH3 ⑤根据比热公式进行求算:△H = -C(t2-t1)(m1+m2)/n(H2O)(kJ/mol) 【要点】 ① 热化学方程式同乘以某一个数时,反应热数值也应该乘上该数; ② 热化学方程式相加减时,同种物质之间可以相加减,反应热也随之相加减; ③ 将一个热化学方程式颠倒时,△H的“+”“-”号必须随之改变。 【课堂练习】 1.已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1 CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( B) A.1∶1 B.1∶3 C.1∶4 D.2∶3 2.在298K、100kPa时,已知:2 ⊿ ⊿ ⊿ 则⊿与⊿和⊿间的关系正确的是(A) A .⊿=⊿+2⊿ B ⊿=⊿+⊿ C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿ 查看更多