- 2021-07-07 发布 |
- 37.5 KB |
- 23页

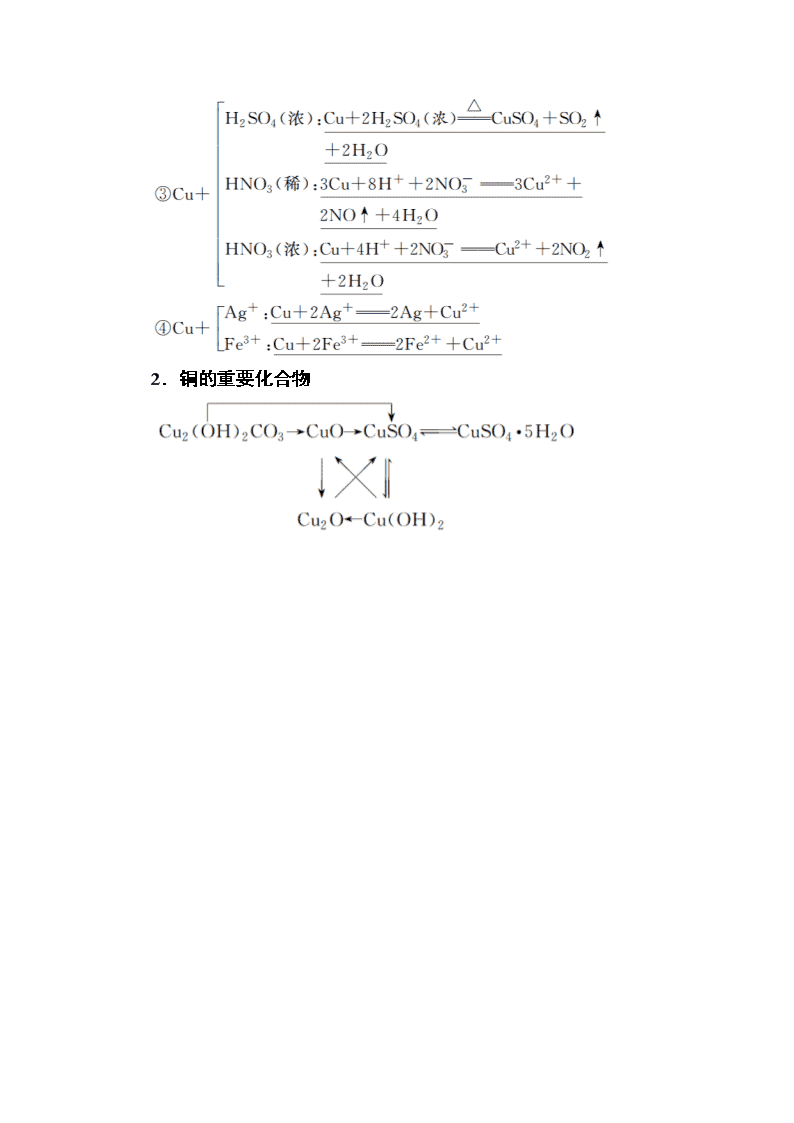

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高三化学人教版一轮学案:第三章 第四节 金属材料及金属矿物的开发利用 Word版含解析
www.ks5u.com 第四节 金属材料及金属矿物的开发利用 最新考纲:1.了解常见金属活动性顺序。2.了解合金的概念及其重要应用。3.了解铜及其重要化合物的制备方法。4.掌握铜及其重要化合物的主要性质及其应用。 核心素养:1.证据推理与模型认知:具有证据意识,能基于证据对金属材料性质提出可能的假设,通过分析推理加以证实或证伪;能运用模型解释化学现象,揭示现象的本质和规律。2.科学探究与创新意识:能对金属的性质提出有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究。 知识点一 铜及其化合物 1.铜的性质 (1)物理性质:铜是紫红色金属,具有良好的导电性、导热性和延展性。 (2)化学性质 写出图中有关反应的化学方程式或离子方程式: ①2Cu+O2+CO2+H2O===Cu2(OH)2CO3 ②2Cu+SCu2S 2.铜的重要化合物 (1)氧化铜和氧化亚铜 名称 氧化铜 氧化亚铜 颜色 黑色 砖红色 与酸反应(H+) CuO+2H+===Cu2++H2O Cu2O+2H+===Cu2++Cu+H2O 与H2反应 CuO+H2Cu+H2O Cu2O+H22Cu+H2O 转化关系 4CuO2Cu2O+O2↑ (2)氢氧化铜 a.物理性质:蓝色不溶于水的固体。 b.化学性质及应用 反应①的化学方程式:Cu(OH)2CuO+H2O 反应②的化学方程式:Cu(OH)2+2H+===Cu2++2H2O (3)铜盐 ①Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,是铜在潮湿空气中被腐蚀的结果,其受热分解的化学方程式为Cu2(OH)2CO32CuO+H2O+CO2↑。 ②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式为CuSO4·5H2OCuSO4+5H2O,蓝色晶体受热转化为白色粉末。无水CuSO4遇水变蓝色(生成CuSO4· 5H2O),据此可用来检验水的存在。 判断正误(正确的打“√”,错误的打“×”) 1.CuO是黑色固体,与水反应生成Cu(OH)2( × ) 提示:CuO不能与水反应生成Cu(OH)2。 2.电解CuCl2溶液的方程式:CuCl2Cu2++2Cl-( × ) 提示:电解CuCl2溶液发生反应:CuCl2Cu+Cl2↑。 3.H2还原CuO时,应先加热,后通H2( × ) 提示:氢气还原氧化铜时,应“先通氢,后点灯”,以免加热时发生爆炸危险。 4.CuSO4·5H2O失去结晶水属于物理变化( × ) 提示:硫酸铜晶体失去结晶水属于化学变化。 5.Cu2O遇硝酸会被氧化成Cu2+( √ ) 6.利用无水硫酸铜遇水变成蓝色这一性质,来检验水的存在( √ ) 提示:无水硫酸铜能与水作用生成蓝色的CuSO4·5H2O,能作水的检测剂。 7.铜锈是铜被空气中的氧气缓慢氧化生成的氧化物( × ) 提示:Cu2(OH)2CO3是铜锈的主要成分。 8.农业上配制波尔多液时可在铁桶或铝桶中进行( × ) 提示:波尔多液的成分含有硫酸铜,能与单质铁或铝发生置换反应而降低药效,故不能在铁桶或铝桶中配制。 1.铜离子为重金属离子,能使蛋白质变性,从而达到杀死细菌的目的,常用CuSO4作游泳池的消毒剂。 2.铜及其化合物的颜色 物质 颜色 物质 颜色 Cu 紫红色 CuSO4 白色 CuO 黑色 CuSO4·5H2O 蓝色 Cu2O 红色 Cu2(OH)2CO3 绿色 Cu2S 黑色 Cu(OH)2 蓝色 在无机物的综合推断题中,常利用颜色来区别或检验铜及其化合物。 3.通常利用反应:2Cu+O22CuO除去混合气体中的少量O2。 4.铜为变价金属,与Cl2反应生成CuCl2,与S反应生成Cu2S,由此可知氧化性:Cl2>S。 5.Cu与稀H2SO4不反应,但在通入O2的条件下,可逐渐溶解:2Cu+O2+2H2SO4===2CuSO4+2H2O。 1.(2020·河北石家庄二中模拟)铜在自然界多以化合态的形式存在于矿石中。常见的铜矿石有:黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石[CuCO3·Cu(OH)2]。下列说法不正确的是( C ) A.可用稀盐酸除去铜器表面的铜绿 B.硫酸铜溶液可用作游泳池的消毒剂 C.工业上常采用电解法制取粗铜 D.在上述几种含铜化合物中,铜的质量分数最高的是Cu2S 解析:CuSO4是重金属盐,能使蛋白质变性,B项正确;工业上常用电解法精炼铜,C项不正确。 2.下列有关CuSO4溶液的叙述正确的是( A ) A.该溶液中Na+、NH、NO、Mg2+可以大量共存 B.通入CO2气体产生蓝色沉淀 C.与H2S反应的离子方程式:Cu2++S2-===CuS↓ D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O===Cu(OH)2↓+2NH 解析:A项,CuSO4溶液显酸性,Na+、NH、NO、Mg2+可以大量共存,A项正确;B项,CO2与CuSO4溶液不发生反应,违背了强酸制弱酸的原理,B项错误;C项,H2S属于弱电解质,书写离子反应方程式时,要写化学式,C项错误;D项,CuSO4溶液与过量浓氨水反应生成四氨基合铜离子[Cu(NH3)4]2+,D项错误。 3.已知CuO经高温灼烧生成Cu2O,Cu2O与H+发生反应:Cu2O+2H+===Cu+Cu2++H2O。将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是( C ) A.如果溶液变为蓝色、同时有紫红色固体出现,说明样品全部生成了Cu2O B.溶液中最终可能有紫红色固体出现 C.这种实验的结果无法说明CuO分解的程度 D.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解 解析:由于Cu2O和Cu都能够与热的稀硝酸反应,所以不论CuO是否完全分解,溶液中最终不可能有紫红色固体出现,所以C正确。 4.新制氢氧化铜存在平衡:Cu(OH)2+2OH-Cu(OH)(深蓝色)。某同学进行下列实验: 下列说法不正确的是( D ) A.①中出现蓝色沉淀 B.③中现象是Cu(OH)2+2OH-Cu(OH)正向移动的结果 C.④中现象证明葡萄糖具有还原性 D.对比②和④可知Cu(OH)2氧化性强于Cu(OH) 解析:CuSO4溶液与NaOH溶液反应可生成蓝色沉淀Cu(OH)2,A正确。新制Cu(OH)2存在平衡:Cu(OH)2+2OH-Cu(OH),加入NaOH,氢氧根离子的浓度增大,平衡正向移动,B正确。③中加入葡萄糖溶液有砖红色的沉淀生成,说明葡萄糖中含有醛基,所以葡萄糖具有还原性,C正确。④中氧化葡萄糖的是Cu(OH),而②中未生成砖红色沉淀,可知氧化性:Cu(OH)2查看更多
相关文章
- 当前文档收益归属上传用户