- 2021-07-07 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高一化学下学期期末考试试题 人教 目标版
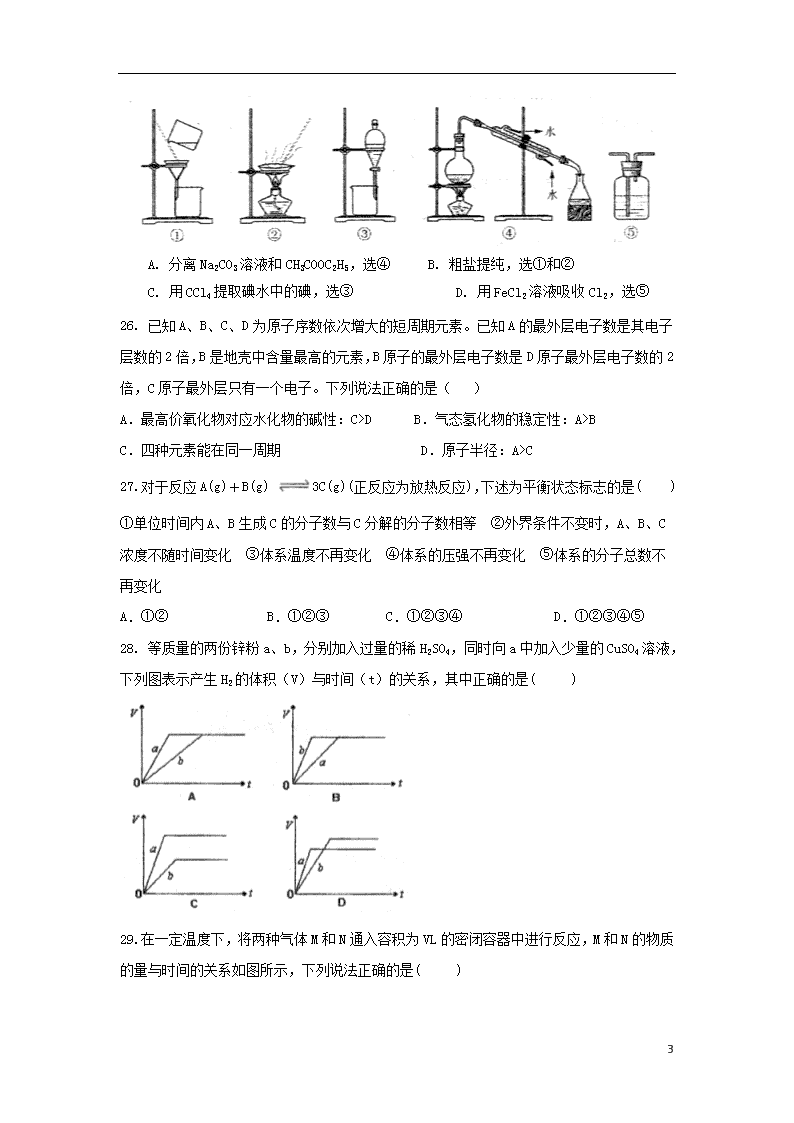
2019学年高一化学下学期期末考试试题 (满分100分 考试时间60分钟) 可能用到的相对原子质量:Cl—35 N—14 H--1 一、选择题(每小题只有一个正确选项符合题意,每小题4分,共56分) 16.下列有关物质的性质与用途不对应的是( ) A. 铝合金的密度小,硬度大,可用作建筑材料 B. 食品工业中用Na2CO3作焙制糕点的膨松剂 C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 D. 二氧化硅是制造光导纤维的材料 17. 下列有关化学用语使用正确的是( ) A. NH4Br的电子式: B. S的原子结构示意图: C. 乙酸的分子式:CH3COOH D. 原子核内有18个中子的氯原子: 18.能正确表示下列反应的离子方程式的是( ) A.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO===3Fe3++2H2O+NO↑ B. 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO C. 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO===CaCO3↓+H2O D.向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO 19. 设NA代表阿伏加德罗常数的数值,下列说法正确的是( ) A. 常温常压下,1 mol氦气含有的核外电子数为4NA B. 17g NH3所含的氢原子数为3NA C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA D. 2L 1mol/LNa2SO4溶液中含有的Na+的数目是2NA 20. 对于溶液中某些离子的检验及结论一定正确的是( ) A. 加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- C. 加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- D. 加入稀盐酸产生无色气体,气体通入澄清石灰水,溶液变浑浊,一定有CO32- 21.下列说法正确的是( ) 7 A.任何化学反应都伴随着能量的变化 B.H2O(g)===H2O(l)该过程放出大量的热,所以该过程是化学变化 C.化学反应中能量的变化都表现为热量的变化 D.对于如图所示的过程,是吸收能量的过程 22、下列说法正确的是( ) ① H2O2 分子中既含极性键又含非极性键 ② F2、Cl2、Br2、I2 熔点随相对分子质量增大而升高 ③Na2O2 固体中的阴离子和阳离子个数比是 1∶2 ④由于非金属性 Cl > Br > I,所以酸性 HCl > HBr > HI A.②③④ B.①③④ C.①②③ D..①②③④ 23. 下列叙述不正确的是( ) A. 可以用NaOH溶液鉴别MgCl2和AlCl3 B. 可以用溴水鉴别甲烷和乙烯 C. 可以用分液漏斗分离乙酸和乙醇 D. 可以用NaOH溶液除去苯中少量的Br2 24.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是 ( ) A.电子通过外电路从b极流向a极 B.b极上的电极反应式为:O2+2H2O+4e-==4OH- C.每转移0.1 mol电子,消耗1.12 L的H2 D.H+由a极通过固体酸电解质传递到b极 25. 下列实验中,所选装置不合理的是( ) 7 A. 分离Na2CO3溶液和CH3COOC2H5,选④ B. 粗盐提纯,选①和② C. 用CCl4提取碘水中的碘,选③ D. 用FeCl2溶液吸收Cl2,选⑤ 26. 已知A、B、C、D为原子序数依次增大的短周期元素。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是( ) A.最高价氧化物对应水化物的碱性:C>D B.气态氢化物的稳定性:A>B C.四种元素能在同一周期 D.原子半径:A>C 27.对于反应A(g)+B(g) 3C(g)(正反应为放热反应),下述为平衡状态标志的是( ) ①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化 A.①② B.①②③ C.①②③④ D.①②③④⑤ 28. 等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( ) 29. 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( ) 7 A. 0~t2内用M表示的平均反应速率是2/t2(mol··) B. t1~t2内容器内的压强逐渐减小 C. 该反应的方程式为N2M D. t2与t3时刻的混合气体的平均相对分子质量相等 二、非选择题(本大题包括3小题,每空3分,共48分) 1、(10)反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示: (1)该反应为______反应(填“吸热”或“放热”). (2)若要使该反应的反应速率加快,下列措施可行的是______ (填字母). A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸 (3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”). 铜片上产生的现象为______该极上发生的电极反应为______。 2.(17分)氯气是一种重要的工业原料某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为: 他们利用该反应设计如图所示制取氯气并验证其性质的实验. 回答下列问题: 7 该实验中A部分的装置是 ______ 填标号. 装置B中产生的现象为 ______ . 请设计实验验证装置C中的已被氧化 ______ . 写出D装置中发生反应的离子方程式 ______ . 该实验存在明显的缺陷,请你提出改进的方法 ______ . 若将上述装置改为制取并分别验证的漂白性、氧化性和还原性等性质. B中 ______ 溶液退色,则说明产生的气体为; C中溶液出现 ______ ;D中 ______ 溶液退色,说明有还原性. 3.(17分)(1)在某一容积为2 L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示: 回答下列问题: ①该反应的化学方程式为__________________________________。 ②前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因是________(填字母)。 A.增大压强 B.降低温度 C.加入催化剂 D.增加A的物质的量 (2)在100 ℃时,将0.01 mol的四氧化二氮气体充入0.1 L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格: 时间/s 浓度/mol·L-1 0 20 40 60 80 100 7 c(N2O4)/mol·L-1 0.100 0.070 0.050 c3 a b c(NO2)/mol·L-1 0.000 0.060 c2 0.120 0.120 0.120 试填空: ①该反应的化学方程式:________________________________, 达到平衡时四氧化二氮的转化率为_______, ②在0~20 s内,四氧化二氮的平均反应速率为______,哪一时间段(指0~20、20~40、40~60、60~80、80~100 s)反应速率最大并解释 。 7 化学答案 BDABC ACCDA ADDB 15.(共10分) (1)放热; (2)AC; (3)正 有气泡产生 2H++2e-=H2↑。 16.(共17分)(1) b(1分); (2)淀粉KI溶液变蓝(2分) (3)取样,加HCl酸化的 BaCl2溶液,若有白色沉淀生成,则原试样中NaSO3已被氧化(3分); (4)(3分); (5)实验缺少尾气处理装置,应在D后增加一个盛有NaOH溶液的烧杯(2分); (6)品红(2分);淡黄色沉淀(2分);酸性KMnO4溶液或溴水(2分) 17 (共17分) (1)①4A+5B6C+4D(2分) ②0.1 mol·L-1·min-1(2分) AC(2分) (2)①N2O2NO2 (3分) 60%(3分) ②0.001 5 mol·L-1·s-1(2分) 0~20 s 开始时反应物的浓度最大(3分) 7查看更多