- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省汉中市部分高中2020-2021学年高二上学期质量检测(二)(12月月考) 化学 Word版含答案
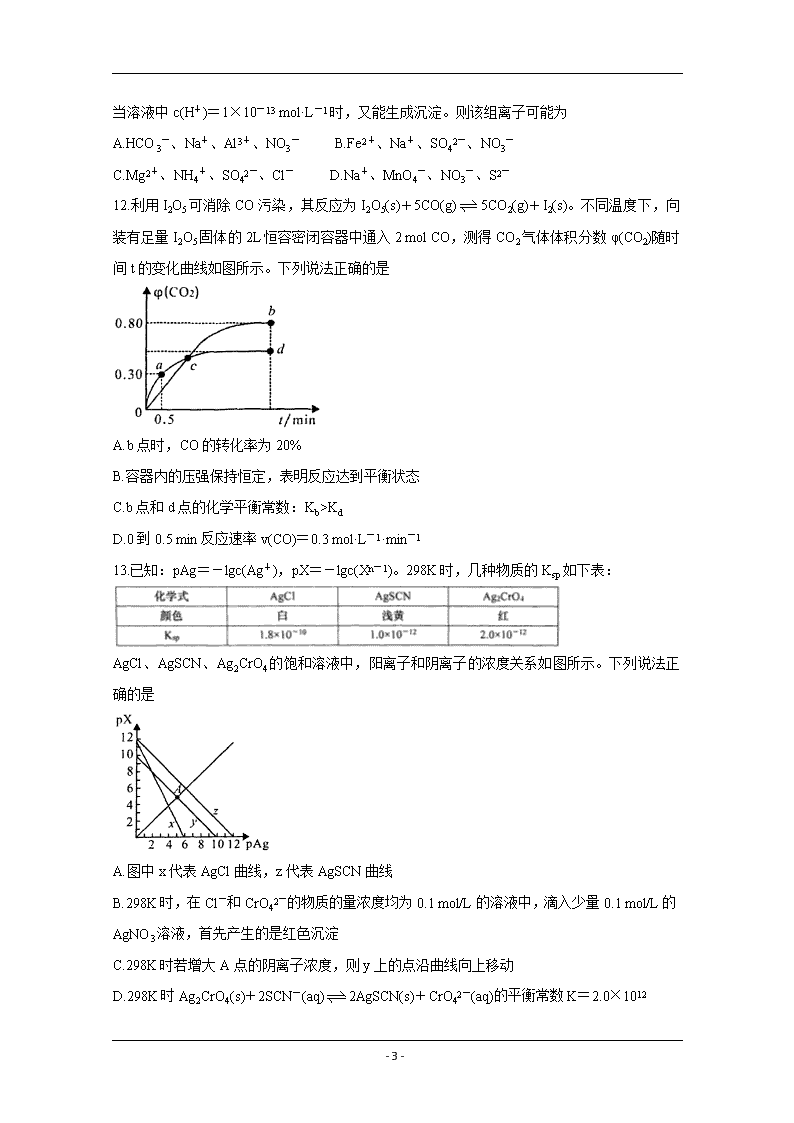
- 1 - 2020-2021 学年度第一学年度质量检测 高二化学试题(二) 考生注意:本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分,满分 100 分,考试时间 90 分 钟。请将答案填写在答题纸相应的位置,交卷时,只交答题纸。 第 I 卷(选择题 共 48 分) 一、选择题(本大题共 16 小题,每小题只有一个正确选项,每小题 3 分,共 48 分) 1.在太空中发现迄今已知最大钻石的直径是 4000 公里,重达 100 亿万亿万亿克拉。下列关于 金刚石的叙述中正确的是 A.含 1 mol C 的金刚石中的共价键为 4 mol B.金刚石和石墨是同分异构体 C.C(s,石墨) C(s,金刚石) △H=+1.9 kJ/mol,说明金刚石比石墨稳定 D.石墨转化为金刚石是化学变化 2.下列说法中正确的是 A.放热反应都比吸热反应易发生 B.中和反应中,每生成 1 mol H2O 均会放出 57.3 kJ 的热量 C.NH4Cl 固体与 Ba(OH)2·8H2O 混合搅拌过程中,体系能量增加 D.无法判断 2CO2(g)+3H2O(g)=C2H5OH(l)+3O2(g)是吸热反应还是放热反应 3.下列叙述中正确的是 A.1 mol H2 燃烧放出的热量为 H2 的燃烧热 B.Na2SO3 和 H2O2 的反应为氧化还原反应 C. 和 “互为同系物 D.Fe(OH)3 胶体和 FeSO4 溶液均能产生丁达尔效应 4.一定条件下,可逆反应 C(s)+CO2(g) 2CO(g) △H>0,达到平衡状态,进行如下操作: ①升高反应体系的温度 ②增加反应物 C 的用量 ③缩小反应体系的体积 ④减少体系中 CO 的量 上述措施中一定能使反应的正反应速率显著加快的是 A.①②③④ B.①③ C.①② D.①③④ 5.下列有关实验操作或测量数据的说法正确的是 A.用托盘天平称量食盐的质量为 12.35 g - 2 - B.用碱式滴定管量取高锰酸钾溶液 20.00 mL C.用 pH 试纸测量次氯酸钠溶液的 pH 为 11.5 D.滴定管、容量瓶和分液漏斗在使用前都要先查漏 6.一定温度下恒容容器中,可逆反应 2HI(g) I2(g)+H2(g)达到平衡状态的标志是 ①单位时间内生成 n mol H2 的同时生成 2n mol HI ②单位时间内生成 n mol H2 的同时生成 n mol I2 ③用 HI、I2、H2 的物质的量浓度变化表示的反应速率的比为 2:1:1 的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的压强不再改变的状态 A.①④ B.①④⑤ C.①②④⑤ D.①②③④⑤ 7.反应 3Fe(s)+4H2O(g) Fe3O4+(s)+4H2(g)在一密闭容器中进行,下列条件的改变能使反应 速度变快的是 ①体积不变,增加 Fe 的量;②体积不变,增加 H2O 的量;③体积不变,充入 N2 使压强增大; ④压强不变,充入 N2 使体积增大 A.①②③ B.②④ C.②③ D.② 8.下列叙述不能证明乙酸是弱电解质的是 A.常温时 0.1 mol/L 乙酸溶液的 pH=3 B.常温时 0.1 mol/L 的乙酸钠溶液能使红色石蕊试纸变蓝 C.0.1 mol/L 的乙酸溶液与同体积 0.1 mol/L 的氢氧化钠溶液恰好反应 D.0.1 mol/L 乙酸溶液的导电性比 0.1 mol/L 盐酸弱 9.25℃时,向 10 mL pH=12 的某碱溶液中加入 10 mL pH=2 的盐酸,充分反应后滴入酚酞试 液,溶液变红,则此碱一定是 A.弱碱 B.一元强碱 C.多元强碱 D.任何碱 10.下列方程式书写正确的是 A.HCO3 -在水溶液中的电离方程式:HCO3 -+H2O 2H3O++CO32- B.H2SO3 的电离方程式:H2SO3 2H++SO32- C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- D.NaHCO3 的电离方程式:NaHCO3=Na++H++CO32- 11.25℃时,在溶液中能够大量共存,当溶液中 c(H+)=1×10-1 mol·L-1 时,有气体产生,而当 - 3 - 溶液中 c(H+)=1×10-13 mol·L-1 时,又能生成沉淀。则该组离子可能为 A.HCO3 -、Na+、Al3+、NO3 - B.Fe2+、Na+、SO42-、NO3 - C.Mg2+、NH4 +、SO42-、Cl- D.Na+、MnO4 -、NO3 -、S2- 12.利用 I2O5 可消除 CO 污染,其反应为 I2O5(s)+5CO(g) 5CO2(g)+I2(s)。不同温度下,向 装有足量 I2O5 固体的 2L 恒容密闭容器中通入 2 mol CO,测得 CO2 气体体积分数φ(CO2)随时 间 t 的变化曲线如图所示。下列说法正确的是 A.b 点时,CO 的转化率为 20% B.容器内的压强保持恒定,表明反应达到平衡状态 C.b 点和 d 点的化学平衡常数:Kb>Kd D.0 到 0.5 min 反应速率 v(CO)=0.3 mol·L-1·min-1 13.已知:pAg=-lgc(Ag+),pX=-lgc(Xn-1)。298K 时,几种物质的 Ksp 如下表: AgCl、AgSCN、Ag2CrO4 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正 确的是 A.图中 x 代表 AgCl 曲线,z 代表 AgSCN 曲线 B.298K 时,在 Cl-和 CrO42-的物质的量浓度均为 0.1 mol/L 的溶液中,滴入少量 0.1 mol/L 的 AgNO3 溶液,首先产生的是红色沉淀 C.298K 时若增大 A 点的阴离子浓度,则 y 上的点沿曲线向上移动 D.298K 时 Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO42-(aq)的平衡常数 K=2.0×1012 - 4 - 14.25℃时,等体积混合 0.10 mol/L 盐酸和 0.06 mol/L Ba(OH)2 溶液后,溶液的 pH 值等于 A.2.0 B.12.3 C.1.7 D.12.0 15.已知:①CH3COOH 和 CH3COONa 等物质的量混合配成的稀溶液,pH 为 4.7;②用等物质 的量的 HCN 和 NaCN 配成的稀溶液中,c(CN-)查看更多