- 2021-07-06 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省太康县第一高级中学高二上学期第二次月考化学试题 解析版
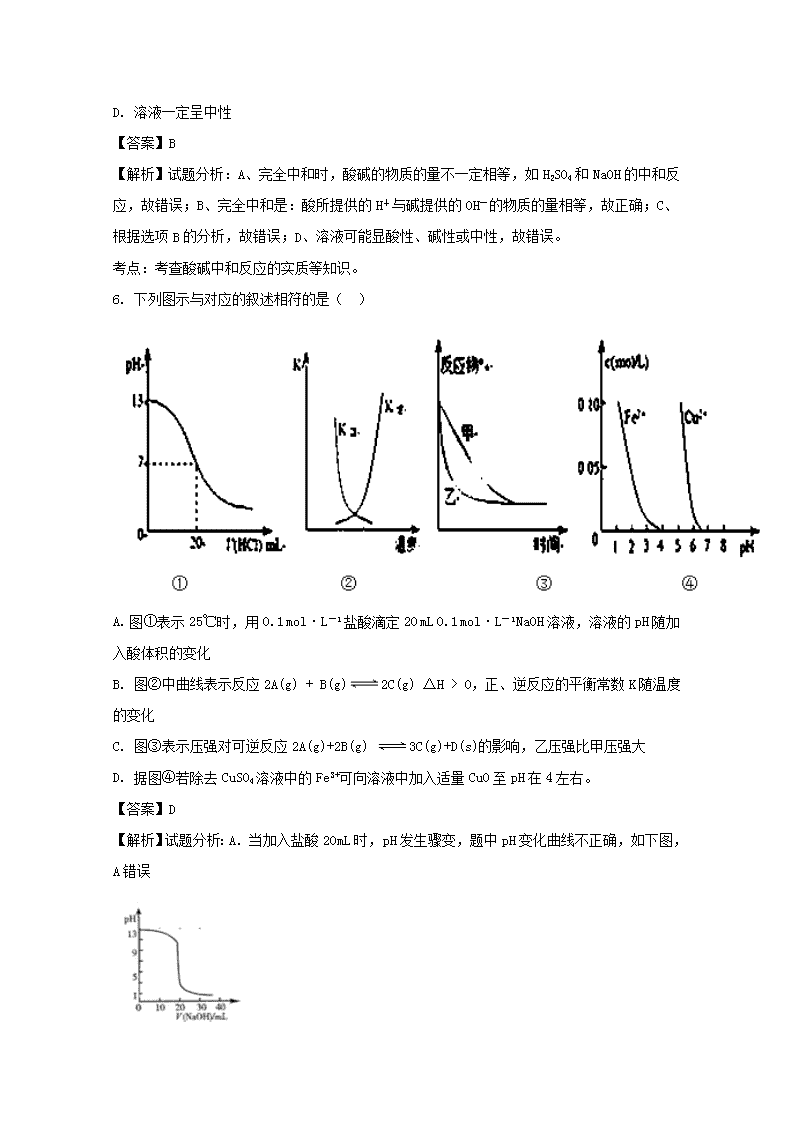
河南省太康县第一高级中学2017-2018学年高二上学期第二次月考 化学试题 1. 标准状况下,将2.24LNH3通入1L 0.1mol/L的乙酸溶液中,欲确定所得溶液中NH4+、CH3COO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是 ①NH3·H2O和CH3COOH的电离常数 ②NH3·H2O和CH3COONH4的电离常数 ③溶液的pH A. 不需任何数据 B. 必需知道①、②、③三组数据 C. 只需知道①、③中的任一组数据 D. 只需知道①、②、③中的任一组数据 【答案】C 【解析】A.酸和碱恰好反应生成盐醋酸铵,根据一水合氨和醋酸的电离常数确定其离子的水解程度,和溶液酸碱性,水解程度越大的离子,其浓度越小,A错误;B.醋酸铵是强电解质,在水中完全电离,不存在电离常数,B错误;C.根据溶液的pH和电离常数可判断离子的水解程度,从而确定离子浓度大小,C正确;D.根据以上分析可知D错误;答案选C。 2. 汽水是CO2的饱和溶液,其中存在如下平衡:H2CO3H++HCO3-……① HCO3-H++CO32-……②将汽水倒入试管中分别进行下列实验,相应分析结论错误的是 A. 加热、平衡①、②可能都向左移动 B. 加入澄清石灰水,平衡①、②均向右移动 C. 加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 D. 通入过量CO2或滴加氯水,溶液pH均减小 【答案】D 【解析】试题分析:A、加热碳酸分解生成CO2和水,促使平衡向左移动,A正确;B、加入澄清的石灰水,溶液的碱性增强,降低氢离子的浓度,平衡①、②均向右移动,B正确;C、加入碳酸钙悬浊液,碳酸与碳酸钙结合生成可溶性的碳酸氢钙,促进碳酸钙的溶解,C正确;D、温度不变,再通入CO2,溶液的浓度不变,pH不变,D不正确,答案选D。 考点:考查考查外界条件对电离平衡、溶解平衡的影响 3. 氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是 A. 1 mol/L氢氰酸溶液的pH约为3 B. 常温下,pH=a的HCN稀释100倍后所得溶液pH<(a +2)[(a +2)<7] C. 10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应 D. NaCN溶液呈碱性 【答案】C 【解析】试题分析:A、1 mol/L氢氰酸溶液的pH约为3,若为强酸,则pH为0,可以说明HCN是弱酸,错误;B、若为强酸,则pH=a的HCN溶液稀释100倍后pH=a+2,现在溶液pH<(a +2),可以说明HCN是弱酸,错误;C、HCN与NaOH等物质的量混合恰好完全反应,属于酸碱中和,不能说明HCN是弱酸,正确;D、若HCN是强酸,则NaCN溶液呈中性,而实际显碱性,可以说明HCN是弱酸,错误,答案选C。 考点:考查弱酸的判断依据 4. 下列有关问题,与盐的水解有关的是 ① NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ② 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③ 草木灰与铵态氮肥不能混合施用 ④ 实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤ 加热蒸干AlCl3溶液得到Al(OH)3固体 A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤ 【答案】D 【解析】①中NH4Cl与ZnCl2溶液水解均显酸性,可以除去金属表面的锈。②HCO与Al3+两种离子水解相互促进,产生二氧化碳,可做灭火剂。③草木灰的主要成分为碳酸钾,水解显碱性,而铵态氮肥水解显酸性,两物质水解相互促进放出氨气因而不能混合施用。④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏合在一起而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡胶塞。⑤AlCl3溶液中存在水解平衡:AlCl3+3H2OAl(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体。 5. 酸碱完全中和时 A. 酸和碱的物质的量一定相等 B. 酸所提供的H+与碱提供的OH-的物质的量相等 C. 酸和碱的物质的量浓度相等 D. 溶液一定呈中性 【答案】B 【解析】试题分析:A、完全中和时,酸碱的物质的量不一定相等,如H2SO4和NaOH的中和反应,故错误;B、完全中和是:酸所提供的H+与碱提供的OH-的物质的量相等,故正确;C、根据选项B的分析,故错误;D、溶液可能显酸性、碱性或中性,故错误。 考点:考查酸碱中和反应的实质等知识。 6. 下列图示与对应的叙述相符的是( ) A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 B. 图②中曲线表示反应2A(g) + B(g)2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 C. 图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙压强比甲压强大 D. 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。 【答案】D 【解析】试题分析:A.当加入盐酸20mL时,pH发生骤变,题中pH变化曲线不正确,如下图,A错误 B.反应2A(g)+B(g)2C(g)△H>0,温度升高反应正向进行,正反应速率大于逆反应速率,故B错误;C.2A(g)+2B(g)3C(g)+D(s)反应是气体体积变化的反应,压强改变,平衡发生移动,故C错误;D.若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在3-4左右,铁离子沉淀完全,D正确;故选D. 考点:化学平衡常数的含义;体积百分含量随温度、压强变化曲线;难溶电解质的溶解平衡及沉淀转化的本质 7. 下列有关实验的原理、方法和结论都正确的是 A. 将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 B. 用CH3COOH溶液作导电性实验,灯光较暗,说明CH3COOH是弱电解质 C. 向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 【答案】C 【解析】试题分析:A项,NH3·H2O是弱电解质,存在电离平衡,因此将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化小;B项,实验原理、方法错误,溶液导电性强弱取决于溶液中离子浓度和离子所带电荷数,而与电解质强弱无关;C项,向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,因生成BaCO3沉淀而使溶液中c(CO32-)变小,由红色逐渐褪去可证明水解平衡逆向移动,溶液碱性减弱;D项,胶体不带电。 考点:考查电解质溶液 8. 下述实验能达到顶期目的的是 编号 实验内容 实验目的 A 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 B 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) 滴定其中NaOH含量 C 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 证明稀释前c(X)=10c(Y) D 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 证明非金属性Cl>F A. A B. B C. C D. D 【答案】B 【解析】试题分析:A、氢氧化钠与氯化镁反应后氢氧化钠是过量的,因此再滴加氯化铁溶液一定生成红褐色氢氧化铁沉淀,不能得出氢氧化镁和氢氧化铁的溶解度相对大小,A不正确;B、酚酞的变色范围是8.2~10.0,因此向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂)滴定是碳酸钡不反应,可以测量出氢氧化钠的含量,B正确;C、两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等,这说明两种碱不能同时是强碱,其中Y一定是弱碱,因此不能确定两种碱的浓度关系,C不正确;D、非金属性强弱与氢化物的酸性强弱无关系,因此根据等物质的量浓度的HF与HCl溶液的pH,后者较小不能得出非金属性Cl>F,D不正确,答案选B。 考点:考查化学实验方案设计与评价 9. 下列关于各图的叙述中,正确的是 A. 图甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 B. 图甲表示2 mol H2(g)所具有的能量比2 molH2O(g)所具有的能量多483.6 kJ C. 图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH D. 图乙中起始时HA的物质的量浓度大于HB 【答案】C 【解析】试题分析:A、氢气燃烧放热,A错误;B、图甲表示2 mol H2(g)和1mol氧气所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ,B错误;C、酸越弱,在稀释时pH变化程度小,则根据乙图可知HA的酸性强于HB。酸越弱,酸根越易水解,溶液碱性越强,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH,C正确;D、HA的电离程度强于HB,则在pH相等的条件下,HA的浓度小于HB,D错误,答案选C。 考点:考查反应热、弱电解质的电离、盐类水解等 10. 人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡: H++HCO3- H2CO3 CO2+H2 H++PO43-HPO42- H++HPO42-H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是 A. 当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 B. 当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 C. 某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒 D. 在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小 【答案】C 【解析】试题分析:人体体液的缓冲系统中存在如下平衡:H++HCO3-H2CO3CO2+H2O、H++PO43-HPO42-、H++HPO42-H2PO4-,所以当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定,故A正确;当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定,故B正确;某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,但是pH值不会减小,故C错误,为本题的答案;在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小,故D正确。 考点:电离平衡 点评:本题考查了电离平衡,该知识点是高考考查的重点,本题难度不大。 11. 在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是 ①FeCl3溶液与Cu的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 ③饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 ④配制FeCl3溶液需加入一定量的盐酸 A. ①④ B. ②③④ C. ②③ D. ①②③④ 【答案】B 【解析】试题分析:①是铁离子的氧化性,与水解是无关系的。铁离子在溶液中存在水解平衡,生成氢氧化铁和盐酸,加热促进水解,且生成的盐酸易挥发,从而最终得到氢氧化铁固体,灼烧生成氧化铁,②有关系;利用铁离子的水解可用制备氢氧化铁胶体,铁离子水解显酸性,加入盐酸的目的是抑制铁离子的水解,即选项③④均与水解有关系,答案选B。 考点:考查铁离子水解的有关判断和应用 点评:该题是基础性试题的考查,侧重对教材基础知识的巩固和训练,旨在培养学生灵活运用水解原理解决实际问题的能力。有利于培养学生的应试能力,激发学生学习化学的兴趣。 12. 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下) ①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。 ②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。 ③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3 )+2c(CO32-) ④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0 ⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw; 则三者关系为:Ka·Kh=Kw ⑥反应A(g)2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 A. ①②③⑥ B. ③④⑤⑥ C. ②④⑤⑥ D. ①③④⑤ 【答案】B 【解析】试题分析:① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。错误,C(H+)降低,C(OH-)增大;A、D错误;② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。错误,pH=2,可以计算出C(H+)=10-2,pH=1,可以计算出C(H+)=10-1,c(H+)之比为1∶10,C错误,B正确。 考点:考查弱电解质的电离平衡、PH计算、电荷守恒、平衡常数、反应焓变的计算 13. 25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是 A. 相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大 B. 物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大 C. 等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH D. HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:Ka•K=Kw 【答案】D 【解析】试题分析:A、pH相同,两种酸溶液的c(OH—)相同,则水电离的c(OH—),因此水电离的c(H+)也相同,错误;B、由已知条件可知,电离程度:CH3COOH>HCN,则水解程度:CH3COONa查看更多
相关文章
- 当前文档收益归属上传用户