- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省九师联盟2020届高三5月质量检测试题 化学
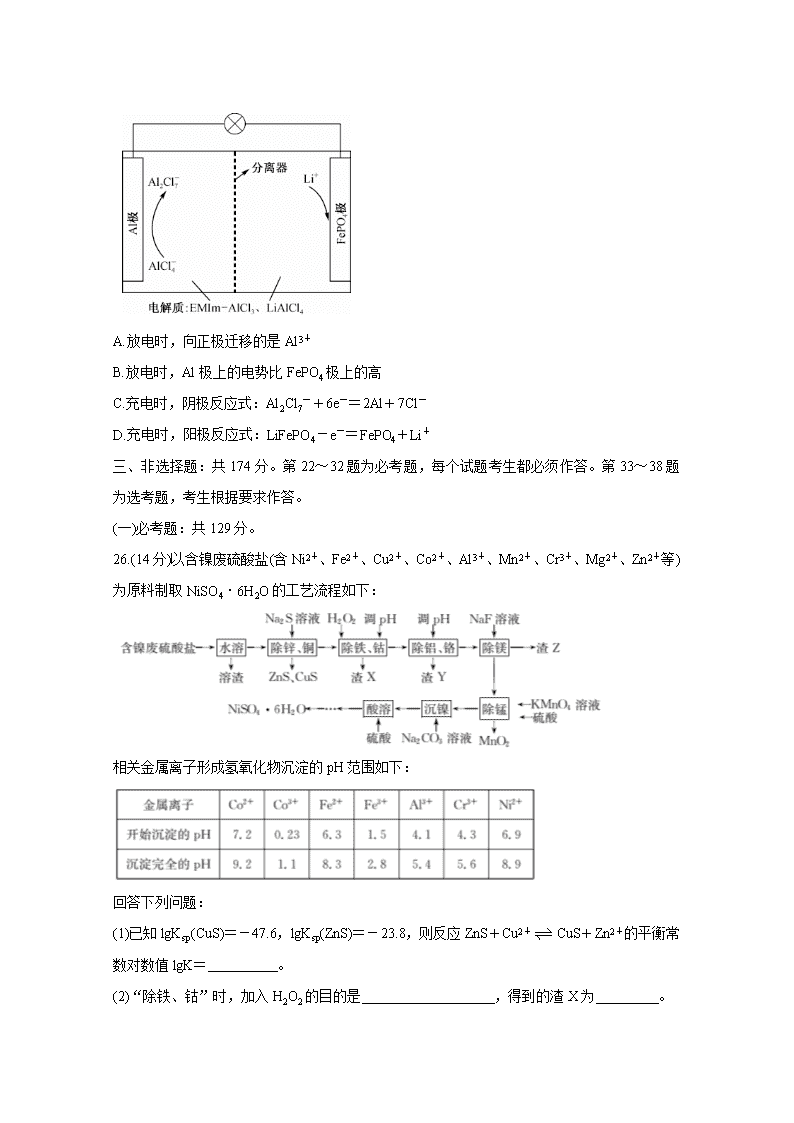
2019~2020学年高三5月质量检测 理科综合 化学部分 考生注意: 1.本试卷分选择题和非选择题两部分。满分300分,考试时间150分钟。 2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。 3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。 4.本卷命题范围:高考范围。 5.可能用到的相对原子质量:H1 C12 N14 O16 S32 Co59 一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.苏颂《本草图经》有关不灰木(火浣布)有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”成分可能是 A.纤维素 B.硅酸盐 C.氧化铁 D.动物毛皮 8.化合物(a)与(b)的结构简式如图所示。下列叙述正确的是 A.(a)与(b)互为同分异构体 B.(a)分子中所有碳原子均共面 C.(b)的一氯取代物共有3种 D.(a)与(b)均能使Br2/CCl4褪色 9.设NA为阿伏加德罗常数的值。下列说法正确的是: A.标准状况下,2.24 L三氯甲烷中含氢原子数为0.1NA B.0.1 mol·L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA C.8.0 g NH4NO3发生反应5NH4NO3=4N2+2HNO3+9H2O,转移电子数为0.3NA D.O.1 mol P35Cl2与足量37Cl2发生反应:PCl3+Cl2PCl5,产物中P-37Cl键数为0.2NA 10.硼烯是继石墨烯之后又一种“神奇纳米材料” ,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是 A.“皱褶”式硼烯中含B、H两种元素 B.“皱褶”式硼烯中硼原子达到8电子稳定结构 C.硼的最高价氧化物对应水化物的酸性比碳酸的强 D.硼烯有望代替石墨烯作锂离子电池的电极材料 11.等体积两种一元酸“酸1”和“酸2”分别用等浓度的KOH溶液滴定,滴定曲线如图所示。下列说法错误的是 A.“酸1”比“酸2”的酸性强 B.“酸2”的浓度为0.01 mol·L-1 C.“酸2”的Ka的数量级约为10-5 D.滴定“酸1”和“酸2”均可用酚酞作指示剂 12.某新型离子电池电解质的化学组成为W5.7XY4.7Z1.3(各元素的化合价均为最高正价或最低负价),已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z位于同周期,W原子的核外电子总数与Y原子的最外层电子数之和等于9,Y的最高正价与最低负价代数和为4。下列说法错误的是 A.常见单质的沸点:Y>Z B.W的单质能与冷水反应 C.X与Z原子序数之和是Y核电荷数的2倍 D.W、X、Y、Z的简单离子均能促进水的电离 13.一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiAl2Cl7+3LiFePO4(s)Al+3FePO4+7LiAlCl4。下列说法正确的是 A.放电时,向正极迁移的是Al3+ B.放电时,Al极上的电势比FePO4极上的高 C.充电时,阴极反应式:Al2Cl7-+6e-=2Al+7Cl- D.充电时,阳极反应式:LiFePO4-e-=FePO4+Li+ 三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。 (一)必考题:共129分。 26.(14分)以含镍废硫酸盐(含Ni2+、Fe2+、Cu2+、Co2+、Al3+、Mn2+、Cr3+、Mg2+、Zn2+等)为原料制取NiSO4·6H2O的工艺流程如下: 相关金属离子形成氢氧化物沉淀的pH范围如下: 回答下列问题: (1)已知lgKsp(CuS)=-47.6,lgKsp(ZnS)=-23.8,则反应ZnS+Cu2+CuS+Zn2+的平衡常数对数值lgK= 。 (2)“除铁、钴”时,加入H2O2的目的是 ,得到的渣X为 。 (3)“除铝、铬”时,调pH范围为 ;渣Y中含Cr(OH)3,其性质与Al(OH)3类似,写出Cr(OH)3与NaOH反应的化学方程式: 。 (4)“除锰”时,发生反应的离子方程式为 。 (5)“酸溶”得到溶液制备NiSO4·6H2O晶体,还需进行的操作工艺是 。 27.(15分)CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6 g;在150℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。 (1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S): ①使装置a中反应发生的操作为 ;装置b中盛放的试剂是 。 ②装置c中的长直导管的作用是 ,三颈烧瓶中通人CO2不能过量,原因是 。 (2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是 ;该反应的化学方程式为 。 (3)探究硫脲的性质: ①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是 (填化学式,下同)。 ②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 。 ③可用酸性KMnO4溶液滴定硫脲,已知MnO4-被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42-,该反应中氧化剂与还原剂的物质的量之比为 。 28.(14分)热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题: (1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O3H++HSO4-+2I -、I-+I2I3-。若起始时n(I2)=n(SO2)=1 mol,I-、I3-、H+、HSO4-的物质的量随的变化如图所示: 图中表示的微粒:a为 ,d为 。 (2)起始时HI的物质的量为1 mol,总压强为0.1MPa下,发生反应HI(g)H2(g)+I2(g)。平衡时各物质的物质的量随温度变化如图所示: ①该反应的△H (填“>”或“<”)0。 ②600℃时,平衡分压p(I2)= MPa,反应的平衡常数Kp= (Kp为以分压表示的平衡常数)。 (3)反应H2(g)+I2(g)2HI(g)的反应机理如下: 第一步I22I(快速平衡) 第二步I+H2H2I(快速平衡) 第三步H2I+I2HI(慢反应) ①第一步反应 (填“放出”或“吸收”)能量。 ②只需一步完成的反应称为基元反应,基元反应如aA+dD=gG+hH的速率方程,v=kca(A)·cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成HI(g)的速率方程为v= (用含k1、k-1、k2…的代数式表示)。 (二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。 35.[化学——选修3:物质结构与性质](15分) iCo2S4g-C3N4-CNT是一类很有发展前途的化合物电催化剂。回答下列问题: (1)基态Co2+的价层电子排布图(轨道表达式)为 ;基态S原子电子占据最高能级的电子云轮廓图为 形。 (2)g-C3N4(结构片段如图1,环上化学键与苯环类似)可由三聚氰胺()与(NH4)2SO4共热制得。 ①g-C3N4分子中环上的氮原子、碳原子杂化方式依次为 、 。 ②SO42-的空间构型为 。 ③三聚氰胺分子中含σ键 个,它不溶于冷水,溶于热水,其主要原因是 。 (3)碳纳米管(CNT,结构如图2)具有良好的导电性,其原因是 。 (4)CoS2具有AB2型立方结构(如图3),晶胞参数为553.4 pm。设NA为阿伏加德罗常数的值,则晶体的密度为 g·cm-3(列出计算式)。 36.[化学——选修5:有机化学基础](15分) 孟鲁司特钠可用于抗新型冠状病毒肺炎,其制备中间体G的一种合成路线如下: 已知: ①B、C除苯环外还含有一一个五元环,D的苯环上只有两个取代基; 回答下列问题: (1)A的化学名称是 。 (2)F中含氧官能团名称是 。 (3)B的结构简式为 。 (4)D生成E同时生成乙酸的化学方程式为 。 (5)E生成F的反应类型是 。 (6)化合物W与G互为同分异构体,能发生水解反应,其核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则W的结构简式为 (写一种)。 (7)设计以苯甲酸和乙醇为起始原料制备3-苯基3-戊醇()的合成路线: 。(无机试剂及有机溶剂任用)查看更多