- 2021-07-06 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届山东省曲阜师范大学附属中学高二下学期第一次月考化学试题(解析版)
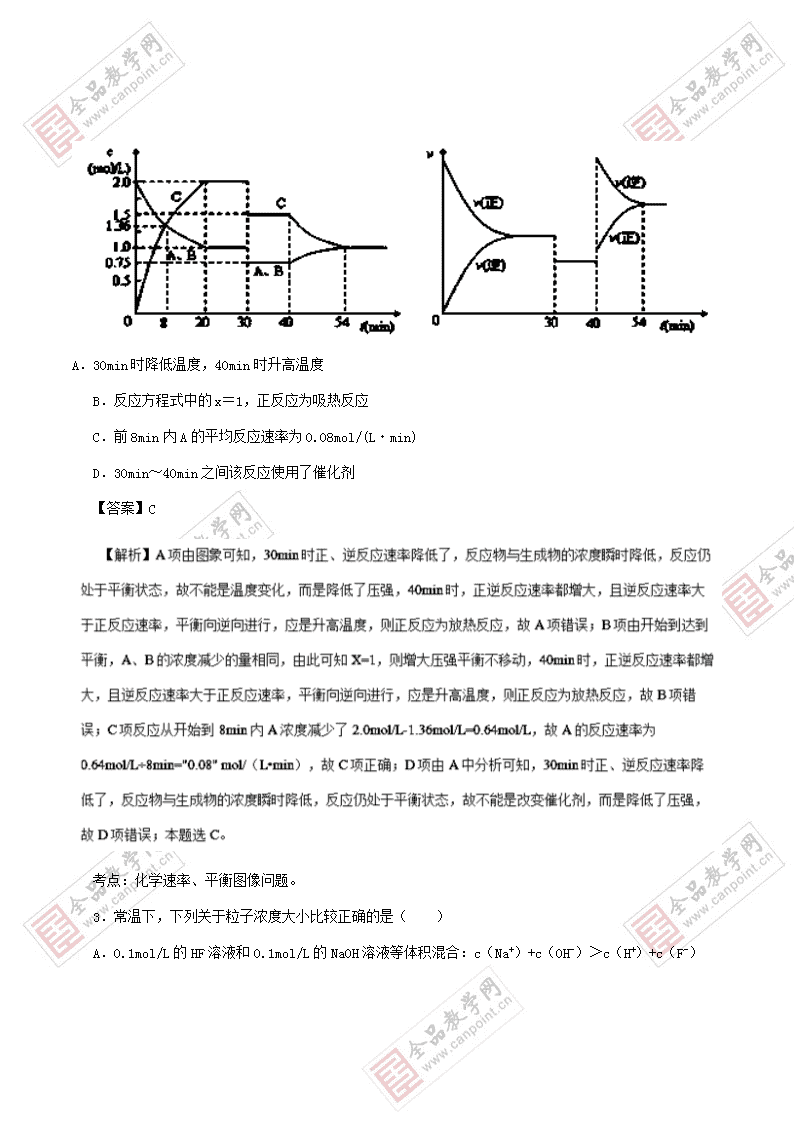
分值:100分 考试时间:50分钟 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 (第Ⅰ卷) 一、选择题(单选,每个小题6分,共48分,请把答案涂到答题卡相应的位置。) 1.下列描述正确的是( ) A.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量。 B.已知氢氢键键能为akJ/mol,氯氯键键能为bkJ/mol,氢氯键键能为ckJ/mol,则生成1molHCl放出的能量为(a+b-2c)/2kJ C.需要加热才能发生的反应一定是吸热反应 D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的反应热为:△H=+2×283.0kJ/mol 【答案】D 【解析】A.中和热是指生成1mol水放出的热量,H2SO4和Ca(OH)2反应生成硫酸钙和水,生成硫酸钙微溶,形成过程放热,则浓 H2SO4和 Ca(OH)2反应的中和热△H<2×(-57.3)kJ/mol,故A错误;B.H2与Cl2生成HCl的反应的化学方程式为:H2+Cl2=2HCl 其焓变△H=反应物的键能-生成物的键能=(a+b-2c)kJ/mol,则生成1molHCl放出的能量为-(a+b-2c)/2kJ,,故B错误;C.有些放热反应必须在加热条件下才能进行,如铝热反应,故C错误;D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故D正确;故选D。 2.在某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g) + xB(g) 2C(g),达到平衡后,在不同的时间段,分别只改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间变化如下图所示 。下列说法中正确的是( ) A.30min时降低温度,40min时升高温度 B.反应方程式中的x=1,正反应为吸热反应 C.前8min内A的平均反应速率为0.08mol/(L・min) D.30min~40min之间该反应使用了催化剂 【答案】C 考点:化学速率、平衡图像问题。 3.常温下,下列关于粒子浓度大小比较正确的是( ) A.0.1mol/L的HF溶液和0.1mol/L的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(H+)+c(F-) B.向0.10mol/LNaHSO3溶液中通入NH3至溶液pH=7 (体积变化可忽略):c(Na+)>c(NH4+)>c(SO32-) C.0.3mol的SO2通入1L0.4mol/L的NaOH溶液中:4c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3) D.pH=4的CH3COOH溶液和pH=10的KOH溶液等体积混合:2c(K+)+c(H+)= c(OH-)+ c(CH3COOH)+ 2c(CH3COO-) 【答案】A 【点睛】考查离子浓度大小比较,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,易错选项是D,注意C利用物料守恒判断即可,不需要计算出溶液中溶质成分。 4.一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质溶液为6 mol/L的 KOH溶液。 下列说法中正确的是( ) A.放电时K+ 移向负极 B.放电时电池正极的电极反应为NiO(OH) + H2O + e- = Ni(OH)2 + OH- C.放电时电池负极的电极反应为H2 - 2e- = 2H+ D.该电池充电时将碳电极与外接电源的正极相连 【答案】B 【解析】A.放电时,该电池为原电池,电解质溶液中阳离子向正极移动,所以钾离子向正极移动,故A错误;B.放电时,正极上NiO(OH)得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故B正确;C.放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,故C错误;D.该电池充电时,碳电极附近物质要恢复原状,则应该得电子发生还原反应,所以碳电极作阴极,应该与电源的负极相连,故D错误;故选B。 5.分枝酸可用于生化研究,其结构简式如图。 下列关于分枝酸的叙述正确的是( ) A.分枝酸的分子式为C10H12O6 B.分枝酸属于芳香化合物 C.分枝酸能发生酯化反应、加成反应 D.分枝酸分子中含有3种官能团 【答案】C 【解析】A.由结构可知分子式为C9H10O6,故A错误;B.分子结构中不含有苯环,不能称为芳香族化合物,故B错误;C.含碳碳双键可使溴的四氧化碳溶液,可发生加成,含有羧基可发生酯化反应,故C正确;D.含-COOH、碳碳双键、-OH及醚键,四种官能团,故D错误;故选C。 6.下列说法正确的是( ) A.丙烷没有同分异构体 B.CH(CH3)2CH2CH2CH3 的一氯代物有4种 C.二氯苯有3种,则四氯苯有6种 D.CH3OH与CH2OH-CH2OH都属于醇,互为同系物 【答案】A 【解析】A.丙烷不存在同分异构体,故A正确;B.CH(CH3)2CH2CH2CH3 等效氢为5种,其一氯代物有4种,故B错误;C.二氯苯有3种,则四氯苯也应该是3种,故C错误;D.CH3OH分子结构中只有一个醇羟基,而CH2OH-CH2OH分子结构中有两个醇羟基,二者都属于醇,但不是同系物,故D错误;答案为A。 7.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( ) A.分液、萃取、重结晶 B.分液、蒸馏、萃取 C.萃取、蒸馏、分液 D.蒸馏、萃取、分液 【答案】B 【解析】①汽油不溶于水,所以汽油和氯化钠溶液是分层的,可以采用分液的方法分离;②酒精和水是互溶的两种液体,可以采用蒸馏的方法来分离;③向氯化钠和单质溴的水溶液中加入萃取剂四氯化碳后,溴单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后分液即可实现二者的分离.①②③各混合液分离的正确方法依次是分液、蒸馏、萃取,所以选项C正确。 【考点定位】考查物质的分离、提纯的基本方法选择与应用的知识。 【名师点睛】物质中混有杂质要对物质进行分离提纯,物质的性质不同,物质中含有的杂质种类不同,使用的方法也不同。分离互不相溶的两层液体混合物用分液的方法;分离互溶的沸点相差较大的液体混合物 用蒸馏的方法;分离难溶性固体与可溶性液体混合物用过滤的方法;若溶质在互不相溶的溶剂中溶解度不同,溶质与新溶剂不能发生反应,可以利用萃取,然后再分液的分离;若固体溶质在溶剂中溶解度受温度影响变化不大,可以利用蒸发溶剂的方法分离;若固体溶质在溶剂中溶解度受温度影响变化较大,可以利用结晶的方法分离。总之,分离物质采用的方法要根据物质的性质进行确定。 8.10mL某种气态烃,在50mL氧气中完全燃烧,得到液态水和体积为35mL的混合气体(所有气体体积都是在同温同压下测定),则下列烃中符合题意的烃是( ) A.CH4 B.C2H2 C.C3H8 D.C2H6 【答案】D 【解析】令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,故烃完全燃烧,有氧气剩余,则x+<5,CxHy+(x+)O2xCO2+H2O(l) 气体体积减小△V 1 1+ 10mL 60mL-35mL=25mL 10mL︰25mL=1︰(1+);得y=6,由于x+<5,所以x<3.5,故x=2或3,故为乙烷或丙烯,故选D。 【点睛】根据原子守恒确定烃完全燃烧,氧气有剩余时根据,注意运用体积差的计算方法来解答;类物质碳原子个数一般小于4的为气体,令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,充分燃烧:CxHy+(x+ )O2 xCO2+ H2O,则x+ <5,根据方程式CxHy+(x+ )O2 xCO2+H2O(l)利用体积差量计算判断。 二、填空题(每空2分,共52分,请把答案写到相应的位置。) 9.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇 。 I:CH4(g)+H2O(g) CO(g)+ 3H2(g)△H= +206.0 kJ/mol II:CO(g)+2H2(g) CH3OH(g)△H=﹣129.0 kJ/mol ⑴CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为: ___________________________________________________________________________ ⑵将1.0mol CH4和2.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得一定的压强下CH4的转化率与温度的关系如图1(见上面题干中) 。 ①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为: _______________________________________ ②100℃时反应I的平衡常数为__________________________________ ⑶在压强为0.1Mpa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是______ (填字母序号). A.c(H2)减少 B.正反应速率加快,逆反应速率减慢 C.CH3OH 的物质的量增加 D.c ( H2 )/c (CH3OH )减小 E.平衡常数K增大 ⑷写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: __________________________________________________________________________ ⑸甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2 (见上面题干中);通电后,Co2+ 放电变为Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。 ①写出阳极电极反应式________________________________________________________ ②写出除去甲醇的离子方程式__________________________________________________ 【答案】 (1).CH4(g)+ H2O(g)= CH3OH(g)+ H2(g)△H = + 77.0 kJ/mol (2).0.003 mol/(L·min) (3).2.25×10- 4 (4).C D (5).CH3OH﹣6e- + 8OH- ═ CO32- + 6H2O (6).Co2+﹣e- = Co3+ (7).6Co3+ + CH3OH + H2O = CO2↑+ 6Co2+ + 6H+ 【解析】(1)根据盖斯定律,I + II得:CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为CH4(g)+H20(g)==CH3OH(g)+H2(g) △H="+77.0" KJ/mol;(2)①100 ℃达到平衡甲烷的转化率为50%,时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为=0.03mol/(L·min); ②;0.0225 (3)CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1;将容器的容积压缩, c ( H2)增大;正反应速率加快,逆反应速率加快; 平衡正向移动,CH3OH 的物质的量增加 ;平衡正向移动,所以重新平衡c ( H2)/ c (CH3OH )减小 ;温度不变平衡常数K不变;(4)①阳极发生氧化反应,电极反应式Co2+—e-="=" Co3+;②Co3+ 做氧化剂把水中的甲醇氧化成CO2,除去甲醇的离子方程式6Co3++ CH3OH + H2O==CO2↑ + 6Co2++ 6H+。 考点:本题考查燃料电池、反应速率、化学平衡。 10.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题: ⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是_________(填代号). a.溶液的pH增大 b.CH3COOH的电离程度增大 c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变 ⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中: c(CH3COO-)/c(CH3COOH)=______________________ ⑶常温下,将20mL 0.1 mol/L CH3COOH溶液 和20mL 0.1 mol/L HNO2 溶液分别与 20mL 0.1 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是_______(填写序号);反应结束后所得两溶液中,c(CH3COO-)________c(NO2-)(填“>”、“<”或“=”); ⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数_________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。 ⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________ 【答案】 (1).a d (2).18 (3).② (4).< (5).小于 (6).1.8×10-5 【解析】(1)向0.1mol•L-1CH3COOH 溶液中加入少量CH3COONa 晶体时;a.醋酸钠电离生成的醋酸根离子抑制醋酸电离,所以溶液的酸性减弱,pH增大,故a正确;b.醋酸钠电离出醋酸根离子导致溶液中醋酸根离子浓度增大,则抑制醋酸电离,所以CH3COOH的电离程度减小,故b错误;c.醋酸钠是强电解质,完全电离,所以溶液中离子浓度增大,则溶液的导电能力增强,故c错误;d.溶液中c(OH-).c(H+)=Kw,Kw只受温度影响,温度不变所以Kw不变,故d正确;故答案为ad;(2)混合液中=18;(3)亚硝酸电离平衡常数大于醋酸,所以相同浓度的醋酸和亚硝酸中,亚硝酸中氢离子浓度大于醋酸,所以亚硝酸反应速率大于醋酸,制取相同体积的二氧化碳,亚硝酸需要的时间短,所以②是醋酸反应曲线;反应结束后,醋酸根离子水解程度大于亚硝酸根离子,所以溶液中存在c(CH3COO-)<c(NO2-);(4)pH相同的一元弱酸,加水稀释促进弱酸电离,加水稀释相同的倍数时pH变化越小的酸越弱,根据图知,稀释相同的倍数时HXpH变化小于醋酸,所以HX酸性小于醋酸,则HX的电离平衡常数小于CH3COOH的电离平衡常数;(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,二者恰好完全反应生成醋酸铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相同,则醋酸电离平衡常数等于一水合氨电离平衡常数为1.8×10-5。 11.有机化学基础填空题: ⑴具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论。根据上图回答:该物质具有的官能团是_______________、_____________(填化学式),所以该物质即可以归为_____________类又可以归为____________类(填有机物的类别)。 ⑵写出下列化合物的名称或结构简式: ①结构简式为 ;此烃的名称为__________________ ②结构简式为此烃的名称为_______________ ③2,4-二甲基已烷的结构简式为_________________ 【答案】 (1).—COOH (2).—CHO (3).羧酸 (4).醛 (5).3-甲基-2-乙基-1-戊烯 (6).1, 2—二甲基—4—乙基苯 (7). 【解析】(1)有机物含有的官能团有羧基、酚羟基和醛基,所以这个化合物可看作羧酸类和醛类;(2)① 的最长碳链含有5个碳原子,为戊烯,在3号碳原子上有一个甲基,在2号碳原子上有一个乙基,命名为:3-甲基-2-乙基-1-戊烯;②有苯环的,命名时可以依次编号命名,命名为:对甲基乙苯或4-甲基乙基苯;③根据2,4-二甲基已烷的名称可知,在主链上有6个碳原子,在2号和4号碳上各有一个甲基,结构简式为。 【点睛】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长:选最长碳链为主链;②多:遇等长碳链时,支链最多为主链;③近:离支链最近一端编号;④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;(2)有机物的名称书写要规范;(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。 12.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为原料制备环己烯。 已知: ⑴制备粗品:将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。 ①A中碎瓷片的作用是_________________,导管B除了导气外还具有的作用是______________________。 ②试管C置于冰水浴中的目的是________________ ③从环己醇的水溶液中获得较纯净的环己醇的方法是______________ ⑵某烃X能使溴的CCl4溶液褪色,1molX完全燃烧时消耗9molO2并生成等物质的量的CO2与H2O,又知X中仅含有2个甲基,则符合上述条件的X结构最多有_______种。经测定,该烃X的核磁共振氢谱示意图如图,则X的结构简式为(写其中一种即可):________________________ 【答案】 (1).防暴沸 (2).冷凝 (3).冷却环己烯,使其液化,防止其挥发 (4).蒸馏 (5).6 (6).CH3-CH2-CH=CH-CH2-CH3 或 【解析】(1)①根据实验室制乙烯可知,发生装置A中碎瓷片的作用是防止暴沸,导管B比较长,能增加与空气的接触面积,其作用是导气和将生成的气体物质冷凝回流;②冰水浴的目的是降低环己烯蒸气的温度,使其液化防止环己烯挥发;③环己醇与水相互混溶,可根据沸点的差异,利用蒸馏操作进行分离;(2)某烃X能使溴的CCl4溶液褪色,说明分子结构中含有碳碳双键,1molX完全燃烧时消耗9molO2并生成等物质的量的CO2与H2O,说明碳氢原子数目比为1:2,设此有机物的分子式为CnH2n,则:n+=9,解得n=6,此有机物的分子式为C6H12,又知X中仅含有2个甲基,则符合上述条件的X结构有CH3CH2CH2CH=CHCH3、CH3CH2CH=CH2CH2CH3、CH2=CHCH2CH(CH3)2、CH2=C(CH3)CH2CH2CH3、CH2=CHCH(CH3)CH2CH3、 共6种结构;其中满足核磁共振氢谱图示的有CH3-CH2-CH=CH-CH2-CH3 或。 【点睛】清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中只有一组峰,说明该分子中的H原子都是等效的,只有1种H原子,等效氢判断:①同一碳原子上的氢原子是等效的,②同一碳原子上所连接甲基上的氢原子是等效的,③处于同一对称位置的碳原子上的氢原子是等效的。 查看更多