- 2021-07-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高一化学下学期期末考试试题(新版)人教新目标版
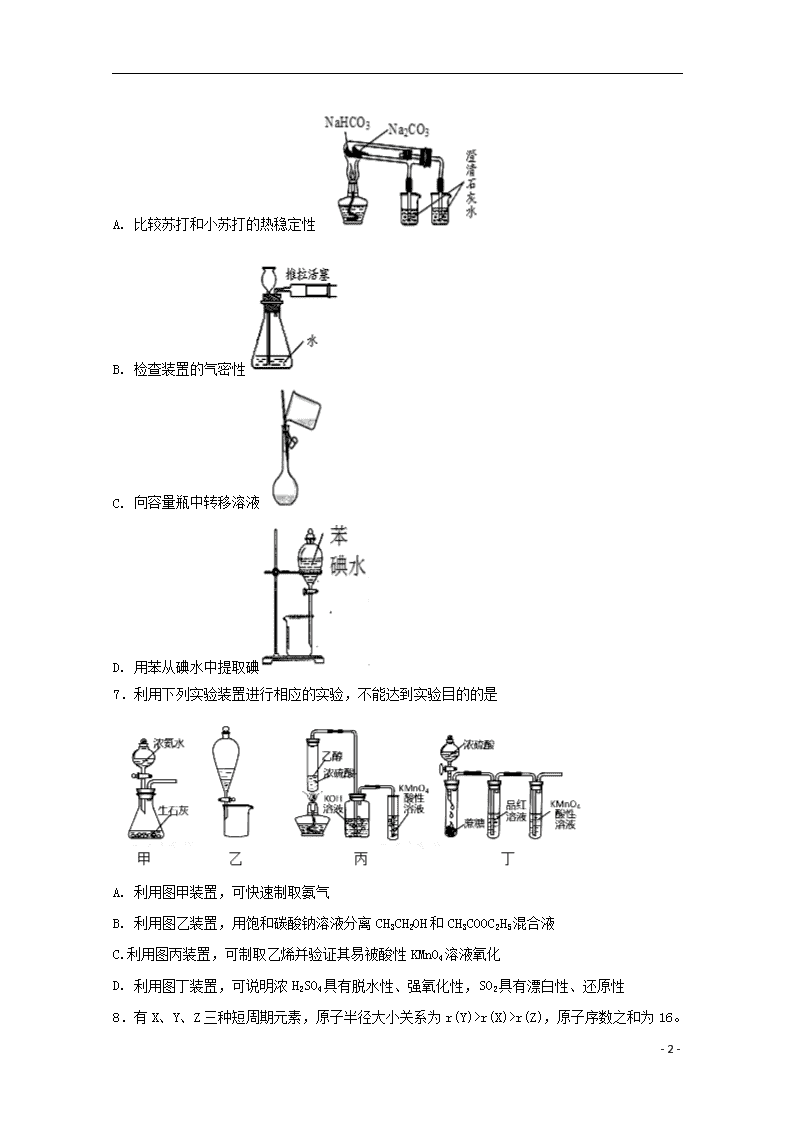
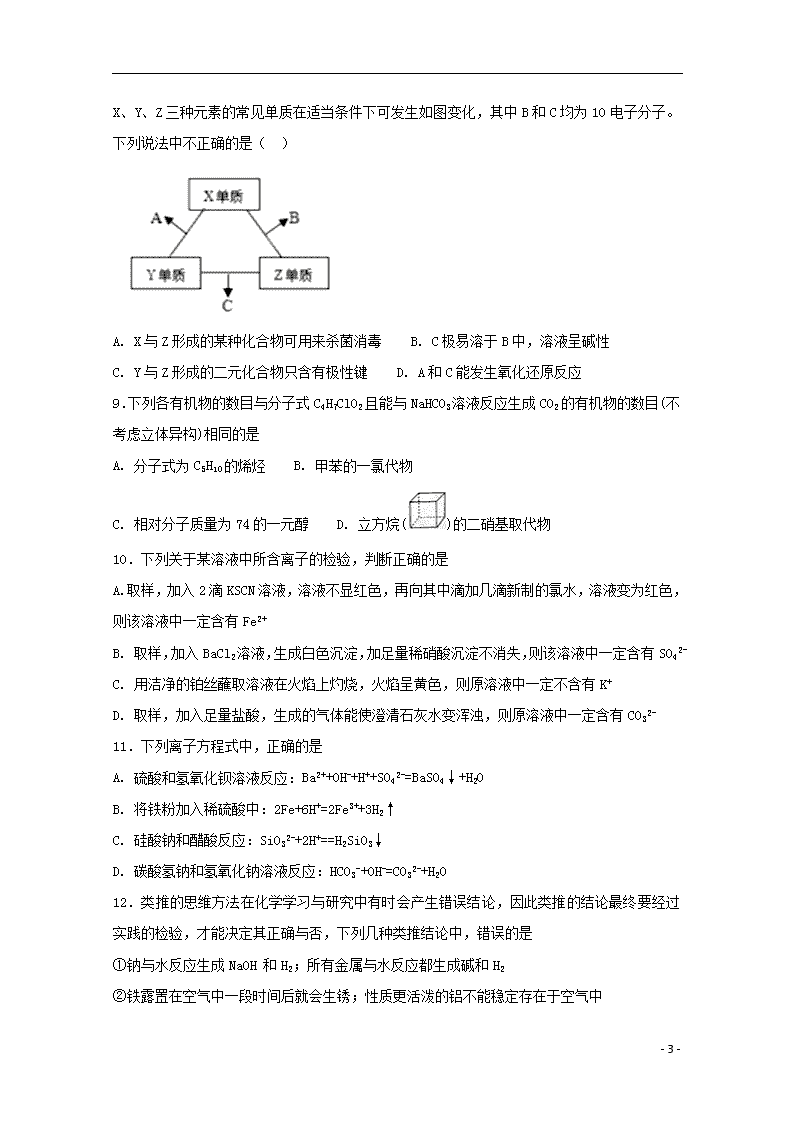
2019学年度第二学期期末考试 高一年级 化学试卷 一、单选题 1.室温下,下来事实不能说明NH3·H2O为弱电解质的是 A. 0.1 mol·L-1NH3·H2O的pH小于13 B. 0.1 mol·L-1 NH4Cl溶液的pH小于7 C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱 D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色 2.设NA为阿伏加德罗常数值。下列有关叙述正确的是 A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA C. 1 mol Fe溶于过量硝酸,电子转移数为2NA D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA 3.某同学在实验室中用KMnO4代替MnO2制备Cl2,反应原理为2KMnO4+16HCl(浓)== 2KCl+2MnCl2+5Cl2↑+8H2O。下列叙述不正确的是( ) A. 氧化剂为KMnO4,其中Cl元素被还原 B. 若有0.8molH2O生成,则反应中有NA个电子转移 C. 浓HCl在反应中起酸性和还原性的作用 D. 氧化剂与还原剂的物质的量之比为1:5 4.下列离子方程式书写正确的是( ) A. 漂白粉溶液中通入过量的CO2: Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HClO B. 氯气与水的反应: Cl2+H2O2H++Cl-+ClO— C. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3—+Ba2++OH-=BaCO3↓+H2O D. 钠和冷水反应 : Na+2H2O=Na++2OH-+H2↑ 5.将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是( ) A. Na和Fe B. Mg和Cu C. Al和Mg D. Zn和Fe 6.下列不能达到实验目的是( ) - 8 - A. 比较苏打和小苏打的热稳定性 B. 检查装置的气密性 C. 向容量瓶中转移溶液 D. 用苯从碘水中提取碘 7.利用下列实验装置进行相应的实验,不能达到实验目的的是 A. 利用图甲装置,可快速制取氨气 B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 C.利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 8 - 8 - .有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法中不正确的是( ) A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性 C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应 9.下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是 A. 分子式为C5H10的烯烃 B. 甲苯的一氯代物 C. 相对分子质量为74的一元醇 D. 立方烷()的二硝基取代物 10.下列关于某溶液中所含离子的检验,判断正确的是 A. 取样,加入2滴KSCN溶液,溶液不显红色,再向其中滴加几滴新制的氯水,溶液变为红色,则该溶液中一定含有Fe2+ B. 取样,加入BaCl2溶液,生成白色沉淀,加足量稀硝酸沉淀不消失,则该溶液中一定含有SO42- C. 用洁净的铂丝蘸取溶液在火焰上灼烧,火焰呈黄色,则原溶液中一定不含有K+ D. 取样,加入足量盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- 11.下列离子方程式中,正确的是 A. 硫酸和氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O B. 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ C. 硅酸钠和醋酸反应:SiO32-+2H+==H2SiO3↓ D. 碳酸氢钠和氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O 12.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是 ①钠与水反应生成NaOH 和H2;所有金属与水反应都生成碱和H2 ②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 - 8 - ③化合物KCl的焰色为紫色;K2CO3的焰色也为紫色 ④钠钾合金的熔点应介于Na和K熔点之间 A. ①② B. ①④ C. ①②③④ D. ①②④ 13.已知氧化性:Br2>Fe3+,向含有2molFeBr2的溶液中加入含a molCl2的氯水,充分反应,下列说法不正确的是 A. 离子的还原性强弱:Fe2+>Br->Cl- B. 当a≤1时,发生的离子反应:2Fe2++Cl2 === 2Fe3++2Cl- C. 当a=2时,反应后的离子浓度之比为:c(Fe3+):c(Br-):c(Cl-)=1:2:2 D. 当a≥3时,发生的离子反应:2Fe2++4Br-+3Cl2 === 2Fe3++2Br2+6Cl- 14.下列离子方程式书写不正确的是( ) A. Cu在加热时溶于过量浓硫酸:Cu+4H++Cu2++SO2↑+2H2O B. Na2O2与H2O反应制备O2:2Na2O2+2H2O=4Na++4OH-+O2↑ C. 向Mg(HCO3)2溶液中加入过量NaOH溶液: Mg2++4OH-+2=Mg(OH)2↓+2H2O+2 D. 向FeI2溶液中加入过量溴水:2Fe2++4I-+3Br2=2Fe3++2I2+6Br- 15.有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示。有关它的说法中错误的是( ) A. 其二氯代物有4种 B. 它所有的原子均在同一平面上 C. 其分子式为C6H8 D. 它不可能是环丙烷的同系物 16.16.28g铜、银合金与足量的一定浓度的硝酸完全反应,放出的气体与2.24L的O2(标准状况)混合,通入水中,恰好完全吸收,则合金中Cu与Ag的物质的量之比为( ) A. 1:1 B. 1:2 C. 2:1 D. 3:1 17.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是( ) A. Cu2S 既是氧化产物又是还原产物 B. 5molFeS2发生反应,有10mol电子转移 C. FeS2只作还原剂 D. 产物中的SO42-离子有一部分是氧化产物 18.对于下列反应的说法中正确的是( ) - 8 - A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂 B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1 C. 反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成3molCl2,转移电子6mol D. Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+ 19.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( ) A. 反应中共消耗1.8molH2SO4 B. 气体甲中SO2与H2的体积比为7:1 C. 反应中共消耗1.6molZn D. 反应中共转移3.2mol电子 20.下列说法在一定条件下可以实现的是( ) ①酸性氧化物与酸发生反应 ②没有电子转移的氧化还原反应 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥通过单质化合形成FeCl2 A. ①③④⑤ B. ②④⑤ C. ①②③⑤⑥ D. ③⑤⑥ 二、综合题 21.有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Al3+、Mg2+、Ba2+、Fe3+、SO42-、CO32-和I-。取该溶液进行以下实验: ①用pH试纸检验,溶液呈酸性; ②取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色; ③另取部分溶液,加入稀NaOH溶液使其变为碱性,溶液中始终无沉淀生成; ④取部分上述碱性溶流,加Na2CO3溶液有白色沉淀生成; ⑤将③得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。 (1)根据上述实验事实,该溶液中肯定存在的离子是_________;肯定不存在的离子是______。 (2)对于不确定是否存在的离子,应用___________方法进行检验。 - 8 - (3)实验②中发生反应的离子方程式为____________________。 (4)实验④中发生反应的离子方程式为____________________。 22.铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表: 物质 Al Al2O3 Fe Fe2O3 熔点/℃ 660 2 054 1 535 1 462 沸点/℃ 2 467 2 980 2 750 ﹣ I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____(填“合理”或“不合理”)。 (2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。 (3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。 A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液 Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题: (1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________; (2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________; - 8 - (3)熔融物中铝元素的物质的量为_______mol。 (4)B点对应的沉淀的物质的量为____mol。 - 8 - 参考答案 DAACB ACCAA DDCAB BDBBA 21. H+、NH4+、Ba2+、I- Al3+、Mg2+、Fe3+、SO42-、CO32- 焰色反应 2I-+Cl2=I2+2Cl- Ba2++CO32-=BaCO3↓ 22. 合理 NaOH溶液 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ B 8Fe+30H++3NO3﹣═8 Fe3++3NH4++9 H2O Al(OH)3 + OH- =AlO2- + 2H2O 0.012 0.048 - 8 -查看更多