- 2021-07-06 发布 |
- 37.5 KB |
- 26页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习增分攻略:新情境下陌生方程式、离子方程式的书写学案(全国通用)
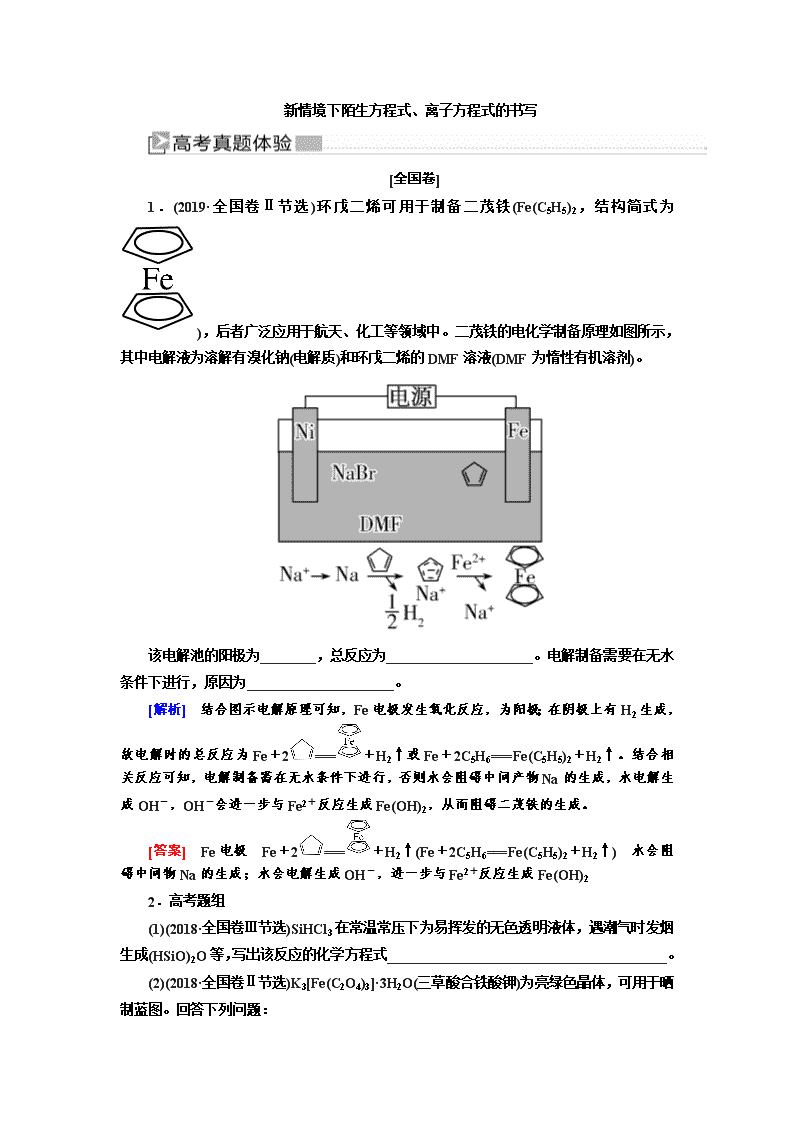
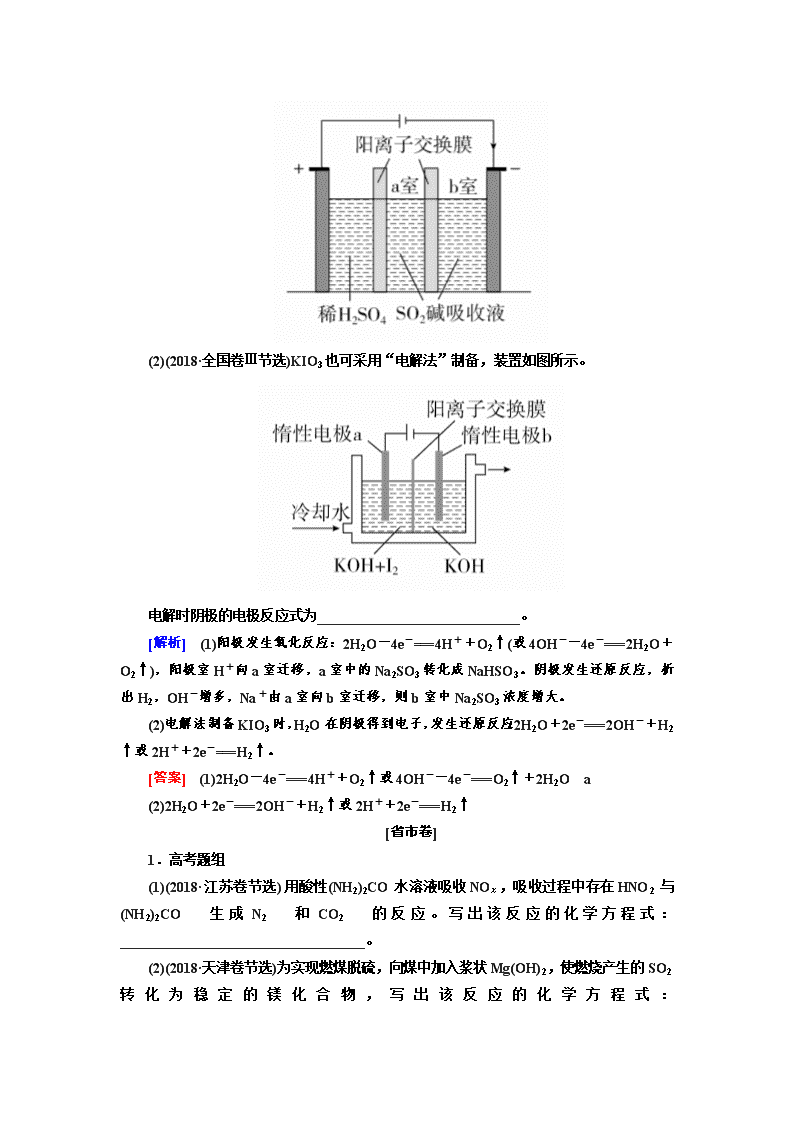
新情境下陌生方程式、离子方程式的书写 [全国卷] 1.(2019·全国卷Ⅱ节选)环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 该电解池的阳极为________,总反应为_____________________。电解制备需要在无水条件下进行,原因为_____________________。 [解析] 结合图示电解原理可知,Fe电极发生氧化反应,为阳极;在阴极上有H2生成,故电解时的总反应为Fe+2===+H2↑或Fe+2C5H6===Fe(C5H5)2+H2↑。结合相关反应可知,电解制备需在无水条件下进行,否则水会阻碍中间产物Na的生成,水电解生成OH-,OH-会进一步与Fe2+反应生成Fe(OH)2,从而阻碍二茂铁的生成。 [答案] Fe电极 Fe+2===+H2↑(Fe+2C5H6===Fe(C5H5)2+H2↑) 水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2 2.高考题组 (1)(2018·全国卷Ⅲ节选)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式________________________________________。 (2)(2018·全国卷Ⅱ节选)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题: 晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为2K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为________________________________。 (3)(2018·全国卷Ⅰ节选)①生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:________________________________________ ②(2018·全国卷Ⅰ节选)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_________________________________。 [解析] (1)SiHCl3遇潮气时发烟生成(HSiO)2O等,结合原子守恒推知SiHCl3与水蒸气反应除生成(HSiO)2O外,还生成HCl,化学方程式为2SiHCl3+3H2O===(HSiO)2O+6HCl。 (2)光解反应的化学方程式为2K3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑,反应后有草酸亚铁产生,联想Fe2+的检验:用K3[Fe(CN)6]可以生成蓝色沉淀Fe3[Fe(CN)6]2,题目也表明是显色剂。所以显色反应的化学方程式为3FeC2O4+2K3[Fe(CN)6]=== Fe3[Fe(CN)6]2+3K2C2O4。 (3)①NaHSO3结晶脱水生成Na2S2O5。 ②I2作氧化剂,将S2O氧化成SO,本身被还原为I-。 [答案] (1)2SiHCl3+3H2O===(HSiO)2O+6HCl (2)3FeC2O4+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2+3K2C2O4 (3)①2NaHSO3===Na2S2O5+H2O ②S2O+2I2+3H2O===2SO+4I-+6H+ 3.高考题组 (1)(2018·全国卷Ⅰ节选)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为________________________________。电解后,________室的NaHSO3浓度增加。 (2)(2018·全国卷Ⅲ节选)KIO3也可采用“电解法”制备,装置如图所示。 电解时阴极的电极反应式为_____________________________。 [解析] (1)阳极发生氧化反应:2H2O-4e-===4H++O2↑(或4OH--4e-===2H2O+O2↑),阳极室H+向a室迁移,a室中的Na2SO3转化成NaHSO3。阴极发生还原反应,析出H2,OH-增多,Na+由a室向b室迁移,则b室中Na2SO3浓度增大。 (2)电解法制备KIO3时,H2O在阴极得到电子,发生还原反应:2H2O+2e-===2OH-+H2↑或2H++2e-===H2↑。 [答案] (1)2H2O-4e-===4H++O2↑或4OH--4e-===O2↑+2H2O a (2)2H2O+2e-===2OH-+H2↑或2H++2e-===H2↑ [省市卷] 1.高考题组 (1)(2018·江苏卷节选)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________________________________。 (2)(2018·天津卷节选)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的镁化合物,写出该反应的化学方程式: ___________________________________。 (3)(2017·江苏卷节选)①45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为______________________________________。 ②NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为_______________________________________。 (4)(2016·上海卷节选)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2,已知HCN、HOCN中N元素的化合价相同。写出发生反应的离子方程式:____________________________________。 [解析] (1)由题给信息可知,反应物为HNO2、(NH2)2CO,生成物为CO2和N2,根据氧化还原反应方程式的配平方法可写出该反应的化学方程式为2HNO2+(NH2)2CO===2N2↑+CO2↑+3H2O。 [答案] (1)2HNO2+(NH2)2CO===2N2↑+CO2↑+3H2O (2)2Mg(OH)2+2SO2+O2===2MgSO4+2H2O (3)①4CuCl+O2+8H2O2Cu2(OH)2Cl2·3H2O ②4Ag+4NaClO+2H2O===4AgCl+4NaOH+O2↑ (4)2OCN-+3ClO-===CO+CO2↑+3Cl-+N2↑ 2.高考题组 (1)(2018·江苏卷节选)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:__________________________________________。 (2)(2018·天津卷节选)O2辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 电池的负极反应式:___________________________。 电池的正极反应式:6O2+6e-===6O 6CO2+6O===3C2O+6O2 反应过程中O2的作用是____________________________。 该电池的总反应式:___________________________。 (3)(2017·江苏卷节选)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: ①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_________________________________。 ②“电解Ⅱ”是电解Na2CO3溶液,原理如下图所示。阳极的电极反应式为______________________________________, 阴极产生的物质A的化学式为________。 [解析] (1)由题给信息可知,反应物为HNO2(弱酸),生成物为HNO3,因此阳极反应式为HNO2-2e-+H2O===3H++NO。 (2)该电池中Al作负极,电解质为含AlCl3的离子液体,故负极反应为Al-3e-===Al3+。正极为多孔碳电极,根据正极反应式,得正极总反应为6CO2+6e-===3C2O,O2不参与正极的总反应,故O2为催化剂。将负极反应 式:2Al-6e-===2Al3+和正极反应式:6CO2+6e-===3C2O相加,可得该电池的总反应式为2Al+6CO2===Al2(C2O4)3。 (3)①电解Al2O3,阳极O2-放电生成O2,石墨(C)电极会被O2氧化。②阳极水中的OH-放电生成O2及H+(2H2O-4e-===O2↑+4H+),H+与CO结合生成HCO(CO+H+===HCO,由题图可知阳极区Na2CO3转化为NaHCO3),写出总反应:4CO+2H2O-4e-===4HCO+O2↑。阴极,水中的H+放电生成H2。 [答案] (1)HNO2-2e-+H2O===3H++NO (2)Al-3e-===Al3+(或2Al-6e-===2Al3+) 催化剂 2Al+6CO2===Al2(C2O4)3 (3)①石墨电极被阳极上产生的O2氧化 ②4CO+2H2O-4e-===4HCO+O2↑ H2 考点一 陌生氧化还原反应方程式、离子方程式的书写 1.在日常的学习、练习中,注意记忆、积累常见元素的化合价;认识并掌握常见的氧化剂、还原剂。 (1)强氧化性物质或离子 Na2O2、Fe3+、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、Br2、HClO、NaClO、Ca(ClO)2、KMnO4(H+)。 (2)强还原性物质或离子 Fe2+、Fe(OH)2、SO2(H2SO3、Na2SO3、NaHSO3、SO)、H2S(Na2S、NaHS、S2-)、HI(NaI、I-)等。 2.掌握常见氧化剂、还原剂发生氧化还原反应的产物。有时候物质的氧化还原产物还要根据题中的情景信息考虑,如:H2S与浓硝酸反应甚至能被氧化为H2SO4,I-可以被过量的浓氯水氧化生成IO。了解常见物质反应后的存在形式,比如O2得电子后转变为O2-,在酸性环境下结合H+生成H2O,而在碱性条件下则与H2O转变为OH-。 3.书写信息型氧化还原反应方程式的步骤 (1)找出发生氧化还原反应的物质或离子。 (2)依据掌握的氧化还原反应规律合理地预测产物(这里要重视题目中的信息提示,或给出的生成物)。 (3)根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应计量数。 (4)根据原子守恒和溶液的酸碱性,通过在反应方程式的两端添加H+、OH-或H2O的形式使方程式的两端的电荷守恒。 【典例1】 (2019·全国卷Ⅱ节选)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉: (1)在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________________________________ 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为_________________________。 (2)在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的________(填化学式)。 (3)沉淀器中反应的离子方程式为_________________。 [思路点拨] [解析] (1)由流程图中经浸出槽后得到净化的BaS溶液以及回转炉尾气中含有有毒气体可知,在回转炉中BaSO4与过量的焦炭粉反应生成可溶性的BaS和CO;生产上可通过水蒸气变换反应除去回转炉中的有毒气体CO,即CO与H2O反应生成CO2和H2。(2)所得“还原料”的主要成分是BaS,BaS在潮湿空气中长期放置能与空气中的H2O反应生成具有臭鸡蛋气味的H2S气体,“还原料”的水溶性变差,表明其表面生成了难溶性的BaCO3。(3)结合立德粉的成分可写出沉淀器中S2-、Ba2+、Zn2+、SO反应生成BaSO4·ZnS的离子方程式。 [答案] (1)BaSO4+4CBaS+4CO↑ CO+ H2OCO2+H2 (2)BaCO3 (3)S2-+Ba2++Zn2++SO===BaSO4·ZnS↓ 题组一:陌生氧化还原反应方程式的书写 1.(1)(2019·重庆七校联考)工业上常用次氯酸钠溶液吸收N2H4,将其转化为无毒的N2,该过程发生反应的化学方程式为 ___________________________________________。 (2)(2019·广州综合测试一)二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如图: 步骤ⅰ中生成VOCl2的同时生成一种无色无污染的气体,该化学方程式为_______________________________。 (3)(2019·广东七校联合体第一次联考)工业上以含三价钒(V2O3)为主的某石煤(含有Al2O3、CaO等杂质)为原料,采用钙化法焙烧制备V2O5。其流程如下: 焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是_______________________。 (4)(2019·长春质检)S2Cl2与水反应,有无色刺激性气味的气体产生,并有黄色沉淀生成,该反应的化学方程式是 ___________________________________。 (5)(2019·福建模拟)工业上氰化钠常用于从矿物中提取金,通空气条件下金先与氰化钠溶液反应转化为Na[Au(CN)2],再用金属锌还原出金,同时生成Na2[Zn(CN)4]。两步反应的化学方程式分别为___________________________,_____________________。 [解析] (1)N2H4中N为-2价,生成物N2中N为0价,则N2H4作还原剂,NaClO作氧化剂,Cl的化合价降低,该反应的化学方程式为:N2H4+2NaClO===2NaCl+N2↑+2H2O。 (2)根据原子守恒可知生成的无色无污染的气体为N2,结合V由+5价降至+4价、N由-2价升至0价,根据得失电子守恒、原子守恒可写出ⅰ中的化学方程式。 (3)焙烧时,V2O3、生石灰与O2反应生成Ca(VO3)2,其化学方程式为CaO+O2+V2O3Ca(VO3)2。 (4)结合S2Cl2 与水反应时,有无色刺激性气味的气体和黄色沉淀生成,可知黄色沉淀为单质S,再由原子守恒可知生成的刺激性气味的气体为SO2和HCl,据此写出反应的化学方程式。 (5)通空气条件下,O2参与Au与NaCN溶液的反应,生成物Na[Au(CN)2]中Au为+1价,O2被还原为-2价的物质,则Au与O2的物质的量之比为4∶1,该反应为4Au+8NaCN+O2+2H2O===4Na[Au(CN)2]+4NaOH。根据用Zn还原Na[Au(CN)2]得到Au和Na2[Zn(CN)4],可写出该置换反应。 [答案] (1)N2H4+2NaClO===2NaCl+N2↑+2H2O (2)2V2O5+N2H4·2HCl+6HCl===4VOCl2+N2↑+6H2O (3)CaO+O2+V2O3Ca(VO3)2 (4)2S2Cl2+2H2O===3S↓+SO2↑+4HCl↑ (5)4Au+8NaCN+O2+2H2O===4Na[Au(CN)2]+4NaOH Zn+2Na[Au(CN)2]===2Au+Na2[Zn(CN)4] 题组二:陌生离子方程式的书写 2.(1)(2019·济南模拟)辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。取样品,加入酸性KMnO4溶液,加热(硫元素全部转化为SO),写出Cu2S溶于酸性KMnO4溶液的离子方程式_______________________________________。 (2)(2019·湖北八校联考)废水处理方法之一是用Cl2将废水中的CN-氧化成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5∶2,则该反应的离子方程式是_________________________。 (3)(2019·烟台模拟)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移8 mol电子。该反应的离子方程式是______________。 (4)(2019·湖南三湘联考)纳米CdSe(硒化镉)可用作光学材料。在一定条件下,由Na2SO3和Se(硒,与S为同族元素)反应生成Na2SeSO3(硒代硫酸钠);再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe纳米颗粒。研究表明,CdSe的生成分成两步:①SeSO在碱性条件下生成HSe-; ②HSe-与Cd2+反应生成CdSe。 完成第①步反应的离子方程式 SeSO+________===HSe-+________。写出第②步反应的离子方程式________________________________。 (5)(2019·重庆调研)亚硝酰氯遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。写出亚硝酰氯(ClNO)与H2O反应的离子方程式:___________________________________。 [解析] (1)由已知可知,酸性条件下,KMnO4可氧化Cu2S生成+2价的Cu和SO, MnO被还原为Mn2+,根据得失电子守恒、电荷守恒及原子守恒可得离子方程式为Cu2S+2MnO+8H+===2Cu2++SO+2Mn2++4H2O。 (2)CN-中C和N分别为+2价和-3价,结合氧化产物为CO2和N2,可知每个CN-失去5个电子,结合反应的Cl2与CN-的物质的量之比为5∶2,可知Cl2生成Cl-。 (3)Na2S2O3中硫元素为+2价,根据1 mol Na2S2O3参加反应转移8 mol电子,知S2O被氧化为SO;Cl2被还原为Cl-,根据得失电子守恒可确定S2O与Cl2的物质的量之比为1∶4,再结合原子守恒、电荷守恒写出离子方程式。 (4)SeSO在碱性条件下生成HSe-,即必须有OH-参与反应且Se由+2价降至-2价,则S由+2价升至+6价,另一产物为SO,其离子方程式为SeSO+OH-===HSe-+SO。HSe-与Cd2+反应生成CdSe,该反应在碱性条件下进行,其离子方程式为HSe-+Cd2++OH-===CdSe+H2O。 (5)根据题中信息可知ClNO与水反应生成的红棕色气体为NO2,则另一氧化物为NO,生成的氯化物为HCl,反应的离子方程式为2ClNO+H2O===2H++2Cl-+NO↑+NO2↑。 [答案] (1)Cu2S+2MnO+8H+===2Cu2++SO+2Mn2++4H2O (2)5Cl2+2CN-+4H2O===10Cl-+2CO2+N2+8H+ (3)S2O+4Cl2+5H2O===2SO+8Cl-+10H+ (4)OH- SO HSe-+Cd2++OH-===CdSe+H2O (5)2ClNO+H2O===2H++2Cl-+NO↑+NO2↑ 考点二 非氧化还原型陌生方程式的书写 非氧化还原反应涉及最多的为复分解反应,也会涉及无单质参与的化合反应、无单质生成的分解反应以及酸性物质(酸、酸性氧化物、酸式盐)与碱性物质(碱、碱性氧化物、碱式盐)的反应。在平时学习中体会这些化学反应发生的基本原理。相比较氧化还原方程式而言,难度较小。在书写和配平时用到更多的是原子守恒,其主要可分为以下几种情况: 1.广义的水解反应 广义的水解是指化合物中的正电性的原子或原子团与OH结合,负电性的原子或原子团与H结合形成两种新的物质。 2.酸(酸式盐)与碱可发生中和反应、强酸与弱酸盐可以反应。 3.铵盐、弱酸酸式盐、难溶氢氧化物、难溶碳酸盐受热易分解。 4.多元弱酸盐与其多元弱酸反应生成其酸式盐。 题组一:根据“广义”的水解书写方程式 1.(1)(2019·汉中一检)写出亚硫酰氯(SOCl2)在潮湿的空气中产生白雾的化学方程式:_______________________________。 (2)(2019·广东六校联考)一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应的化学方程式为___________________。 (3)(2019·吉林百校联盟联考)四氯化硅与烧碱溶液反应生成两种盐的化学方程式:_______________________________。 (4)(2019·江淮十校联考)一氯胺(NH2Cl)是一种重要的水消毒剂,写出产生消毒物质的化学方程式:___________________。 (5)(2019·泉州质检)常用尿素[CO(NH2)2]除去工业废 [答案] (1)SOCl2+H2O===SO2↑+2HCl↑ (2)CO(NH2)2+3H2O===CO2↑+2NH3·H2O (3)SiCl4+6NaOH===Na2SiO3+4NaCl+3H2O (4)NH2Cl+H2O===HClO+NH3 (5)2Cr3++3CO(NH2)2+9H2O===2Cr(OH)3↓+3CO2↑+6NH 题组二:根据中和原理或“较强酸制较弱酸”原理书写方程式 2.(1)(2019·烟台适应性练习)工业上可用盐酸处理铝硅酸盐,如正长石(KAlSi3O8)制取硅酸胶体。写出该反应的化学方程式:_____________________________________。 (2)(2019·滨州模拟)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 写出Mg2B2O5·H2O与硫酸反应的化学方程式_______。 (3)25℃,H2C2O4和HF两种酸的电离平衡常数如下: 则H2C2O4溶液和NaF溶液反应的离子方程式为______________________________________。 [答案] (1)KAlSi3O8+4HCl+H2O===KCl+AlCl3+3H2SiO3(胶体) (2)Mg2B2O5·H2O+2H2SO4===2MgSO4+2H3BO3 (3)H2C2O4+F-===HF+HC2O 题组三:根据对热稳定性的理解书写方程式 3.(1)“煅烧”偏钒酸铵(NH4VO3)可得到工业制硫酸的催化剂五氧化二钒(V2O5),写出该反应的化学方程式: _______________________________________。 (2)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4。写出该反应的化学方程式:_____________________________________。 [解析] (1)联想铵盐的不稳定性,类比NH4HCO3的分解。 (2)Li2FeSiO4可看作Li2SiO3·FeO,根据该化学式的特点,联想Na2CO3与SiO2的高温反应,FeC2O4受热分解生成FeO、CO和CO2即可写出总的方程式。 [答案] (1)2NH4VO3V2O5+2NH3↑+H2O↑ (2)Li2CO3+FeC2O4·2H2O+SiO2Li2FeSiO4+CO↑+2CO2↑+2H2O↑ 题组四:应用平衡转化思想书写方程式 4.(1)沉钴工艺流程如下图所示,请写出“沉钴”过程中的离子方程式:____________________________________。 (2)利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下: ①分解过程发生的反应为Na2SiF6+4NH3·H2O===2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为________。 ②水浴加热过程中生成冰晶石的化学方程式为 ________________________________。 [解析] (1)该反应的微观平衡移动过程如下: (2)①根据化学反应中原子守恒可得X的化学式。②根据流程信息和问题(1)反应中的产物可知,水浴加热过程中氟化钠、氟化铵与偏铝酸钠生成冰晶石沉淀和氨气逸出,促使平衡正向移动。 [答案] (1)Co2++2HCO===CoCO3↓+CO2↑+H2O (2)①SiO2 ②2NaF+4NH4F+NaAlO2Na3AlF6↓+4NH3↑+2H2O 考点三 陌生电极反应式的书写 1.原电池的电极反应都是自发氧化还原反应的半反应,其书写思路为: (1)负极反应先考虑还原剂失电子后的合理产物(碳元素酸性生成CO2、碱性以CO存在),然后考虑产物与电解质是否反应。 (2)正极反应则先考虑氧化剂得电子后的合理产物,然后考虑产物与电解质是否反应。 2.电解池中的阳极有最强的氧化能力,阴极有最强的还原能力,所以可以发生平常不能发生的一些氧化还原反应。电解液中氧化性的离子可以在阴极得电子,还原性离子则可以在阳极失电子。同时考虑得失电子产物与电解液可能发生的反应。 3.由于离子在电极上的放电顺序除了与离子氧化还原性有关外还与离子浓度等有关,所以有些电极反应需要结合题目的信息完成。 【典例2】 (2019·江苏卷节选)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如图。 (1)写出阴极CO2还原为HCOO-的电极反应式: _______________________________________。 (2)电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________________________。 [思路点拨] (1)分析CO2、HCOO-中C元素的价态,确定1 mol CO2在反应中得到的电子数。 (2)判断阴极附近溶液的酸碱性。 (3)根据元素守恒、电荷守恒,正确书写电极反应式。 [解析] (1)CO2中的C为+4价,HCO-中的C为+2价,1 mol CO2转化为HCOO-时,得2 mol e-。(2)阳极上水放电,生成O2和H+,H+会与HCO反应使HCO减少,由电荷平衡可知,K+会移向阴极区,所以KHCO3溶液浓度降低。 [答案] (1)CO2+H++2e-===HCOO-或CO2+HCO+2e-===HCOO-+CO (2)阳极产生O2,pH减小,HCO浓度降低;K+部分迁移至阴极区 题组一:原电池中陌生电极反应式的书写 1.(1)(2019·昆明质检)中科院研究人员将MnO2 和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为________________________________________。 (2)(2019·福州质检)如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图: 该电池的负极反应式为_________________________。 (3)(2019·惠州第三次调研)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质中自由移动。 请写出负极反应式________________________________。 (4)(2019·武昌调研)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。 请写出该电池的正极反应式:_____________________。 [解析] (1)结合题图知,b极上葡萄糖失电子转化为C6H10O6,电极反应式为:C6H12O6-2e-===C6H10O6+2H+。 (2)燃料电池均是可燃物做负极,失电子,发生氧化反应,根据交换膜为质子交换膜可知电解质为酸性电解质,故负极产物为CO2和H+。 (3)结合图示可知,多孔电极a和b分别为负极和正极,CO在负极发生氧化反应,电极反应式为CO+O2--2e-===CO2。 (4)根据氧化还原反应原理,首先确定N2在反应中作氧化剂,因而参与正极反应,再根据盐酸介质知产物应该为NH,从电子守恒和电荷守恒及原子守恒三个角度可以确定其电极反应式。 [答案] (1)C6H12O6-2e-===C6H10O6+2H+ (2)CH3OCH3+3H2O-12e-===2CO2+12H+ (3)CO+O2--2e-===CO2 (4)N2+6e-+8H+===2NH 题组二:电解池中陌生电极反应式的书写 2.(1)(2019·济南模拟)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0查看更多
相关文章
- 当前文档收益归属上传用户