- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高中化学 课时跟踪训练(三)纯碱的生产 新人教版选修2
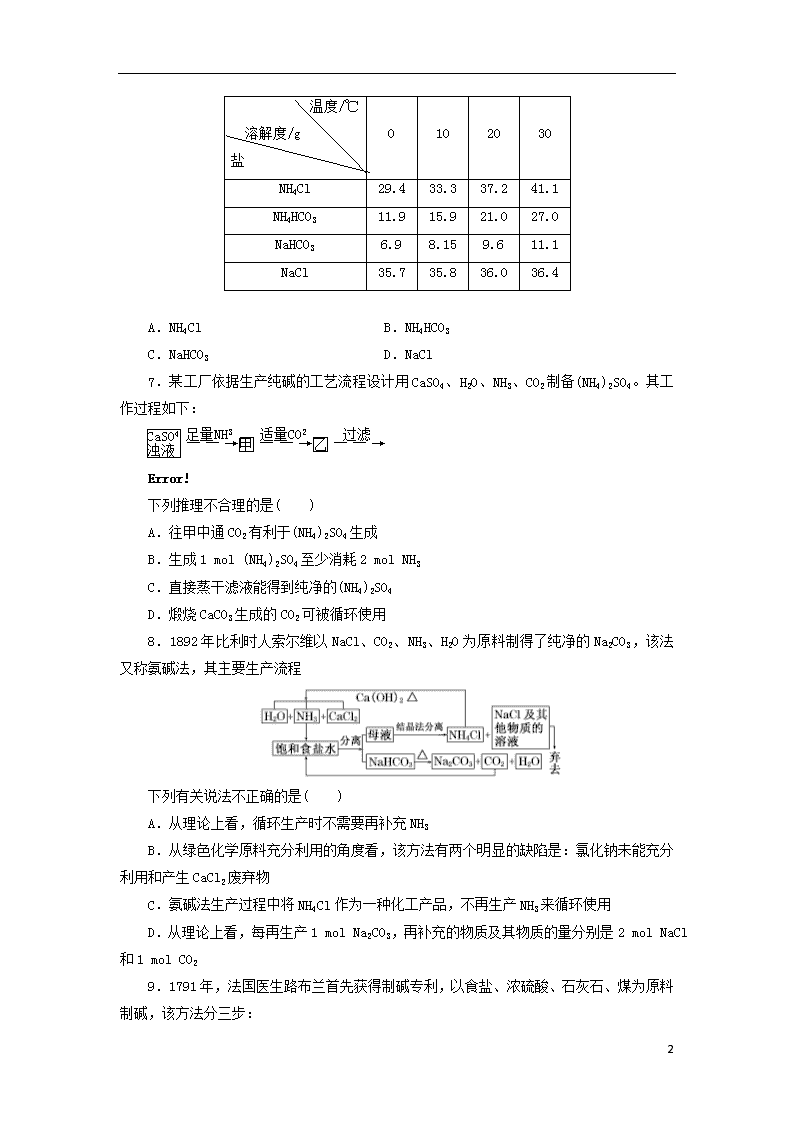
课时跟踪训练(三) 纯碱的生产 一、选择题(本题包括10小题,每小题5分,共50分) 1.我国著名的化工专家侯德榜在20世纪20年代所创立的“侯氏制碱法”誉满全球。“侯氏制碱法”中的碱是指下列的( ) A.NaOH B.K2CO3 C.Na2CO3 D.NaHCO3 2.下列属于侯氏制碱法的优点的是( ) A.氨和二氧化碳由合成氨厂提供 B.母液可回收制氯化铵 C.氯化钠的利用率达96% D.以上全是 3.下列说法不正确的是( ) A.“联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应 NH3+CO2+NaCl+H2O===NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+H2O↑+CO2↑ B.“联合制碱法”生产中有氨的循环利用工艺 C.“氨碱法”生产中有氨的循环利用工艺 D.“联合制碱法”和“氨碱法”都有一定的局限性 4.工业上常用氨碱法制取碳酸钠(将氨气和二氧化碳先后通入饱和食盐水而析出小苏打,再经过滤、焙烧而得到纯碱),但却不能用氨碱法制碳酸钾,这是因为在溶液中( ) A.KHCO3溶解度较大 B.KHCO3溶解度较小 C.K2CO3溶解度较大 D.K2CO3溶解度较小 5.下列说法中不正确的是( ) A.用联合制碱法制造纯碱和氯化铵,原料的利用率高,不必考虑环境保护的问题 B.化工生产技术始终是在不断创新中发展,侯氏制碱法也还需要改进 C.社会对纯碱的需求是纯碱生产技术创新发展的原动力 D.纯碱生产技术的再创新需要多门学科、多种技术的协同作用 6.工业上将相同物质的量的NaCl、CO2、NH3在30 ℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( ) 8 温度/℃ 溶解度/g 盐 0 10 20 30 NH4Cl 29.4 33.3 37.2 41.1 NH4HCO3 11.9 15.9 21.0 27.0 NaHCO3 6.9 8.15 9.6 11.1 NaCl 35.7 35.8 36.0 36.4 A.NH4Cl B.NH4HCO3 C.NaHCO3 D.NaCl 7.某工厂依据生产纯碱的工艺流程设计用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工作过程如下: 下列推理不合理的是( ) A.往甲中通CO2有利于(NH4)2SO4生成 B.生成1 mol (NH4)2SO4至少消耗2 mol NH3 C.直接蒸干滤液能得到纯净的(NH4)2SO4 D.煅烧CaCO3生成的CO2可被循环使用 8.1892年比利时人索尔维以NaCl、CO2、NH3、H2O为原料制得了纯净的Na2CO3,该法又称氨碱法,其主要生产流程 下列有关说法不正确的是( ) A.从理论上看,循环生产时不需要再补充NH3 B.从绿色化学原料充分利用的角度看,该方法有两个明显的缺陷是:氯化钠未能充分利用和产生CaCl2废弃物 C.氨碱法生产过程中将NH4Cl作为一种化工产品,不再生产NH3来循环使用 D.从理论上看,每再生产1 mol Na2CO3,再补充的物质及其物质的量分别是2 mol NaCl和1 mol CO2 9.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步: 8 ①用NaCl与H2SO4反应制Na2SO4: 2NaCl+H2SO4Na2SO4+2HCl↑ ②用焦炭还原Na2SO4制Na2S: Na2SO4+4CNa2S+4CO↑ ③用硫化钠与石灰石反应制Na2CO3: Na2S+CaCO3Na2CO3+CaS 下列说法正确的是( ) A.②③两步都是氧化还原反应 B.只有第②步是氧化还原反应 C.该方法对生产设备基本没有腐蚀 D.该方法对环境污染较小 10.反应NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl是“氨碱法”的重要化学反应,以下是对该反应涉及的有关知识的部分见解,其中不正确的是( ) A.该条件下NaHCO3的溶解度较小 B.NaHCO3不是纯碱 C.析出固体后的溶液为NaHCO3的不饱和溶液 D.析出固体后的溶液为NaHCO3的饱和溶液 二、非选择题(本题包括4小题,共50分) 11.(12分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题: (1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________________________________________________________________________。 (2)写出“联合制碱法”有关反应的化学方程式: ________________________________________________________________________; ________________________________________________________________________。 (3)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=__________________。 12.(12分)侯氏制碱法原理是:将NH3和CO2气体通入饱和食盐水中即可获得NaHCO3和NH4Cl的混合物,然后分离出NaHCO3再加热制得纯碱。其流程如下: 8 参照下表: 物质 CO2 NH3 NaHCO3 NH4Cl NaCl 溶解度(20 ℃) V水∶V二氧化碳=1∶1 V水∶V氨气=1∶700 9.6 g 37.2 g a g 回答下列问题: (1)气体A、B依次是________。 A.CO2、NH3 B.NH3、CO2 C.任何顺序都可以 (2)写出(Ⅰ)和(Ⅱ)步骤总反应的化学方程式____________________________________ ________________________________________________________________________。 由反应原理可知,a________9.6(填“<”、“>”或“=”)。 (3)操作(Ⅲ)的名称是________,化学实验室进行该操作用到的玻璃仪器有________________。 (4)经步骤(Ⅲ)所得液体中含有的盐为(写化学式)________。经过________(填操作名称)后可以得到化肥。 (5)每当通入NH3 44.8 L(标准状况下)时可以得到纯碱100.0 g,则NH3的利用率为________。 13.(12分)根据侯德榜制碱原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35 ℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质后转入蒸发皿中,灼烧2小时,制得Na2CO3固体。四种盐在不同温度下的溶解度表(g/100 g水) 盐 溶解度 温度/℃ NaCl NH4HCO3 NaHCO3 NH4Cl 8 0 35.7 11.9 6.9 29.4 10 35.8 15.8 8.1 33.3 20 36.0 21.0 9.6 37.2 30 36.3 27.0 11.1 41.4 40 36.6 -① 12.7 45.8 50 37.0 - 14.5 50.4 60 37.3 - 16.4 55.3 100 39.8 - - 77.3 注:①>35℃ NH4HCO3会分解。请回答: (1)反应温度控制在30~35 ℃,是因为若高于35 ℃,则____________,若低于30 ℃,则______________;为控制此温度范围,采取的加热方法为_________________________。 (2)加料完毕后,继续保温30分钟,目的是___________________________________。静置后只析出NaHCO3晶体的原因是______________________________________________。 用蒸馏水洗涤NaHCO3晶体的目的是除去____________________________杂质(用化学式表示)。 (3)过滤所得的母液中含有______________________(用化学式表示),需加入________,并做进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。 14.(14分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下: (1)上述生产纯碱的方法称________,副产品的一种用途为________。 (2)沉淀池中发生的化学反应方程式是________________________________________ ________________________________________________________________________。 (3)写出上述流程中X物质的化学式是________。 (4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________________________________。 (5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。 (6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有________________________________________________________________________ ________________________________________________________________________。 a.增大NH的浓度,使NH4Cl更多地析出 8 b.使NaHCO3更多地析出 c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 答 案 1.选C 本题中的碱指的是纯碱Na2CO3。 2.选D 侯氏制碱法的优点有原料易得,NaCl的利用率高,而且产生的NH4Cl可以作肥料。 3.选B “氨碱法”将NH4Cl和Ca(OH)2再反应,使NH3循环利用;“联合制碱法”是制得纯碱和副产品氯化铵。 4.选A 氨碱法制取Na2CO3的原理是,在精制的食盐水中分别通入NH3、CO2,由于NaHCO3溶解度不大,当Na+、HCO浓度较大时便析出NaHCO3晶体,将过滤得到的NaHCO3煅烧得Na2CO3,由于KHCO3溶解度较大,无法从溶液中析出,故无法利用其分解制取K2CO3。 5.选A 化工生产一般都会产生污染物,要科学地评价纯碱生产技术及其他化工生产技术,环境保护也需考虑。 6.选C 据表中数据可知,随温度的降低,NaHCO3的溶解度始终最小,故首先析出的物质应是NaHCO3。 7.选C 观察流程图可知,甲中已通入了足量的NH3,往甲中通CO2的目的是与NH3反应生成(NH4)2CO3,从而有利于(NH4)2SO4的生成,A、B正确;煅烧生成的CO2可以通入甲中循环使用,D正确。 8.选C 工业制碱的原理涉及反应:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O↑。索尔维法用生成的氯化铵制备氨气,将氯化铵进行了循环利用,所以从理论上讲,是不需要补充氨的。但是在生产过程中,NaCl母液被弃去,氯化铵制备氨气生成了无用的氯化钙,这两点是索尔维法的缺陷。根据反应关系式及原子守恒,从理论上看每生产1 mol Na2CO3,需再补充的物质及其物质的量分别是2 mol NaCl和1 mol CO2。 9.选B 氧化还原反应是有元素化合价变化的反应,第③步反应无化合价变化,不是氧化还原反应,A不正确;该生产中产生HCl,对设备严重腐蚀;第②步反应生成的CO是大气污染物,故C、D不正确。 10.选C 该条件下NaHCO3的溶解度不大,因此析出NaHCO3,析出后应为NaHCO3的饱和溶液。 11.解析:(3)联合制碱法反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+H2O↑+CO2↑,总反应可看作是2NH3+2NaCl+CO2+H 8 2O===Na2CO3+2NH4Cl,所以,原子利用率(%)=×100%=×100%。 答案:(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O (2)NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+CO2↑+H2O↑ (3)×100% 12.解析:(1)氨气在水溶液中溶解度大,故侯氏制碱法中先向饱和食盐水中通入NH3,后通入CO2。 (2)由反应原理:饱和食盐水中析出NaHCO3沉淀,故同温下NaCl的溶解度大于NaHCO3的溶解度,a>9.6。 (5)由反应转化关系:NH3~NaCl~Na2CO3,当得到100.0 g纯碱时,消耗NH3为×2=1.887 mol,则NH3的利用率为×100%=94.34%。 答案:(1)B (2)NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl > (3)过滤 烧杯、漏斗、玻璃棒 (4)NaHCO3、NH4Cl(NaCl写与不写均可) 结晶 (5)94.34% 13.解析:(1)温度超过35 ℃,NH4HCO3会分解,反应速率受温度的影响,温度低,反应速率慢,此温度下,用水浴加热较为好控制。 (2)反应需要保持一段时间,使其反应充分。NaHCO3晶体表面会附着未反应完的NaCl、NH4HCO3及生成的NH4Cl等,需水洗除去。 (3)加入盐酸可使NaHCO3转化为NaCl,也可使NH4HCO3转化为NH4Cl。 答案:(1)NH4HCO3分解 反应速率降低 水浴加热 (2)使反应充分进行 NaHCO3的溶解度最小 NaCl、NH4Cl、NH4HCO3 (3)NaHCO3、NaCl、NH4Cl、NH4HCO3 HCl 14.解析:(1)、(2)两问题为识记性题目。(3)需要在理解原理的基础上作出回答。(4)原料利用率和基本实验操作的考查。“循环操作”是提高原料利用率、解决环境污染等问题的关键思想。过滤是初中就要求掌握的基本操作。(5)本问题是Cl- 8 的检验,这是中学常见离子的检验。(6)实际是平衡理论的具体应用。 答案:(1)联合制碱法或侯氏制碱法 制化肥或作电解液等(其他合理答案均可) (2)NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓ (3)CO2 (4)Ⅰ 过滤 (5)稀硝酸和硝酸银溶液 (6)ac 8查看更多