- 2021-07-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版新高考地区选考化学(人教版)一轮复习教师用书:小专题突破7 隔膜在电化学中的功能
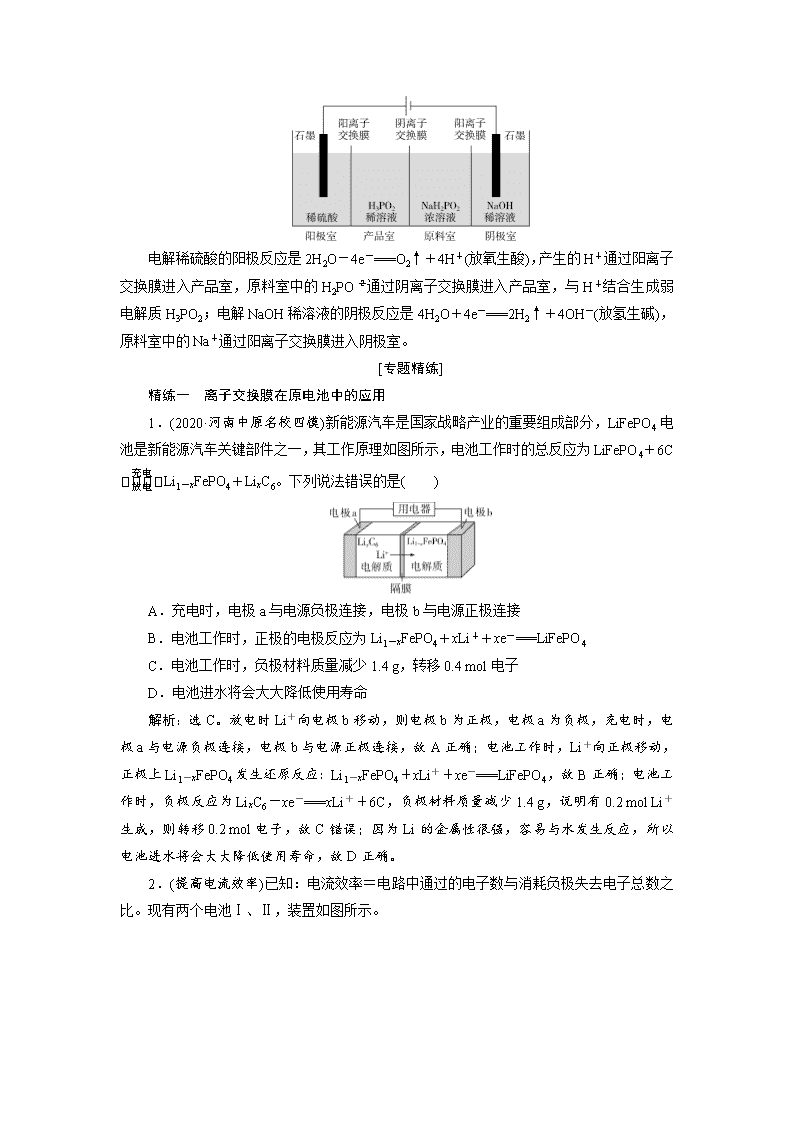
小专题突破7 隔膜在电化学中的功能 ——证据推理与模型认知 [专题精讲] 1.常见的隔膜 隔膜又叫离子交换膜,由高分子特殊材料制成。离子交换膜分三类: (1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子通过。 (2)阴离子交换膜,简称阴膜,只允许阴离子通过,既允许OH-和其他阴离子通过,不允许阳离子通过。 (3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。 2.隔膜的作用 (1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。 (2)能选择性地允许离子通过,起到平衡电荷、形成闭合回路的作用。 3.离子交换膜的选择依据 离子的定向移动。 4.离子交换膜的应用 5.多室电解池的类型 多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室等,以达到浓缩、净化、提纯以及电化学合成的目的。 (1)两室电解池 以惰性电极电解一定浓度的Na2CO3溶液为例,其原理如图所示: ①电极名称的判断:根据“阴阳相吸”判断,Na+移向的乙电极是阴极;根据“阳极放氧生酸”判断,左侧有氧气生成的甲电极是阳极。 ②电极反应式的书写:右侧阴极区电解液为稀氢氧化钠溶液,根据“阴极放氢生碱”, 得4H2O+4e-===2H2↑+4OH-,A为氢气;左侧阳极区电解液为碳酸钠溶液,根据“阳极放氧生酸”,得H+会与CO结合生成HCO:4CO-4e-+2H2O===4HCO+O2↑。 (1)含离子交换膜的电解池的最大优点是能自动把产品(如该电解池产生的NaOH和NaHCO3)分离开,从而降低分离提纯成本。 (2)“阴阳相吸”是很多化学反应的微观基础。“阴阳相吸”的含义:①阴离子与阳离子相互吸引并发生迁移;②阴极吸引电解液中的阳离子,阳极吸引电解液中的阴离子,并使阳离子与阴离子发生定向移动;③正极吸引自由电子,使电子经过金属导线由负极定向移动到正极。 (2)三室电解池 以三室式电渗析法处理含KNO3的废水得到KOH和HNO3为例,其原理如图所示: ①阴极反应及ab膜的判断:阴极的电极反应是4H2O+4e-===2H2↑+4OH-(放氢生碱),生成的带负电荷的OH-吸引中间隔室的K+向阴极迁移,得到KOH溶液,阴极区溶液的pH增大,ab膜为阳离子交换膜。 ②阳极反应及cd膜的判断:阳极的电极反应是2H2O-4e-===O2↑+4H+(放氧生酸),生成的带正电荷的H+吸引中间隔室的NO向阳极迁移,得到HNO3溶液,阳极区溶液的pH减小,cd膜为阴离子交换膜。 虽然其实质是电解水,但总反应不能写成2H2O2H2↑+O2↑,而应该写为4KNO3+6H2O2H2↑+4KOH+O2↑+4HNO3。 (3)四室电解池 以四室式电渗析法制备H3PO2(次磷酸)为例,其工作原理如图所示: 电解稀硫酸的阳极反应是2H2O-4e-===O2↑+4H+(放氧生酸),产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO通过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应是4H2O+4e-===2H2↑+4OH-(放氢生碱),原料室中的Na+通过阳离子交换膜进入阴极室。 [专题精练] 精练一 离子交换膜在原电池中的应用 1.(2020·河南中原名校四模)新能源汽车是国家战略产业的重要组成部分,LiFePO4电池是新能源汽车关键部件之一,其工作原理如图所示,电池工作时的总反应为LiFePO4+6CLi1-xFePO4+LixC6。下列说法错误的是( ) A.充电时,电极a与电源负极连接,电极b与电源正极连接 B.电池工作时,正极的电极反应为Li1-xFePO4+xLi++xe-===LiFePO4 C.电池工作时,负极材料质量减少1.4 g,转移0.4 mol电子 D.电池进水将会大大降低使用寿命 解析:选C。放电时Li+向电极b移动,则电极b为正极,电极a为负极,充电时,电极a与电源负极连接,电极b与电源正极连接,故A正确;电池工作时,Li+向正极移动,正极上Li1-xFePO4发生还原反应:Li1-xFePO4+xLi++xe-===LiFePO4,故B正确;电池工作时,负极反应为LixC6-xe-===xLi++6C,负极材料质量减少1.4 g,说明有0.2 mol Li+生成,则转移0.2 mol电子,故C错误;因为Li的金属性很强,容易与水发生反应,所以电池进水将会大大降低使用寿命,故D正确。 2.(提高电流效率)已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。 下列说法正确的是( ) A.Ⅰ和Ⅱ的电池反应不同 B.Ⅰ和Ⅱ的能量转化形式不同 C.Ⅰ的电流效率低于Ⅱ的电流效率 D.放电一段时间后,Ⅰ、Ⅱ中都只含1种溶质 解析:选C。Ⅰ、Ⅱ装置中电极材料相同,电解质溶液部分相同,电池总反应、负极反应和正极反应均相同,A项错误。Ⅰ和Ⅱ装置的能量转化形式都是化学能转化成电能,B项错误。Ⅰ装置中铜与氯化铁溶液直接接触,二者会在铜极表面发生反应,导致部分能量损失(或部分电子没有通过电路),导致电流效率降低;而Ⅱ装置采用阴离子交换膜,铜不与氯化铁溶液直接接触,二者不会在铜极表面发生反应,放电过程中交换膜左侧负极的电极反应式为Cu-2e-===Cu2+,阳离子增多;右侧正极的电极反应式为2Fe3++2e-===2Fe2+,负电荷过剩,Cl-从交换膜右侧向左侧迁移,电流效率高于Ⅰ装置,C项正确。放电一段时间后,Ⅰ装置中生成氯化铜和氯化亚铁,Ⅱ装置中交换膜左侧生成氯化铜,右侧生成氯化亚铁,两者还都可能含有氯化铁,D项错误。 精练二 离子交换膜在电解池中的应用 3.(双选)(净化水质)世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是( ) A.X为电源负极 B.若该装置在高温下进行,则净化效率将降低 C.若有1 mol NO被还原,则有6 mol H+通过质子膜迁移至阴极区 D.若BOD为葡萄糖(C6H12O6),则1 mol葡萄糖被完全氧化时,理论上电极上流出24 mol e- 解析:选BD。由装置图可知,X端连接的电极上发生的反应是在微生物作用下BOD、H2O反应生成CO2;Y端连接的电极上发生的反应是在微生物作用下NO反应生成N2, 氮元素化合价降低,发生还原反应,为电解池的阴极,则Y为电源负极,X为电源正极,质子膜允许H+通过。A.由上述分析可知,X为电源正极,故A错误;B.若 该装置在高温下进行,作为催化剂的微生物会失去活性,则净化效率将降低,故B正确;C.根据阴极的电极反应式2NO+10e-+12H+===N2↑+6H2O可知,若有1 mol NO被还原,转移5 mol电子,根据电荷守恒,则有5 mol H+通过质子膜迁移至阴极区,故C错误;D.若 BOD为葡萄糖(C6H12O6),则1 mol葡萄糖被完全氧化时,碳元素化合价由0价变为+4价,理论上电极上流出4×6 mol=24 mol e-,故D正确。 4.(限制某些离子的迁移)用一种阴、阳离子双隔膜三室电解槽处理废水中的NH,模拟装置如图所示。下列说法正确的是( ) A.阳极室溶液由无色变成棕黄色 B.阴极的电极反应式为4OH--4e-===2H2O+O2↑ C.电解一段时间后,阴极室溶液的pH升高 D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 解析:选C。阳极上Fe发生氧化反应生成Fe2+,溶液由无色变为浅绿色,A项错误;阴极上H+发生还原反应:2H++2e-===H2↑,电解一段时间后,阴极室溶液的pH升高,NH透过阳离子选择透过膜进入阴极室,阴极室溶液中的溶质可能有H3PO4、NH4H2PO4、(NH4)2HPO4、(NH4)3PO4等,B、D项错误,C项正确。 5.(海水淡化)(2020·武汉高三调研)电渗析法淡化海水装置如图所示,电解槽中阴离子交换膜和阳离子交换膜交替排列,将电解槽分隔成多个独立的间隔室,海水充满各个间隔室。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水的分离。下列说法正确的是( ) A.离子交换膜b为阳离子交换膜 B.①③⑤⑦间隔室的排出液为淡水 C.通电时,电极1附近溶液的pH比电极2附近溶液的pH变化明显 D.淡化过程中,得到的浓缩海水没有任何使用价值 解析:选B。电极2上H+→H2,所以电极2为阴极,电极1为阳极,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过,Na+需通过阳离子交换膜向电极2移动,则离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜,A项错误;①③⑤⑦中的阴、阳离子分别透过阴、阳离子交换膜移向相邻间隔室,海水被淡化,而相邻间隔室②④⑥中的海水被浓缩,B项正确;电极1上Cl-放电生成Cl2,电极2上H+放电生成H2,故电极2附近溶液的pH变化明显,C项错误;浓缩海水中含有很丰富的元素,有很大的使用价值,D项错误。 在电解池中使用选择性离子交换膜的主要目的是限制某些离子(或分子)的定向移动,避免电解质溶液中的离子或分子与电极产物反应,提高产品纯度或防止造成危险等。查看更多