- 2021-07-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年陕西省黄陵中学高二(普通班)上学期期中考试化学试题 Word版
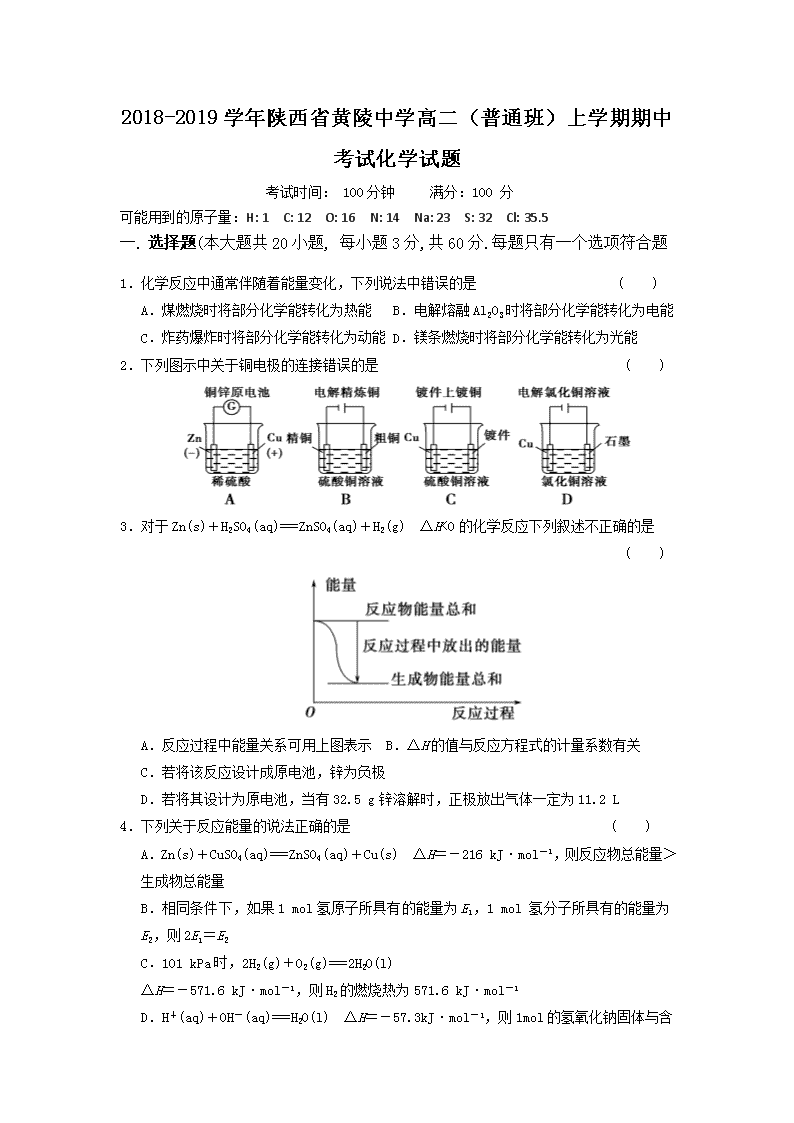
2018-2019学年陕西省黄陵中学高二(普通班)上学期期中考试化学试题 考试时间: 100分钟 满分:100 分 可能用到的原子量:H: 1 C: 12 O: 16 N: 14 Na: 23 S: 32 Cl: 35.5 一. 选择题(本大题共20小题, 每小题3分,共60分.每题只有一个选项符合题 1.化学反应中通常伴随着能量变化,下列说法中错误的是 ( ) A.煤燃烧时将部分化学能转化为热能 B.电解熔融Al2O3时将部分化学能转化为电能 C.炸药爆炸时将部分化学能转化为动能 D.镁条燃烧时将部分化学能转化为光能 2.下列图示中关于铜电极的连接错误的是 ( ) 3.对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是 ( ) A.反应过程中能量关系可用上图表示 B.ΔH的值与反应方程式的计量系数有关 C.若将该反应设计成原电池,锌为负极 D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L 4.下列关于反应能量的说法正确的是 ( ) A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量 B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 C.101 kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1 D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol的氢氧化钠固体与含0.5 mol H2SO4的溶液混合后放出57.3 kJ的热量 5.把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是 ( ) A.H2 B.Ag C.Cl2 D.O2 6.25 ℃、101 kPa 下:①2Na(s)+O2(g)===Na2O(s) ΔH1=-414 kJ·mol-1 ②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ·mol-1 下列说法正确的是 ( ) A.①和②产物的阴阳离子个数比不相等 B.①和②生成等物质的量的产物,转移电子数不同 C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ·mol-1 7.利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是 ( ) A.铝罐将逐渐被腐蚀 B.碳棒上发生的反应为:O2+4e-===2O2- C.碳棒应与玩具电机的负极相连 D.该电池工作一段时间后碳棒的质量会减轻 8.如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( ) A.两个装置之间没有盐桥,故不能形成电流 B.a电极的电极反应式C2H5OH+16OH--12e-===2CO32-+11H2O C.一段时间后,乙池d电极周围的溶液呈现棕褐色 D.乙池在反应前后溶液的pH不变 9.在2 L的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·L-1·s-1,则10 s时,容器中B的物质的量是 ( )。 A.3.4 mol B.3.2 mol C.2.8 mol D.1.2 mol 10.金属锡的冶炼常用焦炭作还原剂:SnO2+2C===Sn+2CO↑,反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法中正确的是 ( )。 A.ΔH<0 ΔS<0 B.ΔH>0 ΔS<0 C.ΔH<0 ΔS>0 D.ΔH>0 ΔS>0 11.下列关于化学反应限度的说法中正确的是( ) A.改变外界条件不能改变化学反应的限度 B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态 C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度 D.当某反应达到限度时,反应物和生成物的浓度一定相等 12.在紫外线的作用下,氧气可生成臭氧:3O22O3,一定条件下该反应达到平衡状态的标志是 ( )。 A.单位时间内生成2 mol O3,同时消耗3 mol O2 B.O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1 C.容器内,2种气体O3、O2浓度相等 D.容积中各组分的体积分数随时间变化 13.当反应:Cl2(g)+S(g)SCl2(g)达到平衡后,若将容器体积缩小,则此时反应速率的变化情况是 ( )。 14.25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb 2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是 ( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 D.25 ℃时,该反应的平衡常数K=2.2 15.将一定质量的Ag2SO4固体置于容积不变的密闭容器中(加入少量V2O5),在200 ℃时发生下列反应:Ag2SO4(s)Ag2O(s)+SO3(g) ΔH>0。10 min时反应达到平衡,此时c(SO3)为0.4 mol·L-1,则下列叙述中不正确的是 ( )。 A.200 ℃时,该反应的平衡常数K=0.4 B.增加Ag2SO4固体的质量,Ag2SO4分解速率会增大 C.若在300 ℃时反应,10 min后SO3的浓度会大于0.4 mol·L-1 D.0~10 min,逆反应速率不断增大 16.在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如右图所示。下列说法不正确的是 ( ) A.由图可知:T1>T2 B.a、b两点的反应速率:b>a C.为了提高Br2(g)的转化率,可采取将HBr液化并及时 移走的方法 D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 17.某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是 ( ) A.该反应为放热反应 B.催化剂能改变该反应的焓变 C.催化剂能降低该反应的活化能 D.逆反应的活化能大于正反应的活化能 18.对于一个特定反应的焓变(ΔH),下列说法错误的是( ) A.与反应方程式的书写有关 B.与反应物和生成物的能量有关 C.与反应物和生成物的化学键有关 D.与是否使用催化剂有关 19.(2012·福建师大附中期中)下列反应的能量变化与其他三项不相同的是( ) A.铝粉与氧化铁的反应 B.氯化铵与消石灰的反应 C.锌片与稀硫酸反应 D.钠与冷水反应 20.热化学方程式:C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3kJ/mol和H(g)+H(g)===H2(g) ΔH=-435.7kJ/mol表示( ) A.氢原子的能量比氢分子的能量低 B.一个氢原子与一个氢原子结合生成1个氢分子,且放出435.7kJ的能量 C.1mol固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.固态碳和液态水反应生成一氧化碳气体和氢气吸收131.3kJ能量 二、非选择题(本题包括6个小题,共40分) 21.(10分)煤燃烧的反应热可通过以下两种途径来利用: a.利用煤在充足的空气中直接燃烧产生的反应热; b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。 这两个过程的热化学方程式为: a.C(s)+O2(g)===CO2(g) ΔH=E1① b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2② H2(g)+O2(g)===H2O(g) ΔH=E3③ CO(g)+O2(g)===CO2(g) ΔH=E4④ 请回答: (1)与途径a相比,途径b有较多的优点,即________________________________________ ___________________________________________________________________________。 (2)上述四个热化学方程式中的哪个反应ΔH>0?______。 (3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是________。 A.a比b多 B.a比b少 C.a与b在理论上相同 (4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_________________________________。 22.(10分)根据下列叙述写出相应的热化学方程式: (1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________________________________________________________。 (2)下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________________________ (3)拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2完全反应生成NH3的反应热为________,1 mol H2完全反应生成NH3所放出的热量为________。 23.(10分)现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则: (1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。 (2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。 (3)若加入B(体积不变),则A的转化率________,B的转化率________。 (4)若升高温度,则平衡时,B、C的浓度之比将________。 (5)若加入催化剂,平衡时气体混合物的总物质的量________。 (6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。 24.(10分)高炉炼铁过程中发生的主要反应为:Fe2O3(s)+CO(g)=Fe(s)+CO2(g) 已知该反应在不同温度下的平衡常数如下: 温度/℃ 1 000 1 150 1 300 平衡常数 4.0 3.7 3.5 请回答下列问题: (1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”); (2)在一个容积为10 L的密闭容器中, 1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=________; (3)欲提高(2)中CO的平衡转化率,可采取的措施是________。 A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的体积 F.加入合适的催化剂 化学答案 一.选择题1---5 BCDAD 6---10 DABCD 11---15 BBDDB 16- --20 DCDBC 二.非选择题 21.答案 (1)煤的利用率高;变成气体后,燃烧充分,运输方便等 (2)反应② (3)C (4)E1=E2+E3+E4 22.答案 (1)S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1 (2)2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ·mol-1 (3) -92 kJ·mol-1 30.7 kJ 23.答案 (1)放 > (2)增大 减小 (3)增大 减小 (4)减小 (5)不变 (6)变深 变浅 24.答案 (1) < (2)0.006 mol·L-1·min-1 60% (3)C查看更多