- 2021-07-06 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【推荐】专题3-4+难溶电解质的溶解平衡-试题君之K三关2017-2018学年高二化学人教版
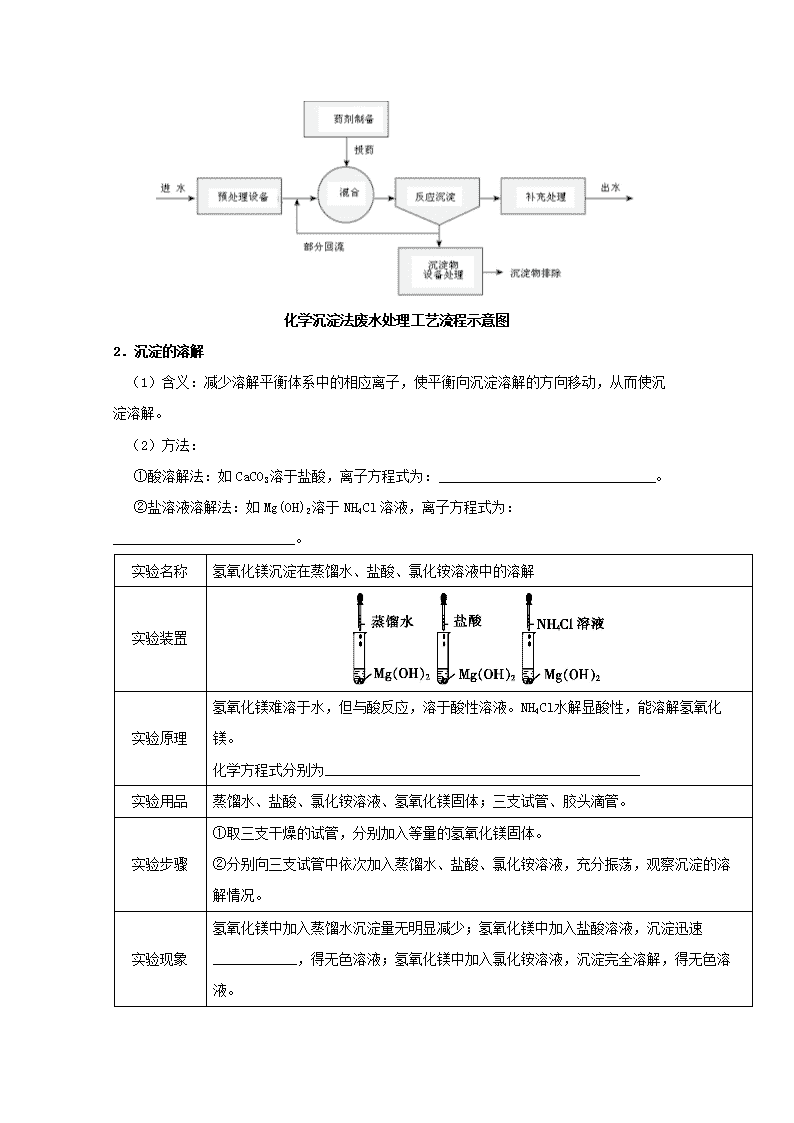
第四节 难溶电解质的溶解平衡 一、溶解平衡 1.溶解平衡 (1)概念:在一定温度下,当沉淀_______和_______的速率相等时,即达到溶解平衡。 (2)表达式(以AgCl为例)_____________________。 2.生成难溶电解质的离子反应的限度 (1)25℃时,溶解性与溶解度的关系。 溶解性 易溶 可溶 微溶 难溶 溶解度 >10 g 110 g 0.011 g <0.01 g (2)反应完全的标志。 对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于__________时,反应就达完全。 二、沉淀反应的应用 1.沉淀的生成 (1)应用:可利用生成沉淀来达到_________________的目的。 (2)条件: ①生成沉淀的反应能够发生; ②生成沉淀的反应进行得越完全越好: (3)方法: 方法 实例 加入试剂 发生反应的离子方程式 调节pH法 除去NH4Cl溶液中的Fe3+ ____ ___________________________ 沉淀剂法 除去污水中的重金属离子 ____ H2S+Cu2+CuS↓+2H+ 化学沉淀法废水处理工艺流程示意图 2.沉淀的溶解 (1)含义:减少溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,从而使沉淀溶解。 (2)方法: ①酸溶解法:如CaCO3溶于盐酸,离子方程式为:_______________________________。 ②盐溶液溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式为:__________________________。 实验名称 氢氧化镁沉淀在蒸馏水、盐酸、氯化铵溶液中的溶解 实验装置 实验原理 氢氧化镁难溶于水,但与酸反应,溶于酸性溶液。NH4Cl水解显酸性,能溶解氢氧化镁。 化学方程式分别为_____________________________________________ 实验用品 蒸馏水、盐酸、氯化铵溶液、氢氧化镁固体;三支试管、胶头滴管。 实验步骤 ①取三支干燥的试管,分别加入等量的氢氧化镁固体。 ②分别向三支试管中依次加入蒸馏水、盐酸、氯化铵溶液,充分振荡,观察沉淀的溶解情况。 实验现象 氢氧化镁中加入蒸馏水沉淀量无明显减少;氢氧化镁中加入盐酸溶液,沉淀迅速____________,得无色溶液;氢氧化镁中加入氯化铵溶液,沉淀完全溶解,得无色溶液。 实验结论 ①氢氧化镁溶于酸和酸性溶液。在含有难溶物氢氧化镁的溶液中存在溶解平衡,加入酸或酸性溶液能促进沉淀的溶解。 ②加入能与沉淀溶解所产生的离子发生反应的试剂,生成挥发性物质或弱电解质而使溶解平衡向溶解的方向移动。 3.沉淀的转化 (1)含义:由一种难溶物转化为另一种难溶物的过程。 (2)实质:_____________________________的移动。(沉淀的溶解度差别______,越容易转化) (3)应用:_______、_______等。 实验名称 氯化银、碘化银、硫化银沉淀的转化 实验装置 实验原理 ______________________________ 实验用品 0.1 mol/L AgNO3溶液、0.1 mol/L NaCl溶液、0.1 mol/L KI溶液、0.1 mol/L Na2S溶液;试管、胶头滴管。 实验步骤 ①向盛有10滴0.1 mol/L AgNO3溶液试管中滴加0.1 mol/L NaCl溶液,至不再有百色沉淀生成。 ②向上述固液混合物中滴加适量0.1 mol/L KI溶液,直到沉淀颜色不再改变为止,观察并记录现象。 ③向上支试管中滴加0.1 mol/L Na2S溶液,直到到沉淀颜色不再改变为止,观察并记录现象。 实验现象 ①NaCl溶液和AgNO3溶液混合产生白色沉淀。 ②向所得固液混合物中滴加KI溶液,沉淀颜色逐渐变成黄色。 ③再向所得固液混合物中滴加Na2S溶液,沉淀颜色逐渐变成黑色。 实验结论 ①溶解度由大到小的顺序为:_________________________________________ [或Ksp(AgCl)>Ksp(AgI),因沉淀类型不同通常不能比较Ksp(AgCl)、Ksp(AgI)与 Ksp(Ag2S)的大小]。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。 实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如Ag+)不能过量。 实验名称 氢氧化镁、氢氧化铁沉淀的转化 实验装置 实验用品 0.1 mol/L MgCl2溶液、0.1 mol/L FeCl3溶液、2 mol/L NaOH溶液;试管、量筒、胶头滴管 实验步骤 向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1〜2滴2 mol/L NaOH溶液,再滴加2滴 0.1 mol/L FeCl3溶液,静置,观察并记录现象。 实验现象 MgCl2溶液中加入NaOH得到白色沉淀,再加入FeCl3后,沉淀逐渐变为红褐色。 实验结论 ①溶解度由大到小的顺序为:__________________(因沉淀类型不同通常不能比较两者Ksp的大小)。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。 实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如OH−)不能过量。 一、1.(1)溶解 生成 (2)AgCl(s)Ag+(aq)+Cl−(aq) 2.(2)1×10−5 mol·L−1 二、1.(1)分离或除去某些离子 (3)氨水 Fe3+ +3NH3·H2OFe(OH)3↓+3 Na2S或H2S 2.(2)①CaCO3+2H+Ca2++CO2↑+H2O ②Mg(OH)2+2Mg2++2NH3· H2O Mg(OH)2+2H+Mg2++H2O,Mg(OH)2 +2Mg2++2NH3•H2O 完全溶解 3.(2)难溶电解质溶解平衡 越大 (3)锅炉除垢 矿物转化 Ag+ +Cl−AgCl↓,AgCl+I−AgI+Cl−,2AgI+S2−Ag2S+2I− Mg2++2OH−Mg(OH)2↓,3Mg(OH)2+2Fe3+3Mg2++2Fe(OH)3 AgCl>AgI>Ag2S Mg(OH)2>Fe(OH)3 溶度积规则 1.表达式 对于一般的溶解平衡:AmBn(s)mAn+(aq)+nBm−(aq),Ksp=[c(An+)]m·[c(Bm−)]n。 2.通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下能否生成沉淀或溶解。 Qc>Ksp:溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡; Qc=Ksp:溶液饱和,沉淀与溶解处于平衡状态; Qc<Ksp:溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 注意啦 (1)Ksp只与难溶电解质的性质和温度有关,与沉淀的量无关。 (2)溶液中离子浓度的变化只能使平衡移动,并不能改变溶度积。 (3)沉淀的生成和溶解这两个相反过程相互转化的条件是离子浓度的大小,改变反应所需的离子浓度,可使反应向着所需的方向转化。 (4)只有组成相似的物质(如AgCl与AgI、CaCO3与BaCO3),才能用Ksp的相对大小来判断物质溶解度的相对大小。 (5)Ksp小的难溶电解质也能向Ksp大的难溶电解质转化,需看溶液中生成沉淀的离子浓度的大小。 已知:25℃时,Ksp[Cu(OH)2]=2.2×10−20;当溶液中各离子浓度幂的乘积大于溶度积时,产生沉淀,反之沉淀溶解。 (1)25℃时,某CuSO4溶液中c(Cu2+)=0.02 mol·L−1,若要生成Cu(OH)2沉淀,应调节溶液的pH,使之大于___________________。 (2)25℃时,要使0.2 mol·L−1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH=_________。 c(H+)==1.0×10−5(mol·L−1),即pH=5,则应调节溶液pH使之大于5才能生成Cu(OH)2沉淀。 (2)要使c(Cu2+)降至0.2 mol·L−1的千分之一,即c(Cu2+)=2.0×10−4 mol·L−1,则c(OH−)=≈1.0× 10−8(mol·L−1),则25 ℃时,c(H+)=1.0×10−6 mol·L−1,pH=6,所以要使Cu2+沉淀较为完全,应使溶液的pH=6。 【答案】(1)5 (2)6 1.下列对难溶电解质的溶解平衡的叙述,错误的是 A.难溶电解质的溶解平衡是一种动态平衡 B.达到溶解平衡时,沉淀的速率和溶解的速率相等,溶液中离子的浓度保持不变 C.达到溶解平衡时,溶液中各种离子的浓度不一定相等 D.达到溶解平衡时,再加入该难溶电解质,将促进其溶解 2.在下列各种液体中,CaCO3的溶解度最大的是 A.H2O B.Na2CO3溶液 C.CaCl2溶液 D.乙醇 3.下列说法不正确的是 A.Ksp只与难溶电解质的性质和温度有关 B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C.其他条件不变,离子浓度改变时,Ksp不变 D.难溶电解质的Ksp越小,溶解度越小 4.牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列溶解平衡:Ca5(PO4)3OH(s)5Ca2+(aq)+3(aq)+OH−(aq)。试回答问题: (1)小孩吃糖后,如果不及时刷牙或漱口,细菌和酶就会作用于糖,在口腔内产生有机羧酸,久而久之,牙齿就会受到腐蚀,其原因是 。 (2)已知Ca5 (PO4)3F(s)的溶解度比上述矿化产物Ca5(PO4)3OH的溶解度更小,质地更坚硬。当牙膏中配有氟化物添加剂后能防止龋齿,其原因是(用离子方程式和简要文字说明)_______________________。 (3)根据以上原理,请你提出一种其他促进矿化的方法:_________________________________。 5.已知相同温度下,AgCl的溶解度远大于AgBr的溶解度。将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,结果是 A.只有AgBr沉淀生成 B.AgCl和AgBr沉淀等量生成 C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主 D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主 6.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据: 物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp(25°C) 8.0×10−16 2.2×10−20 4.0×10−38 完全沉淀时的pH范围 ≥9.6 ≥6.4 34 对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是 A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 B.该溶液中c(SO42−):[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5:4 C.向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液 D.在pH=5的溶液中Fe3+不能大量存在 7.[2017新课标Ⅱ]由下列实验及现象不能推出相应结论的是 实验 现象 结论 A. 向2 mL 0.1 的溶液中加足量铁粉,振荡,加1滴KSCN溶液 黄色逐渐消失,加KSCN溶液颜色不变 还原性: B. 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 CO2具有氧化性 C. 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 石蕊试纸变蓝 NH4HCO3显碱性 D. 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 一只试管中产生黄色沉淀,另一支中无明显现象 8.[2017新课标Ⅲ]在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A.的数量级为 B.除反应为Cu+Cu2++2=2CuCl C.加入Cu越多,Cu+浓度越高,除效果越好 D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 9.[2016新课标Ⅲ]下列有关电解质溶液的说法正确的是 A.向0.1 molCH3COOH溶液中加入少量水,溶液中减小 B.将CH3COONa溶液从20℃升温至30℃,溶液中增大 C.向盐酸中加入氨水至中性,溶液中 D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变 1.【答案】D 【解析】难溶电解质的溶解平衡和我们学过的化学平衡一样,具有逆、动、等、定、变等特征。达到溶解平衡时,溶液中各种离子的浓度保持不变,但不一定相等。难溶电解质是固体,它的浓度可以看作固定不变,因此,增加难溶电解质的量,平衡不移动。 2.【答案】A 【解析】B、C项的溶液中分别含有和Ca2+,均会抑制CaCO3的溶解,而CaCO3在乙醇中是不溶的。 3.【答案】D 4.【答案】(1)有机羧酸电离出H+与Ca5(PO4)3OH电离出的OH−发生反应:H++OH−H2O,使Ca5(PO4)3OH的溶解平衡向右移动 (2)F−与Ca5(PO4)3OH溶解产生的Ca2+、发生反应生成更难溶的Ca5(PO4)3F:5Ca2++3+F− Ca5(PO4)3F↓ (3)在牙膏中加Ca2+,使题中溶解平衡向左移动 【解析】(1)有机羧酸电离出H+与Ca5(PO4)3OH电离出的OH−发生反应:H++OH−H2O,使Ca5(PO4)3OH的溶解平衡向右移动,Ca5(PO4)3OH逐渐溶解,导致牙齿腐蚀出现龋齿。 (2)根据难溶电解质的转化规律,溶解度较小的物质可以转化成溶解度更小的物质。依据题给信息可知,F−可以替代平衡中的OH−,生成溶解度更小、质地更坚硬的Ca5(PO4)3F,从而保护牙齿防止龋齿:5Ca2++3+F−Ca5(PO4)3F↓。 (3)促进矿化的方法之一就是使Ca5(PO4)3OH的溶解平衡向左移动,减少Ca5(PO4)3OH的溶解。一种可行的方法是在牙膏中加Ca2+,使上述溶解平衡向左移动。 5.【答案】C 【解析】根据题意可知,AgCl与AgBr的饱和溶液中Br-的浓度比Cl-的浓度小得多。因此,生成的沉淀以AgCl为主。 6.【答案】C 【解析】根据溶度积常数可判断A正确;由于c(Cu2+)、c(Fe2+)、c(Fe3+)在溶液中均发生水解反应而使金属阳离子浓度减小,因此B正确;由选项C的操作可知,溶液中还有氯离子,即溶液中还存在CuCl2,C错误;由表中数据知Fe3+在pH=3〜4的环境中已沉淀完全,因此选项D正确。 7.【答案】C 8.【答案】C 【解析】A.Ksp(CuCl)=c(Cu+)·c(Cl-),在横坐标为1时,纵坐标大于-6,小于−5,所以Ksp(CuCl)的数量级是10-7,A正确;B.除去Cl-反应应该是Cu+Cu2++2Cl-=2CuCl,B正确;C.溶液中存在平衡:Cu++Cl-CuCl、2Cu+Cu2++Cu,加入纯固态物质Cu对平衡无影响,故C错误;D.在没有Cl-存在的情况下,反应2Cu+Cu2++Cu的平衡常数约为,平衡常数很大,反应趋于完全,D正确。答案选C。 9.【答案】D 【解析】A、=,因为加水,稀释溶液,醋酸电离程度增大,但醋酸根离子浓度减小,平衡常数不变,故比值变大,故错误;B、醋酸钠溶液加热,醋酸根离子水解程度增大,其=1/K,K变大,所以比值变小,故错误;C、盐酸中加入氨水到中性,则有c(H+)=c(OH−),根据电荷守恒,c(NH4+)=c(Cl−),故错误;D、向氯化银和溴化银的饱和溶液中加入少量硝酸银,沉淀溶解平衡逆向移动,氯离子和溴离子浓度比仍等于其溶度积的比值,故不变,故正确。 查看更多