- 2021-07-06 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省随州市第二高级中学2018-2019学年高二9月起点考试化学试题(A班)
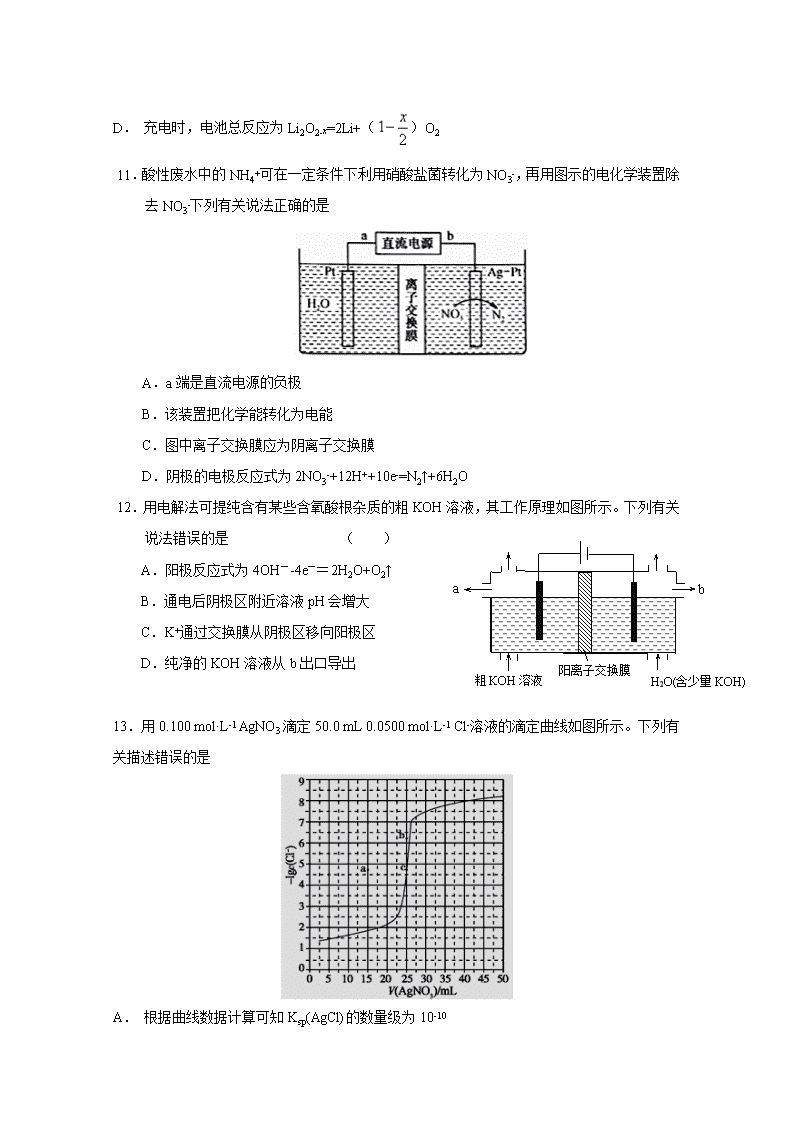
随州二中2017级高二年级9月起点考试 化学试题(A班) 命题人: 可能用到的原子量:H-1 O-16 C-12 Sc-45 一、选择题(每小题只有一个选项正确,每小题3分,共54分) 1.下列说法正确的是 A.反应A(g) 2B(g) ΔH,若正反应的活化能为Ea kJ/mol,逆反应的活化能为 Eb kJ/mol,则ΔH=-(Ea-Eb) kJ/mol B.某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% C.将0.2 mol/L 的CH3COOH 溶液与0.1 mol/L 的NaOH 溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) D.将浓度为0.1 mol/L HF 溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,始终保持增大 2.某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是( ) A.正反应活化能小于100kJ·mol-1 B.逆反应活化能一定小于100kJ·mol-1 C. 正反应活化能比逆反应活化能小100kJ·mol-1 D.正反应活化能比逆反应活化能大100kJ·mol-1 3.已知(x)、 (y)、 (z) 的分子式均为C8H8,下列说法正确的是 ( ) A.x完全氢化后的产物为q,q的一氯代物有六种同分异构体 B.x、y、z中的所有原子不可能都处于同一平面上 C.可以用y萃取溴水中的溴 D.x的同分异构体只有y和z两种 4.两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是: ①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔(C2H2) A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤ 5.已知:|||+,如果要合成,所用的起始原料可以是( ) ①2—甲基—1, 3—丁二烯和2—丁炔 ②1,3—戊二烯和2—丁炔 ③2,3—二甲基—1,3—戊二烯和乙炔 ④2,3—二甲基—1,3—丁二烯和丙炔 A. ①④ B. ②③ C. ①③ D. ②④ 6.乙苯()的二氯代物共有( ) A. 15种 B. 12种 C. 9种 D. 6种 7.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。下列关于该化合物的说法错误的是 A.与环戊烯互为同分异构体 B.二氯代物超过两种 C.所有碳原子均处同一平面 D.生成1 molC5H12至少需要2 molH2 8.分子式为C8H16O2的有机物A,能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A可能的结构有 ( )。A.1种 B.2种 C.3种 D.4种 9.主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有( )。 A.2种 B.3种 C.4种 D.5种 10一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是 A. 放电时,多孔碳材料电极为负极 B. 放电时,外电路电子由多孔碳材料电极流向锂电极 C. 充电时,电解质溶液中Li+向多孔碳材料区迁移 D. 充电时,电池总反应为Li2O2-x=2Li+()O2 11.酸性废水中的NH4+可在一定条件下利用硝酸盐菌转化为NO3-,再用图示的电化学装置除去NO3-下列有关说法正确的是 A.a端是直流电源的负极 B.该装置把化学能转化为电能 C.图中离子交换膜应为阴离子交换膜 D.阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O 阳离子交换膜 a 粗KOH溶液 H2O(含少量KOH) b 12.用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是 ( ) A.阳极反应式为4OH--4e-=2H2O+O2↑ B.通电后阴极区附近溶液pH会增大 C.K+通过交换膜从阴极区移向阳极区 D.纯净的KOH溶液从b出口导出 13.用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是 A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动 14.根据下列图示所得出的结论不正确的是 A. 图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C. 图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42−)越大c(Ba2+ )越小 15.将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是 A.C点对应状态的平衡常数K(C)=10-3.638 B.该反应的△H>0 C.NH3的体积分数不变时,该反应一定达到平衡状态 D.30 ℃时,B点对应状态的v(正)<v(逆) 16.25℃时,某浓度H3PO4 溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示:下列说法正确的是: A.曲线1和曲线2分别表示δ(H3PO4)和δ(HPO42-)的变化 B.25℃时,H3PO4的电离常数K1=10-2.1 C.pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+) D.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L 17.常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( ) A.曲线 M 表示 pH与的变化关系 B.Ka2(H2Y)=10-4.3 C.d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+) D.交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -) 18.可逆反应①X(g)+2Y(g)2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图示: 下列判断正确的是 A. 反应①的正反应是吸热反应 B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 C. 达平衡(I)时,X的转化率为 D. 在平衡(I)和平衡(II)中M的体积分数相等 二、非选择题(46分) 19.(12分)钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下: 回答下列问题: (1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。 (2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31) (3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5] (4)草酸钪“灼烧”氧化的化学方程式为_____________________________。 (5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。 20.(10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。 请回答下列问题: (1)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅱ中生成有机物的反应为__________________________________________(填化学方程式),装置Ⅲ中小试管内苯的作用是__________________________________。 (2)能说明苯与液溴发生了取代反应的现象是_____________________。 (3)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法__________。 (4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。 ①用蒸馏水洗涤、振荡、分液;②用5%的NaOH溶液洗涤、振荡、分液;③用蒸馏水洗涤、振荡、分液;④加入无水CaCl2粉末干燥;⑤_______________(填操作名称)。21.(12分)乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题: (1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是 (填标号)。 A.压强不再变化 B. CO2(g)的体积分数保持不变 C. 混合气体密度不再变化 D.混合气体平均摩尔质量保持不变(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示: ①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为 (填标号)。 A.强酸性 B.弱酸性 C.中性 D.碱性 ②25℃时,反应C2O42-+H2C2O4-2HC2O4-的平衡常数的对数值1gK= 。 (3)向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH) 10 mL(填“>”“=”或“<”)。 (4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是 ; 该过程中发生反应的离子方程式为 ;滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为 。 22.(12分)图中A~J均为有机化合物,根据图中的信息,回答下列问题。 (1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_________________________。 (2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。 (3)由A生成D的反应类型是________,由D生成E的反应类型是________。 (4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和, G 的结构简式为________________________________________________________; (5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应: 则由E和A反应生成F的化学方程式为______________________________________。 (6)H中含有的官能团是________,I中含有的官能团是________。 A班化学参考答案 1-5:CDAAA 6-10:ACBAD 11-15:DCCCC 16-18:BDC 19. 20. :(1)冷凝管起冷凝回流的作用;采用逆向通水,即从a进水,使气体与水充分接触,冷凝效果好,故答案为:冷凝回流;a; (2)Ⅲ中小试管内苯的作用是除去溴化氢中的溴蒸气,避免干扰溴离子检验, 故答案为:吸收溴蒸气; (3)因从冷凝管出来的气体为溴化氢,溴化氢不溶于苯,溴化氢能与硝酸银反应生成溴化银沉淀,故答案为:Ⅲ中硝酸银溶液内有浅黄色沉淀生成; (4)因装置Ⅱ中含有溴化氢气体能污染空气,使I的水倒吸入Ⅱ中可以除去溴化氢气体,以免逸出污染空气;操作方法为开启K2,关闭K1和分液漏斗活塞,故答案为:反应结束后装置Ⅱ中存在大量的溴化氢,使I的水倒吸入Ⅱ中可以除去溴化氢气体,以免逸出污染空气;开启K2,关闭K1和分液漏斗活塞; (5)加入无水CaCl2粉末干燥,然后通过蒸馏操作,获得纯净的溴苯,故答案为:蒸馏. 21. 22. 查看更多