- 2021-07-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
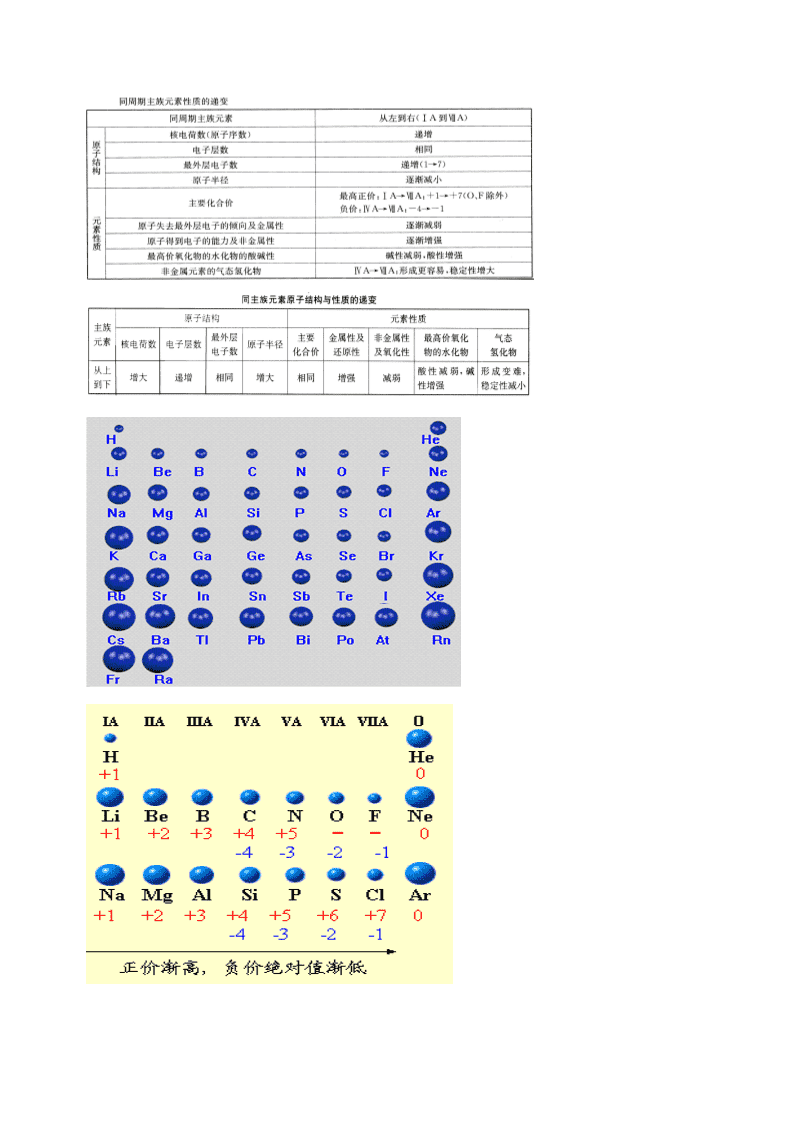
高考化学二轮复习物质结构和元素周期律3元素周期表和元素周期律学案无答案
元素周期表和元素周期律 【思考题】 1、原子序数为 82、88、112 的属于何 族何周期? 2、在元素周期表中,哪纵元素最多,哪纵化合物种类最多? 3、在元素周期表中,前三周期空着的有多少个元素? 4、在元素周期表中,第三主族是哪一纵?三副族呢? 5、在元素周期表中,镧系有多少个元素? 6、在元素周期表中,周期差是多少,同周期的第二主族和第三主族相差 是多少? 一.元素周期表 1.周期表结构 横行——周期:共 个周期, 短 长。 各周期分别有 、 、 、18、18、32、…种元素。前三个周期为短 周期,其余周期为长周期。 纵行——族: 族 列,七主七副一零 VIII。要记住零族元素的原 子序数以便迅速由原子序数确定元素名称。 周期: 1 2 3 4 5 6 元素种类: 2 8 8 18 18 32 零族: 2He 10Ne 18Ar 36Kr 54Xe 86Rn ①若ⅡA 族某元素的原子序数为 n,则与之同周期的ⅢA 族的元素的原子 序数可能为 n+1、n+11、n+25; ②若上一周期某元素的原子序数为 n,则与之同主族的下一周期的元素的 原子序数可 能为 n+2、n+8、n+18、n+32。 2.原子结构与元素周期表的关系 电子层数 = 周期数 主族元素最外层电子数(价电子数)=主族序数=最高正化合价(除 F、O) 由上述关系,就可以由原子结构找出元素在周期表中的位置,也可以由位 置确定原子结构。 二.元素周期律 随着元素原子序数的递增,核外电子排布呈现周期性的变化,由此导 致元素性质(主要是金属性、非金属性、还原性、氧化性 、气态氢化物 形成的难易及其稳定性、最高价氧化物对应水化物的酸碱性…… )呈现周 期性的变化规律,即元素周期律。 三.原子结构、元素性质的变化规律在元素周期表中的体现 1.规律性 2.特殊性 在掌握原子结构、元素性质的一般规律时,还要注意特殊性: (1)同一周期主族元素原子最外层电子排布是 1→8 个电子,但第一周期 是 1→2 个电子; (2)同一周期原子半径从左至右由大→小(稀有气体中不是原子半径而 是范德华半径,没有可比性); (3)同一周期元素主要正化合价由+1 价到+7 价,但 F 无正价、O 无+6 价; (4)原子核中通常含有质子和中子,但是 原子中没有中子; (5)碱金属是 IA 族,但不包括 H 元素,IA 族包括 H 元素和碱金属; (6)气态氢化物与其最高价氧化物对应水化物酸碱性相反,相互反应生 成离子化合物的元素是 N。 3.元素周期表中之最 原子半径最小的原子:H 质量最轻的元素:H 宇宙中含量最多的元素:H 最不活泼的元素:He 最轻的金属单质:Li 形成化合物最多的元素:C 含 H 质量分数最高的气态氢化物:CH4 空气中含量最多的元素:N 地壳中含量最高的元素:O,其次是 Si 地壳中含量最高的金属元素:Al,其次是 Fe 非金属性最强的元素:F 金属性最强的元素:Cs(不考虑 Fr) 与水反应最剧烈的金属单质:Cs(不考虑 Fr) 与水反应最剧烈的非金属单质:F2 最高价氧化物对应水化物酸性最强的酸:HClO4 最高价氧化物对应水化物碱性最强的碱:CsOH(不考虑 FrOH) 所含元素种类最多的族:ⅢB 常温下呈液态的非金属单质是 Br2,金属单质是 Hg 四.元素金属性、非金属性强弱的比较: 1.金属性强弱的比较依据: (1)根据周期表中的位置; (2)根据金属活动性顺序表(盐溶液之间的置换关系、阳离子在水溶液 中电解时放电的一般顺序); (3)根据单质与水或非氧化性酸反应置换出氢气的难易程度; (4)根据最高价氧化物对应水化物的碱性强弱; (5)根据构成原电池时的正负极。 2.非金属性强弱的比较依据: (1)根据周期表中的位置; (2)根据置换关系判断(阴离子在水溶液中电解时放电的一般顺序); (3)根据与金属反应的产物比较; (4)根据与 H2 化合的难易程度及气态氢化物的稳定性、还原性; (5)根据最高价氧化物对应水化物的酸性强弱。 五.位、构、性之间的关系: 六、元素周期表和元素周期律对于其他与化学相关的科学技术 的指导作用: 1、找半导体 2、制造农药 3、 寻找催化剂和耐高温耐腐蚀的合金材料 例 1.已知 X、Y、Z 三种主族元素在周期表中的相对位置如图所示,且 X 的原子序数为 a,下列说法不正确的是 A.Y、Z 的原子序数之和可能为 2a B.Y 的原子序数可能是 a-17 C.Z 的原子序数可能是 a+31 D.X、Y、Z 一定都是短周期元素 例 2.在温度 t1 和 t2 下,X2(g)和 H2 反应生成 HX 的平衡常数如下表: 化学方程式 K(t1) K(t2) F2+H2 2HF 1.8×1036 1.9×1032 Cl2+H2 2HCl 9.7×1012 4.2×1011 Br2+H2 2HBr 5.6×107 9.3×106 I2+H2 2HI 43 34 ⑴已知 t2>t1,HX 的生成反应是 反应(填“吸热”或“放热”)。 ⑵HX 的电子式是 。 ⑶共价键的极性随共用电子对偏移程度的增大而增强,HX 共价键的极性由 强到弱的顺序是 。 ⑷X2 都能与 H2 反应生成 HX,用原子结构解释原因: 。 ⑸K 的变化体现出 X2 化学性质的递 变性,用原子结构解释原因: ,原子半径逐渐增大,得电子能力逐渐减弱。 ⑹仅依据 K 的变化,可以推断出:随着卤素原子核电荷数的增加, (选填字母)。 a.在相同条件下,平衡时 X2 的转化率逐渐降低 b. X2 与 H2 反应的剧烈程度逐渐减弱 c.HX 的还原性逐渐减弱 d.HX 的稳定性逐渐减弱 例 3.下列说法正确的有: (1)短周期元素的最高化合价在数值上都等于该元素所属的族序数。 (2)除短周期外,其它周期均为 18 种元素。 (3)副族元素没有非金属元素。 (4)碱金属元素是指ⅠA 族的所有的元素。 (5)从上到下,ⅠA 族的单质的熔点逐渐升高。 (6)从上到下,卤素单质的熔点逐渐降低。 (7 )元素周期表中,只有第 2 列元素的原子最外层有 2 个电子。 (8)铍的原子半径大于硼的原子半径。 (9)氢氧化铍的碱性比氢氧化钙的弱。 (10)磷的氢化物(PH3)受热时不如 NH3 和 H2S 稳定。 (11)最外层有 5 个电子的原子都是非金属原子。 (12)同周期非金属氧化物对应的水化物的酸性从左到右依次增强。 (13)第 3 周期元素的离子半径最小的是 Na+。 (14)HF、HCl、HBr、HI 酸性逐渐增强。 (15)X、Y 在同一周期,原子半径 X>Y,离子半径 X+>Y 2-。查看更多