- 2021-07-06 发布 |
- 37.5 KB |
- 25页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 考点35 电解原理及其应用(解析版)
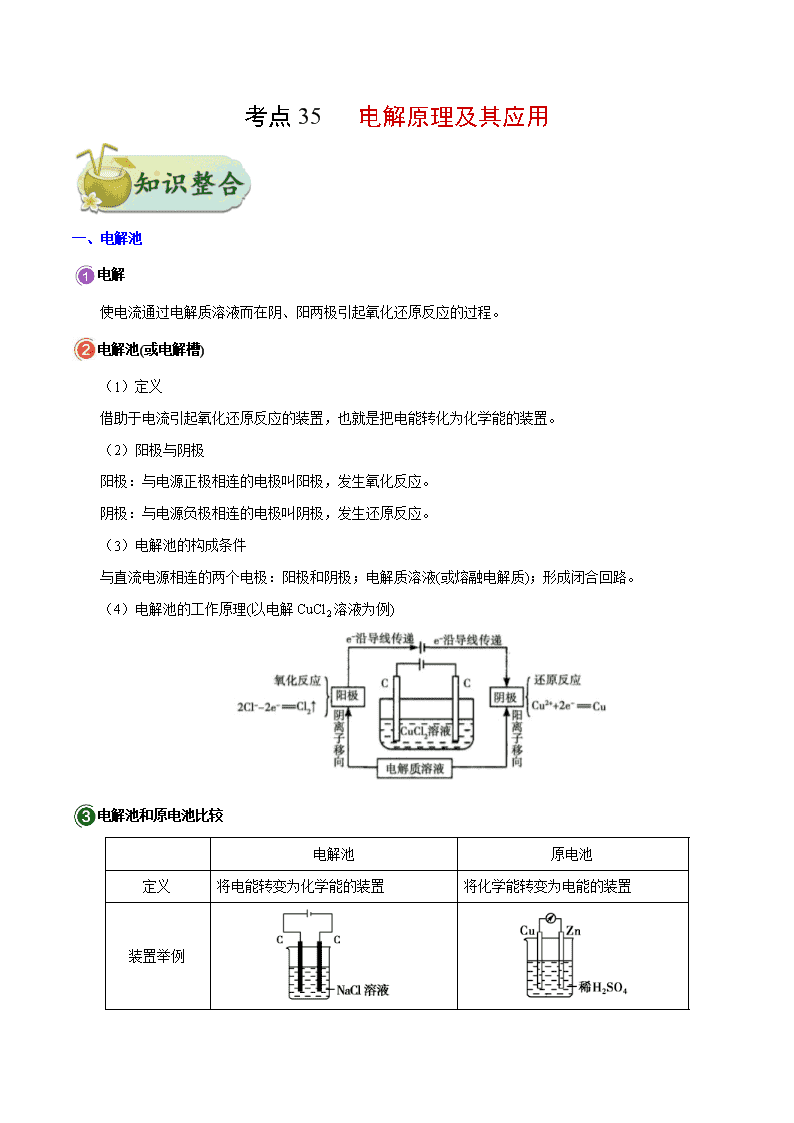
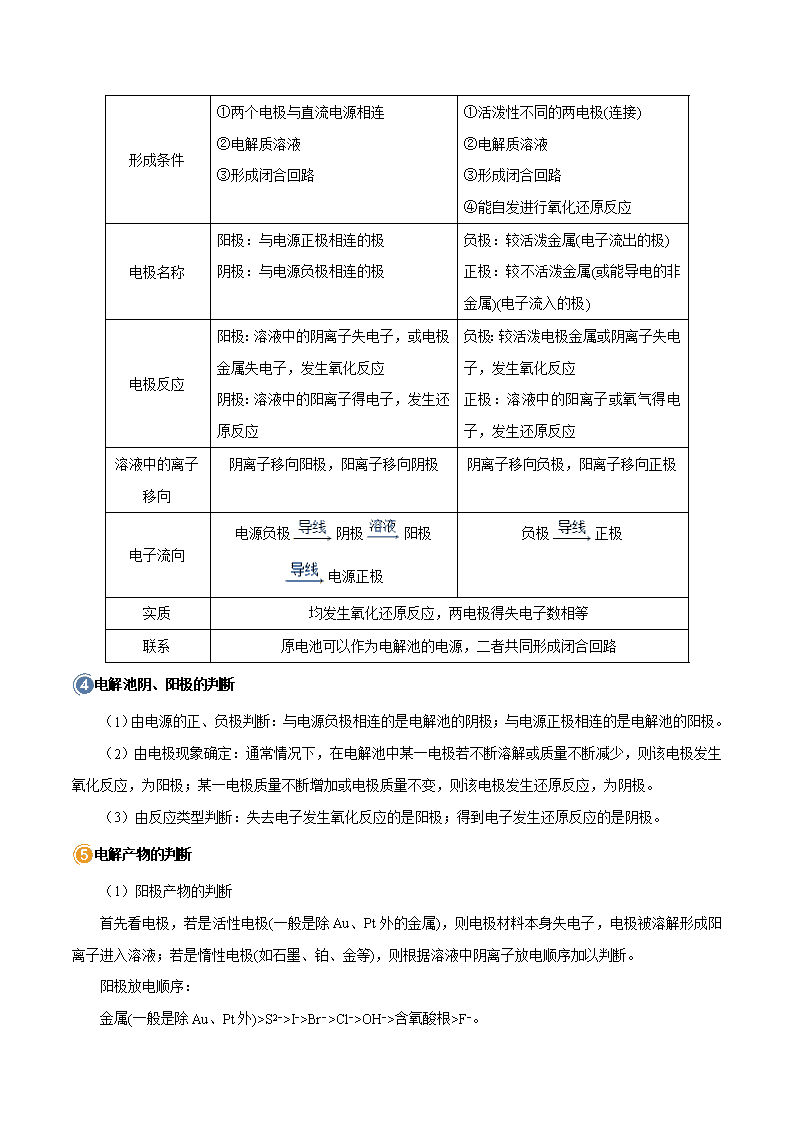
考点 35 电解原理及其应用 一、电解池 电解 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。 电解池(或电解槽) (1)定义 借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置。 (2)阳极与阴极 阳极:与电源正极相连的电极叫阳极,发生氧化反应。 阴极:与电源负极相连的电极叫阴极,发生还原反应。 (3)电解池的构成条件 与直流电源相连的两个电极:阳极和阴极;电解质溶液(或熔融电解质);形成闭合回路。 (4)电解池的工作原理(以电解 CuCl2溶液为例) 电解池和原电池比较 电解池 原电池 定义 将电能转变为化学能的装置 将化学能转变为电能的装置 装置举例 形成条件 ①两个电极与直流电源相连 ②电解质溶液 ③形成闭合回路 ①活泼性不同的两电极(连接) ②电解质溶液 ③形成闭合回路 ④能自发进行氧化还原反应 电极名称 阳极:与电源正极相连的极 阴极:与电源负极相连的极 负极:较活泼金属(电子流出的极) 正极:较不活泼金属(或能导电的非 金属)(电子流入的极) 电极反应 阳极:溶液中的阴离子失电子,或电极 金属失电子,发生氧化反应 阴极:溶液中的阳离子得电子,发生还 原反应 负极:较活泼电极金属或阴离子失电 子,发生氧化反应 正极:溶液中的阳离子或氧气得电 子,发生还原反应 溶液中的离子 移向 阴离子移向阳极,阳离子移向阴极 阴离子移向负极,阳离子移向正极 电子流向 电源负极 阴极 阳极 电源正极 负极 正极 实质 均发生氧化还原反应,两电极得失电子数相等 联系 原电池可以作为电解池的电源,二者共同形成闭合回路 电解池阴、阳极的判断 (1)由电源的正、负极判断:与电源负极相连的是电解池的阴极;与电源正极相连的是电解池的阳极。 (2)由电极现象确定:通常情况下,在电解池中某一电极若不断溶解或质量不断减少,则该电极发生 氧化反应,为阳极;某一电极质量不断增加或电极质量不变,则该电极发生还原反应,为阴极。 (3)由反应类型判断:失去电子发生氧化反应的是阳极;得到电子发生还原反应的是阴极。 电解产物的判断 (1)阳极产物的判断 首先看电极,若是活性电极(一般是除 Au、Pt外的金属),则电极材料本身失电子,电极被溶解形成阳 离子进入溶液;若是惰性电极(如石墨、铂、金等),则根据溶液中阴离子放电顺序加以判断。 阳极放电顺序: 金属(一般是除 Au、Pt外)>S2−>I−>Br−>Cl−>OH−>含氧酸根>F−。 (2)阴极产物的判断 直接根据溶液中阳离子放电顺序加以判断。阳离子放电顺序: Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+。 (1)处理有关电解池两极产物的问题,一定要先看电极是活性电极还是惰性电极。活性电极在阳极放 电,电极溶解生成相应的金属离子,此时阴离子在阳极不放电。对于惰性电极,则只需比较溶液中定向移 动到两极的阴阳离子的放电顺序即可。 (2)根据阳离子放电顺序判断阴极产物时,要注意下列三点: ①阳离子放电顺序表中前一个 c(H+)与其他离子的浓度相近,后一个 c(H+)很小,来自水的电离; ②Fe3+得电子能力大于 Cu2+,但第一阶段只能被还原到 Fe2+; ③Pb2+、Sn2+、Fe2+、Zn2+控制一定条件(即电镀)时也能在水溶液中放电;Al3+、Mg2+、Na+、Ca2+、K+ 只有在熔融状态下放电。 二、电解原理的应用 1.电解饱和食盐水——氯碱工业 (1)电极反应 阳极:2Cl−−2e−===Cl2↑(反应类型:氧化反应)。 阴极:2H++2e−===H2↑(反应类型:还原反应)。 检验阳极产物的方法是:用湿润的 KI淀粉试纸靠近阳极附近,若试纸变蓝,证明生成了 Cl2。电解时 向食盐水中加酚酞,阴极附近溶液变红,说明该电极附近产生的物质为 NaOH。 (2)电解方程式 化学方程式:2NaCl+2H2O 电解 2NaOH+H2↑+Cl2↑ 离子方程式:2Cl−+2H2O 电解 2OH−+H2↑+Cl2↑ 2.电解精炼铜 电镀(Fe表面镀 Cu) 电解精炼铜 阳极 电极材料 镀层金属铜 粗铜(含 Zn、Fe、Ni、Ag、Au等杂质) 电极反应 Cu−2e−===Cu2+ Cu−2e−===Cu2+ Zn−2e−===Zn2+ Fe−2e−===Fe2+ Ni−2e−===Ni2+ 阴极 电极材料 待镀金属铁 纯铜 电极反应 Cu2++2e−===Cu 电解质溶液 含 Cu2+的盐溶液 注:电解精炼铜时,粗铜中的 Ag、Au等不反应,沉积在电解池底部形成阳极泥 3.电镀 利用电解原理,在金属表面上镀上一层其它金属或合金的过程叫电镀。 ①电极的连接:镀层金属或惰性电极做阳极,和外加电源的正极相连;镀件金属做阴极,和外加电源 的负极相连。如铁上镀铜,铜(或石墨)做阳极,铁做阴极。 ②电镀液的选择:选择含有镀层金属离子的溶液做电镀液,如铁上镀铜,选择硫酸铜溶液做电镀液。 ③电极反应:阳极:Cu===Cu2++2e−,阴极:Cu2+ +2e−===Cu ④电镀的特点:若镀层金属做阳极,电镀过程中溶液中阳离子浓度不变;若用惰性电极做阳极,电镀 过程中溶液中阳离子浓度减小。 电镀过程中,溶液中离子浓度不变;电解精炼铜时,由于粗铜中含有 Zn、Fe、Ni等活泼金属,反应过 程中失去电子形成阳离子存在于溶液中,而阴极上 Cu2+被还原,所以电解精炼过程中,溶液中的阳离子浓 度会发生变化。 4.电冶金 冶炼钠、钙、镁、铝等活泼金属,必须用电解法。如电解熔融氯化钠得到钠时: 注意:①电解熔融MgCl2冶炼镁,而不能电解熔融MgO 冶炼镁,因MgO 的熔点很高; ②电解熔融 Al2O3冶炼铝,而不能电解 AlCl3冶炼铝,因 AlCl3是共价化合物,其熔融态不导电。 考向一 电解规律的考查 典例 1 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的 pH依次为升高、不变、 降低的是 A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4 C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4 【解析】由电解规律可得 类型 化学物质 pH变化 放 O2生酸型 CuSO4、AgNO3、Cu(NO3)2 降低 放 H2生碱型 KCl、CaCl2 升高 电解电解质型 CuCl2 升高 HCl 升高 电解 H2O型 NaNO3、Na2SO4、K2SO4 不变 KOH 升高 HNO3 降低 【答案】B 1.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是 A.铜电极附近观察到黄绿色气体 B.石墨电极附近溶液呈红色 C.溶液中的 Na+向石墨电极移动 D.铜电极上发生还原反应 【答案】D 【解析】 试题分析:电解饱和食盐水时溶液中放电的离子是 H+和 Cl—,故铜电极作阴极,H+在此电极上放电,发生 还原反应:2H++2e—=H2↑,此电极附近 OH—增多,附近溶液呈红色,溶液中的 Na+向石墨电极移动;石墨 作阳极,Cl—在此电极上放电,发生氧化反应:2Cl——2e—=Cl2↑,石墨电极附近观察到黄绿色气体;综上所 述 D正确。 用惰性电极电解电解质溶液的规律 类 型 电解质特点 实例 电极反应 电解方程式 电解 对象 电解质 溶液的 变化 电解质溶液 复原的方法阴极 阳极 电 解 水 型 含氧酸 H2SO4 4H++4e− 2H2↑ 4OH−−4e− 2H2O+O2↑ 2H2O 2H2↑+O2↑ 水 浓度增大 加水 可溶性强碱 NaOH 活泼金属含氧 酸盐 KNO3 电 解 电 解 质 型 无氧酸 HCl 2H++2e− H2↑ 2Cl−−2e− Cl2↑ 2HCl H2↑+Cl2↑ 电解质 浓度减小 加 HCl 不活泼金属无 氧酸盐 CuCl2 Cu2++2e− Cu 2Cl−−2e− Cl2↑ CuCl2 Cu+Cl2↑ 加 CuCl2 放 H2 生 碱 型 活泼金属无氧 酸盐 NaCl 2H++2e− H2↑ 2Cl−−2e− Cl2↑ 2NaCl+2H2O 2NaOH +H2↑+Cl2↑ 电解质 和水 生成新 电解质 加 HCl 放 O2 生 酸 型 不活泼金属含 氧酸盐 CuSO4 Cu2++2e− Cu 4OH−−4e− 2H2O+O2↑ 2CuSO4+2H2O 2Cu+ 2H2SO4+O2↑ 电解质 和水 生成新 电解质 加 CuO 考向二 电解原理的“常规”应用 典例 2 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓 NaOH溶液制备高铁酸钠 (Na2FeO4)的装置如图所示。下列说法正确的是 A.铁是阳极,电极反应为 Fe-2e-+2OH-===Fe(OH)2 B.电解一段时间后,镍电极附近溶液的 pH减小 C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有 FeO2-4 D.每制得 1 mol Na2FeO4,理论上可以产生 67.2 L气体 【解析】A.用镍(Ni)、铁作电极电解浓 NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠, 则铁作阳极,镍作阴极,电极反应式为 Fe+8OH--6e-===FeO2-4 +4H2O,故 A错误;B.镍电极上氢离子 放电生成氢气,氢离子浓度减小,所以溶液的 pH增大,故 B错误;C.若离子交换膜为阴离子交换膜,则 电解结束后由于浓度差左侧溶液中会含有 FeO2-4 ,故 C正确;D.温度和压强未知,所以无法计算生成气体 体积,故 D错误。 【答案】C 2.如图是模拟工业电解饱和食盐水的装置图,下列叙述不正确的是 A.a 为电源的负极 B.Fe 电极的电极反应是 4OH - -4e - 2H2O+O2↑ C.通电一段时间后,铁电极附近溶液先变红 D.电解饱和食盐水的化学方程式是 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 【答案】B 【详解】A.Fe 电极作阴极,对应的 a 为电源负极,故 A项正确;B.工业上电解食盐水以石墨为阳极,Fe 电 极为阴极,阴极的电极反应式为: ,故 B项错误;C项,Fe 电极产生 OH - ,遇酚 酞变红,故 C 项正确;D项,NaCl 溶液通电生成 NaOH、Cl2和 H2,故 D 项正确。本题答案为 B。 离子交换膜的作用 阳离子交换膜(以电解 NaCl溶液为例),只允许阳离子(Na+)通过,而阻止阴离子(Cl−、OH−)和分子(Cl2) 通过,这样既能防止 H2和 Cl2混合爆炸,又能避免 Cl2和 NaOH溶液作用生成 NaClO影响烧碱质量,由此 可推知,阴离子交换膜只允许阴离子通过,质子(H+)交换膜只允许质子(H+)通过。 考向三 电解原理的“创新”应用 典例 3.硼酸 3 3H BO 为一元弱酸,已知 3 3H BO 与足量NaOH溶液反应的离子方程式为 3 3 4 3 3H BO OH = B(OH) H BO , 可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许 阳离子、阴离子通过)。下列说法正确的是 A.当电路中通过1mol电子时,可得到 3 31molH BO B.将电源的正、负极反接,工作原理不变 C.阴极室的电极反应式为 2 2=2H O 4e O 4H D. 4B(OH) 穿过阴膜进入阴极室,Na穿过阳膜进入产品室 【答案】A 【分析】 由装置图可知,与电源正极相连的为阳极,与电源负极相连的为阴极,阳极氢氧根失电子发生氧化反应, 电极反应式为 2H2O-4e-═O2↑+4H+,则氢离子穿过阳膜进入产品 H3BO3室;阴极氢离子得电子发生还原反应, 电极反应式为4H2O+4e-═2H2↑+4OH-,Na+穿过阳膜进入阴极室,所以阴极室NaOH溶液浓度增大, -4B(OH) 穿过阴膜进入产品 H3BO3室,与氢离子结合生成 H3BO3,据此分析解答。 【详解】 A.阳极发生失去电子的氧化反应,电极反应式为 2 2=2H O 4e O 4H ,电路中通过1mol电子时有1molH 生成,硼酸 3 3H BO 为一元弱酸,生成1mol硼酸需要1molH ,所以电路中通过1mol电子时,可得到 3 31molH BO ,故 A正确; B.根据以上分析可知,如果将电源的正、负极反接,工作原理将发生变化,故 B错误; C.电解时阴极发生得电子的还原反应,电极反应式为 2 24H O 4e =2H 4OH ,故 C错误; D.阳极电极反应式为 2 2=2H O 4e O 4H ,阴极电极反应式为 2 24H O 4e =2H 4OH ,阳极室中的氢 离子穿过阳膜进入产品室,原料室中的 -4B(OH) 穿过阴膜进入产品室,发生反应: 4 2 3 3B(OH) H =H O H BO ,原料室中的Na穿过阳膜进入阴极室,故 D错误;答案选 A。 3.工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝 酸、有机碳氢化合物等粒子形成的烟雾。烟气中的 SO2可以用 NaOH溶液吸收,将所得的 Na2SO3溶液进行 电解,可循环再生 NaOH,同时得到 H2SO4,其原理如下图所示。(电极材料为石墨) (1)用 NaOH溶液吸收 SO2发生的主要反应的离子方程式为___________________。 (2)图中,交换膜 I应为________(填“阳离子”或“阴离子”)交换膜。 (3)当有 1mol Na+通过阳离子交换膜时,a极生成气体__________L(标准状况)。 (4)SO 2 3 放电的电极反应式为__________________。 (5)通电开始后,阴极附近溶液 pH会增大,请简述原因:_______________。 【答案】SO2+2OH-= 2- 3SO +H2O 阳离子 11.2 2- 3SO -2e-+H2O= 2- 4SO +2H+ H+ 放电促进水 的电离,使 OH-浓度增大 【分析】 电解 Na2SO3溶液过程中,若要实现循环再生 NaOH,同时得到 H2SO4,则 2- 3SO 发生氧化反应生成 2- 4SO , 因此 b电极发生氧化反应, 2- 3SO 移向右侧,电极反应为: 2- 3SO -2e-+H2O= 2- 4SO +2H+ ,交换膜 II为阴离 子交换膜,a电极发生还原反应,Na+移向左侧,电极反应为:2H2O+2e-=H2↑+2OH-,交换膜 I为阳离子交换 膜,据此解答。 【详解】 (1)NaOH溶液吸收 SO2发生的主要反应为 2NaOH+SO2=Na2SO3+H2O,离子方程式为:SO2+2OH-= 2- 3SO +H2O; (2)由上述分析可知,交换膜 I为阳离子交换膜; (3)当有 1mol Na+通过阳离子交换膜时,电解池中有 1mol电子转移,根据 a极电极反应式 2H2O+2e-=H2↑+2OH-可知,将生产 0.5molH2,在标准状况下体积为 0.5mol×22.4L/mol=11.2L; (4) 2- 3SO 发生氧化反应生成 2- 4SO ,电极反应式为 2- 3SO -2e-+H2O= 2- 4SO +2H+; (5)通电后,阴极电极反应式为 2H2O+2e-=H2↑+2OH-,其本质是水电离出的 H+放电,电解过程中促进水的 电离,使阴极负极溶液 OH-浓度增大,从而使溶液 pH增大。 考向四 根据电子守恒计算 典例 4 500 mL NaNO3和 Cu(NO3)2的混合溶液中 c(NO- 3 )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电 一段时间后,两极均收集到气体 1.12 L(标准状况下),假定电解后溶液体积仍为 500 mL,下列说法正确 的是 A.原混合溶液中 c(Na+)=0.2 mol·L-1 B.电解后溶液中 c(H+)=0.2 mol·L-1 C.上述电解过程中共转移 0.4 mol电子 D.电解后溶液复原时需加入 4 g CuO 【解析】两极均收集 1.12 L气体(标准状况下)―→ 阴极:Cu2++2e-===Cu,2H++2e-===H2↑ 阳极:4OH- -4e-===O2↑+2H2O ―→ 转移电子为 0.2 mol⇒n(Cu2+)=0.05 mol,n(H+)=0.1 mol n(Na+)=0.05 mol。复原时需加 CuO: 0.05×80 g=4 g和 H2O:0.05×18 g=0.9 g 或加 Cu(OH)2 4.9 g。 【答案】B 4.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收 NOx的装置如图所示(图中电极均为石墨电极)。 (1)若用 NO2气体进行模拟电解法吸收实验。 ①写出电解时 NO2发生反应的电极反应式: 。 ②若在标准状况下有 2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的 H+为 mol。 (2)某小组在右室装有 10 L 0.2 mol·L−1硝酸溶液,用含 NO和 NO2(不考虑 NO2转化为 N2O4)的废气进 行模拟电解法吸收实验。 ①实验前,配制 10 L 0.2 mol·L−1硝酸溶液需量取 mL、密度为 1.4 g·mL−1、质量分数为 63% 的浓硝酸。 ②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含 3 mol HNO3、0.1 mol HNO2, 同时左室收集到标准状况下 28 L H2。计算原气体中 NO和 NO2的体积比(假设尾气不含氮氧化物, 写出计算过程)。 【答案】(1)①NO2−e−+H2O 3NO +2H+ ②0.1 (2)①143 ②根据原子守恒:n(NO)+n(NO2)=3 mol−0.2 mol·L−1×10 L+0.1 mol=1.1 mol 根据电子守恒:0.1 mol×1+[n(NO)−0.1 mol]×3+n(NO2)×1= 1 28 L 22.4 L mol ×2 解得 n(NO)=0.8 mol,n(NO2)=0.3 mol V(NO)∶V(NO2)=n(NO)∶n(NO2)=0.8 mol∶0.3 mol=8∶3。 【解析】(1)①从图中知,NOx气体在电解时会转化成 HNO3,则 NO2中 N由+4价升高至+5价,失去 1个 e−,用 H+平衡电荷可写出电极反应式。②由电极反应式知,0.1 mol NO2生成 0.1 mol 3NO 和 0.2 mol H+,由电荷守恒可知,需要向左室流入 0.1 mol H+后才能维持右室中溶液为电中性。 (2)①m(HNO3)=10 L×0.2 mol·L−1×63 g·mol−1=126 g,则 V(浓硝酸)= 1 126 g 63% 1.4 g mL ≈143 mL。②由 N 原子守恒,最终生成的 HNO3和 HNO2中的总 N原子数等于 NO和 NO2中所含 N原子数与右室中原HNO3 中 N原子数总和,即 n(HNO3)+n(HNO2)=n(NO)+n(NO2)+10 L×0.2 mol·L−1(Ⅰ);电解过程中左、右两室中 得失电子是守恒的,左侧为 H+得电子生成 H2,右侧为 NO2失电子生成 HNO3,部分 NO失电子生成 HNO2, 部分 NO 失电子生成 HNO3,列式为 28 22.4 mol×2=1×n(NO2)+1×n(HNO2)+[n(NO)−n(HNO2)]×3(Ⅱ),联立 (Ⅰ)、(Ⅱ)可求出 NO和 NO2的物质的量,相同状态下,NO2和 NO的物质的量比即为其体积比。 电化学定量计算的三种方法 (1)根据电子守恒 用于串联电路中电解池阴阳两极产物、原电池正负两极产物、通过的电量等类型的计算,其依据是电 路中转移的电子数相等。 (2)根据总反应式 先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。 (3)根据关系式 根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。 考向五 电化学组合装置的问题 典例 5 如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向(乙)中滴入酚酞溶液, 在 F极附近显红色,则以下说法正确的是 A.电源 B极是正极 B.(甲)、(乙)装置的 C、D、E、F电极均有单质生成,其物质的量比为 1∶2∶2∶2 C.欲用(丙)装置给铜镀银,H应该是 Ag,电镀液是 AgNO3溶液 D.装置(丁)中 X极附近红褐色变深,说明氢氧化铁胶粒带负电荷 【解析】根据图知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色,说 明 F极附近有大量氢氧根离子,由此得出 F极上氢离子放电生成氢气,所以 F极是阴极,则电源 B极是负 极,A极是正极,A错误;甲装置中 C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质, E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的 C、D、E、F电极均 有单质生成;生成 1 mol氧气需要 4 mol电子,生成 1 mol铜时需要 2 mol电子,生成 1 mol氯气时需要 2 mol 电子,生成 1 mol氢气时需要 2 mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为 1∶2∶ 2∶2,B正确;若用(丙)装置给铜镀银,G应该是 Ag,H是铜,电镀液是 AgNO3溶液,C错误;丁装置中 Y电极是阴极,如果 Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,D错误。 【答案】B 5.某同学组装了如图所示的电化学装置,则下列说法正确的是 A.图中甲池为原电池装置,Cu电极发生还原反应 B.实验过程中,甲池左侧烧杯中的浓度不变 C.若甲池中 Ag电极质量增加 5.4 g时,乙池某电极析出 1.6 g 金属,则乙池中的某盐溶液可能是足量 AgNO3溶液 D.若用铜制 U形物代替“盐桥”,工作一段时间后取出 U形物称量,质量不变 【答案】D 【解析】图中甲池为原电池装置,Cu电极为负极发生氧化反应,故 A错误;实验过程中,盐桥中的 3NO 向左边移动,所以左侧烧杯中 3NO 的浓度变大,故 B错误;若甲池中 Ag电极质量增加 5.4 g时,即生 成银 5.4 g,物质的量为 5.4g 108g / mol =0.05 mol,所以整个电路转移电子 0.05 mol,如果硝酸银足量应生成 5.4 g银,故 C错误;用铜制 U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,由于整个电 路转移电子数相等,所以减少的质量与增加的质量相等,U形物的质量不变,故 D正确。 串联装置图比较 图甲中无外接电源,两者必有一个装置是原电池(相当于发电装置),为电解池装置提供电能,其中两个 电极活动性差异大者为原电池装置,即左图为原电池装置,右图为电解池装置。图乙中有外接电源,两烧 杯均作电解池,且串联电解,通过的电流相等。 1.某溶液中含有 Cu2+、Fe2+、Al3+、Cl-、NO- 3,且浓度均大于 0.1 mol/L,用石墨作电极进行电解时,肯 定得不到的产物是 A.Cl2 B.Al C.Cu D.H2 【答案】B 【解析】阴极上 Al3+、Fe2+的放电能力弱于 H+ ,而 Cu2+的放电能力比水电离出的 H+ 的放电能力强,阳 极上 Cl-放电能力强于 OH- 。 2.科研人员设计一种电化学反应器,以 Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为 电极材料。这种电催化膜反应器可用于正丙醇合成丙酸,装置示意图如图。以下叙述错误的是 A.微孔钛膜作阴极 B.使用 Na2SO4溶液是为了在电解开始时增强溶液导电性 C.丙醇转化为丙酸的电极反应式为:CH3CH2CH2OH+H2O-4e-===CH3CH2COOH+4H+ D.反应器工作时料槽中正丙醇分子向电催化膜移动 【答案】A 【解析】微孔钛膜与电源正极相连,作阳极,A项错误;Na2SO4为强电解质,使用 Na2SO4溶液是为了 在电解开始时增强溶液导电性,B项正确;丙醇转化为丙酸,发生氧化反应:CH3CH2CH2OH+H2O-4e -===CH3CH2COOH+4H+,C项正确;反应器工作时,正丙醇发生氧化反应,根据阳极上发生氧化反应, 知正丙醇分子向电催化膜移动,D项正确。 3.MnO2常用于电池工业,现电解含MnSO4的某工业废液来制备 Mn 和MnO2,装置如图,下列说法不正 确的是 A.电极 b发生氧化反应 B.电极 a、b均可用石墨作电极,且通电一段时间后,左、右两边溶液的 pH均减小 C.通电时,溶液中的 S 通过离子交换膜向右移动 D.电极 b的电极反应式为:Mn2+-2e-+2H2O MnO2+4H+ 【答案】B 【解析】本题考查电化学知识,意在考查考生对电解池原理的理解能力。阳极发生氧化反应,MnSO4中 锰元素的化合价升高,由此推断阳极的主要产物是 MnO2,故阳极的电极反应式为 Mn2+-2e-+2H2O MnO2+4H+,故 A、D 项正确;由上述分析知,阳极有 H+生成,溶液 pH减小,阴极的电极反应式为: Mn2++2e- Mn,溶液的 pH无明显变化,故 B项错误;由于两池的 pH不同,故离子交换膜为阴离子 交换膜,溶液中 S 由左向右移动,C项正确。 4.世界某著名学术刊物近期介绍了一种新型中温全瓷铁-空气电池,如图所示。下列说法正确的是 A.放电时,a极发生氧化反应 B.充电时,负极室发生反应:Fe+xH2O(g) FeOx+xH2 C.充电时,a极发生反应:4OH--4e- 2H2O+O2↑ D.放电时,b极发生反应:H2+O2--2e- H2O 【答案】D 【解析】本题考查原电池原理和电解池原理。放电时,a 极上空气中的氧气得电子,发生还原反应,电 极反应式为:O2+4e- 2O2-,则充电时,a极发生反应:2O2--4e- O2↑,A、C错误;由题图可知,放电 时,负极室发生的反应为 xH2O(g)+ +xH2,则充电时发生的反应为 FeOx+xH2 xH2O(g)+Fe, B错误;放电时,b极上氢气失电子发生氧化反应:H2+O2--2e- H2O,D正确。 5.500 mL KNO3和 Cu(NO3)2的混合溶液中,c( 3NO )=6.0 mol/L。用石墨作电极电解此溶液,当通电一段时 间后,两极都收集到 22.4 L气体(标准状况)。假设电解后溶液的体积仍为 500 mL。下列说法正确的是 A.原混合溶液中 K+ 的浓度为 1 mol/L B.上述电解过程中共转移 4 mol电子 C.电解得到的 Cu的物质的量为 0.5 mol D.电解后溶液中 H+ 的浓度为 2 mol/L 【答案】B 【解析】用石墨作电极电解混合溶液,阳极发生氧化反应 2H2O−4e− O2↑+4H+,由于两个电极都收集 到了气体,因此阴极反应式为:Cu2++2e− Cu,2H++2e− H2↑。由于两极均收集到 22.4 L气体(标 准状况),即 1 mol气体,故转移电子的物质的量为 4 mol;生成 H2需要电子为 2 mol,因此 Cu2+的物质 的量为 1 mol,浓度为 2 mol·L−1,生成 Cu 单质为 1 mol;根据溶液中电荷守恒可知 c(K+)=6.0 mol·L−1−2 mol·L−×2=2 mol·L−1;由于阳极生成氧气,同时生成 4 mol H+,而阴极上只消耗了 2 mol,因此电解后溶 液中的 H+物质的量为 2 mol,由于电解后溶液的体积为 500 mL,因此电解后溶液中 c(H+)为 4 mol·L−1。 由上述分析可知,A.原混合溶液中 c(K+)为 2 mol·L−1,A错误;B.上述电解过程中共转移 4 mol电子, B正确;C.电解得到的 Cu的物质的量为 1 mol,C错误;D.电解后溶液中的 c(H+)为 4 mol·L−1,D错 误。答案为 B。 6.如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH===2K2CO3+6H2O。下列说法正确的是 A.甲池通入 CH3OH的电极反应式为 CH3OH+6e-+2H2O===CO2-3 +8H+ B.反应一段时间后,向乙池中加入一定量 Cu(OH)2固体,能使 CuSO4溶液恢复到原浓度 C.甲池中消耗 224 mL(标准状况)O2,此时丙池中理论上产生 1.16 g 固体 D.若将乙池电解质溶液换成 AgNO3溶液,则可以实现在石墨棒上镀银 【答案】C 【解析】甲池通入 CH3OH的电极发生氧化反应:CH3OH-6e-+8OH-===CO2-3 +6H2O,A项错误;乙 池中石墨作阳极,Ag作阴极,电解总反应为 2CuSO4+2H2O 2Cu+O2↑+2H2SO4,由于 CuSO4溶液 过量,溶液中减少的是“2Cu+O2↑”,因此加入 CuO或 CuCO3能使原溶液恢复到原浓度,B项错误;丙 池中的总反应为MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑,根据各电极上转移电子数相同,可得关系 式:O2~4e-~2Mg(OH)2,丙池中产生Mg(OH)2固体的质量为 0.224 L 22.4 L·mol-1 ×2×58 g·mol-1=1.16 g, C项正确;石墨棒作阳极,Ag作阴极,只能在银极上镀银,D项错误。 7.某混合物浆液含有 Al(OH)3、MnO2和少量 Na2CrO4。考虑到胶体的吸附作用使 Na2CrO4不易完全被水浸 出,某研究小组利用设计的电解分离装置(如图所示),使浆液分离成固体混合物和含铬元素溶液,并回收 利用。 用惰性电极电解时,CrO42-能从浆液中分离出来的原因是_________________________,分离后含铬元素的 粒子是__________,阴极室生成的物质为__________(写化学式)。 【答案】CrO42-通过阴离子交换膜进入阳极室 CrO42-、Cr2O72- H2、NaOH 【分析】电解时,CrO42-通过阴离子交换膜向阳极移动,阴极发生还原反应生成氢气和 NaOH,以此解答该 题。 【详解】 电解时,CrO42-通过阴离子交换膜向阳极移动,从而从浆液中分离出来,因存在 2CrO42-+2H+⇌Cr2O72-+H2O, 则分离后含铬元素的粒子是 CrO42-、Cr2O72-,阴极发生还原反应生成氢气和 NaOH,故答案为:CrO42-通过 阴离子交换膜进入阳极室;CrO42-、Cr2O72-;NaOH和 H2。 8.用零价铁 Fe 去除水体中的硝酸盐 3NO 已成为环境修复研究的热点之一. 1 Fe还原水体中 3NO 的反应原理如图 1所示. ①作负极的物质是______. ②正极的电极反应式是______. 2 将足量铁粉投入水体中,经 24小时测定 3NO 的去除率和 pH,结果如下: 初始 pH pH 2.5 pH 4.5 3NO 的去除率 接近100% 50% 24小时 pH 接近中性 接近中性 铁的最终物质形态 pH 4.5 时, 3NO 的去除率低.其原因是______. 3 实验发现:在初始 pH 4.5 的水体中投入足量铁粉的同时,补充一定量的 2Fe 可以明显提高 3NO 的去 除率.对 2Fe 的作用提出两种假设: Ⅰ 2.Fe 直接还原 3NO ; Ⅱ 2.Fe 破坏 FeO OH 氧化层. ①做对比实验,结果如图 2所示,可得到的结论是______. ②同位素示踪法证实 2Fe 能与 FeO OH 反应生成 3 4Fe O .结合该反应的离子方程式,解释加入 2Fe 提高 3NO 去除率的原因:______. 4 其他条件与 2 相同,经 1小时测定 3NO 的去除率和 pH,结果如表: 初始 pH pH 2.5 pH 4.5 3NO 的去除率 约10% 约3% 1小时 pH 接近中性 接近中性 与 2 中数据对比,解释 2 中初始 pH不同时, 3NO 去除率和铁的最终物质形态不同的原因:______. 【答案】铁 3 4 2NO 8e 10H NH 3H O FeO OH 不导电,阻碍电子转移 本实验条件 下, 2Fe 不能直接还原 3NO ;在 Fe 和 2Fe 共同作用下能提高 3NO 的去除率 2 3 4Fe 2FeO OH Fe O 2H , 2Fe 将不导电的 FeO OH 转化为可导电的 3 4Fe O ,利于电子转移 初始 pH低时,产生的 2Fe 充足;初始 pH高时,产生的 2Fe 不足 【分析】 (1) NO3-在正极得电子发生还原反应产生 NH4+ ,根据图 2信息可知为酸性环境;(2)pH越高 Fe3+越易水解 生成 FeO(OH); (3)①根据图 2中的三个实验结果进行分析; ②结合(2)题中的铁的最终物质形态结果差异进行分析; 【详解】 (1) ①Fe还原水体中 3NO ,则 Fe 作还原剂发生氧化反应,失去电子,作负极, 故答案为:铁; 3NO② 在正极得电子发生还原反应产生 4NH ,根据图 2信息可知为酸性环境,则正极的电极反应式为: 3 4 2NO 8e 10H NH 3H O ,故答案为: 3 4 2NO 8e 10H NH 3H O ; (2)①加入 2Fe 可以显提高 3NO 的去除率,pH越高, 3Fe 越易水解生成 FeO OH ,而 FeO OH 不导 电,阻碍电子转移,所以 3NO 的去除率低,故答案为: FeO OH 不导电,阻碍电子转移; (3)从图 2的实验结果可以看出,单独加入 2Fe 时, 3NO 的去除率为 0,因此得出 2Fe 不能直接还原 3NO ; 而 Fe和 2Fe 共同加入时 3NO 的去除率比单独 Fe 高,因此可以得出结论:本实验条件下, 2Fe 不能直接 还原 3NO ;在 Fe 和 2Fe 共同作用下能提高 3NO 的去除率,故答案为:本实验条件下, 2Fe 不能直接还 原 3NO ;在 Fe和 2Fe 共同作用下能提高 3NO 的去除率; ②同位素示踪法证实了 2Fe 能与 FeO OH 反应生成 3 4Fe O ,离子方程式为: 2 3 4Fe 2FeO OH Fe O 2H , 2Fe 将不导电的 FeO OH 转化为可导电的 3 4Fe O ,利于电子转移, 故答案为: 2 3 4Fe 2FeO OH Fe O 2H , 2Fe 将不导电的 FeO OH 转化为可导电的 3 4Fe O ,利于 电子转移; (4)根据实验结果可知 2Fe 的作用是将不导电的 FeO OH 转化为可导电的 3 4Fe O ,而 3NO 的去除率由 铁的最终物质形态确定,因此可知实验初始 pH会影响 2Fe 的含量,故答案为:初始 pH低时,产生的 2Fe 充足;初始 pH高时,产生的 2Fe 不足。 1.[2020新课标Ⅱ]电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意 图。当通电时,Ag+注入到无色WO3薄膜中,生成 AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错 误的是 A.Ag为阳极 B.Ag+由银电极向变色层迁移 C.W元素的化合价升高 D.总反应为:WO3+xAg=AgxWO3 【答案】C 【分析】 从题干可知,当通电时,Ag+注入到无色WO3薄膜中,生成 AgxWO3器件呈现蓝色,说明通电时,Ag电极 有 Ag+生成然后经固体电解质进入电致变色层,说明 Ag电极为阳极,透明导电层时阴极,故 Ag电极上发 生氧化反应,电致变色层发生还原反应。 【详解】 A.通电时,Ag电极有 Ag+生成,故 Ag电极为阳极,故 A项正确; B.通电时电致变色层变蓝色,说明有 Ag+从 Ag电极经固体电解质进入电致变色层,故 B项正确; C.过程中,W由WO3的+6价降低到 AgxWO3中的+(6-x)价,故 C项错误; D.该电解池中阳极即 Ag电极上发生的电极反应为:xAg-xe- = xAg+,而另一极阴极上发生的电极反应为: WO3+xAg++xe- = AgxWO3,故发生的总反应式为:xAg + WO3 =AgxWO3,故 D项正确; 答案选 C。 2.[2018新课标Ⅰ]最近我国科学家设计了一种 CO2+H2S 协同转化装置,实现对天然气中 CO2和 H2S 的高 效去除。示意图如图所示,其中电极分别为 ZnO@石墨烯(石墨烯包裹的 ZnO)和石墨烯,石墨烯电极 区发生反应为: ①EDTA-Fe2+-e-=EDTA-Fe3+ ②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+ 该装置工作时,下列叙述错误的是 A.阴极的电极反应:CO2+2H++2e-=CO+H2O B.协同转化总反应:CO2+H2S=CO+H2O+S C.石墨烯上的电势比 ZnO@石墨烯上的低 D.若采用 Fe3+/Fe2+取代 EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性 【答案】C 【解析】该装置属于电解池,CO2在 ZnO@石墨烯电极上转化为 CO,发生得到电子的还原反应,为阴极, 石墨烯电极为阳极,发生失去电子的氧化反应,据此解答。 A、CO2在 ZnO@石墨烯电极上转化为 CO,发生得到电子的还原反应,为阴极,电极反应式为 CO2+H+ +2e-=CO+H2O,A正确; B、根据石墨烯电极上发生的电极反应可知①+②即得到 H2S-2e-=2H++S,因此总反应式为 CO2+H2S =CO+H2O+S,B正确; C、石墨烯电极为阳极,与电源的正极相连,因此石墨烯上的电势比 ZnO@石墨烯电极上的高,C错误; D、由于铁离子、亚铁离子均易水解,所以如果采用 Fe3+/Fe2+取代 EDTA-Fe3+/EDTA-Fe2+,溶液需要酸 性,D正确。答案选 C。 点睛:准确判断出阴阳极是解答的关键,注意从元素化合价变化的角度去分析氧化反应和还原反应,进 而得出阴阳极。电势高低的判断是解答的难点,注意从物理学的角度借助于阳极与电源的正极相连去分 析。 3.[2017 新课标Ⅱ]用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为 2 4 2 2 4H SO H C O 混合溶液。下列叙述错误的是 A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为: 3Al 3e ===Al D.硫酸根离子在电解过程中向阳极移动 【答案】C 【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故 A说法正确;B、 不锈钢网接触面积大,能增加电解效率,故 B说法正确;C、阴极应为阳离子得电子,根据离子放电顺 序应是 H+ 放电,即 2H+ +2e− H2↑,故 C说法错误;D、根据电解原理,电解时,阴离子移向阳极, 故 D说法正确。 【名师点睛】本题考查电解原理的应用,如本题得到致密的氧化铝,说明铝作阳极,因此电极方程式应 是 2Al−6e−+3H2O Al2O3+6H+,这就要求学生不能照搬课本知识,注意题干信息的挖掘,本题难度 不大。 4.[2017海南]一种电化学制备 NH3的装置如图所示,图中陶瓷在高温时可以传输 H+。下列叙述错误的是 A.Pd电极 b为阴极 B.阴极的反应式为:N2+6H++6e− 2NH3 C.H+由阳极向阴极迁移 D.陶瓷可以隔离 N2和 H2 【答案】A 【解析】A、此装置为电解池,总反应是 N2+3H2 2NH3,Pd 电极 b 上是氢气发生反应,即氢气失 去电子化合价升高,Pd 电极 b为阳极,故 A说法错误;B、根据 A选项分析,Pd 电极 a 为阴极,反应 式为 N2+6H++6e− 2NH3,故 B说法正确;C、根据电解池的原理,阳离子在阴极上放电,即有阳 极移向阴极,故 C说法正确;D、根据装置图,陶瓷隔离 N2和 H2,故 D说法正确。 【名师点睛】本题考查电解原理,首先判断阴阳两极,阴极连接电源的负极,阴极上得到电子化合价降 低,发生还原反应,阳极连接电源的正极,阳极上失去电子化合价升高,发生氧化反应,然后判断电极 材料,惰性电极还是活动性金属作电极,活动性金属作阳极,活动性金属先失电子,如果是惰性材料作 阳极,则是还原性强的阴离子先失电子,氧化性强的离子在阴极上得电子;电极反应式的书写是高考的 热点,一般需要根据装置图完成,需要看清反应环境。 5.[2016·北京]用石墨电极完成下列电解实验。下列对实验现象的解释或推测不合理的是 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部褪色;c 处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产 生;…… A.a、d处:2H2O+2e− H2↑+2OH− B.b处:2Cl−−2e− Cl2↑ C.c处发生了反应:Fe−2e− Fe2+ D.根据实验一的原理,实验二中m处能析出铜 【答案】B 【解析】本题结合实验考查电化学知识,意在考查考生对电解池的熟练程度和分析能力。由于有外接电 源,所以实验一和实验二均为电解池装置。实验一中,铁丝中的电流方向为从d到c,电子移动方向为从c 到d,所以实验一的装置是比较复杂的电解池,其中a为阴极,c为阳极,d为阴极,b为阳极。a、d处发生 反应2H2O+2e− H2↑+2OH−,A项正确;若b处发生反应2Cl−−2e− Cl2↑,不足以解释b处“变红”和“褪 色”现象,故B项错误;c处铁作阳极,发生反应Fe−2e− Fe2+,由于生成的Fe2+浓度较小,且pH试纸本 身有颜色,故颜色上无明显变化,C项正确;实验二是一个更加复杂的电解池装置,两个铜珠的左端均 为阳极,右端均为阴极,初始时两个铜珠的左端(阳极)均发生反应Cu−2e− Cu2+,右端(阴极)均发生反 应2H++2e− H2↑,一段时间后,Cu2+移动到m和n处,m、n处附近Cu2+浓度增大,发生反应Cu2++2e− Cu,m、n处能生成铜,D正确。 6.[2016·新课标Ⅰ]三室式电渗析法处理含 Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子 交换膜,在直流电场的作用下,两膜中间的 Na+和 2 4SO 可通过离子交换膜,而两端隔室中离子被阻挡不 能进入中间隔室。 下列叙述正确的是 A.通电后中间隔室的 2 4SO 离子向正极迁移,正极区溶液 pH增大 B.该法在处理含 Na2SO4废水时可以得到 NaOH和 H2SO4产品 C.负极反应为 2H2O−4e− O2+4H+,负极区溶液 pH降低 D.当电路中通过 1 mol电子的电量时,会有 0.5 mol的 O2生成 【答案】B 【解析】本题考查电解池原理,意在考查考生运用所学知识分析、解决问题的能力。该装置为电解池。 H2O在正(阳)极区放电,生成 O2和 H+,中间隔室中的阴离子 2 4SO 通过 cd膜移向正(阳)极,故正(阳)极 区得到 H2SO4,当电路中通过 1 mol电子时生成 0.25 mol O2,正(阳)极区溶液 pH减小,H2O在负(阴)极 区放电,生成 OH−和 H2,负(阴)极区溶液 pH增大,A、C、D项错误。H2O在负(阴)极区放电生成 H2和 OH−,中间隔室中的阳离子 Na+通过 ab膜移向负(阴)极,故负(阴)极区可得到 NaOH,而正(阳)极区可得 到 H2SO4,故 B项正确。查看更多