- 2021-07-06 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习鲁科版气体的制法及其性质探究作业
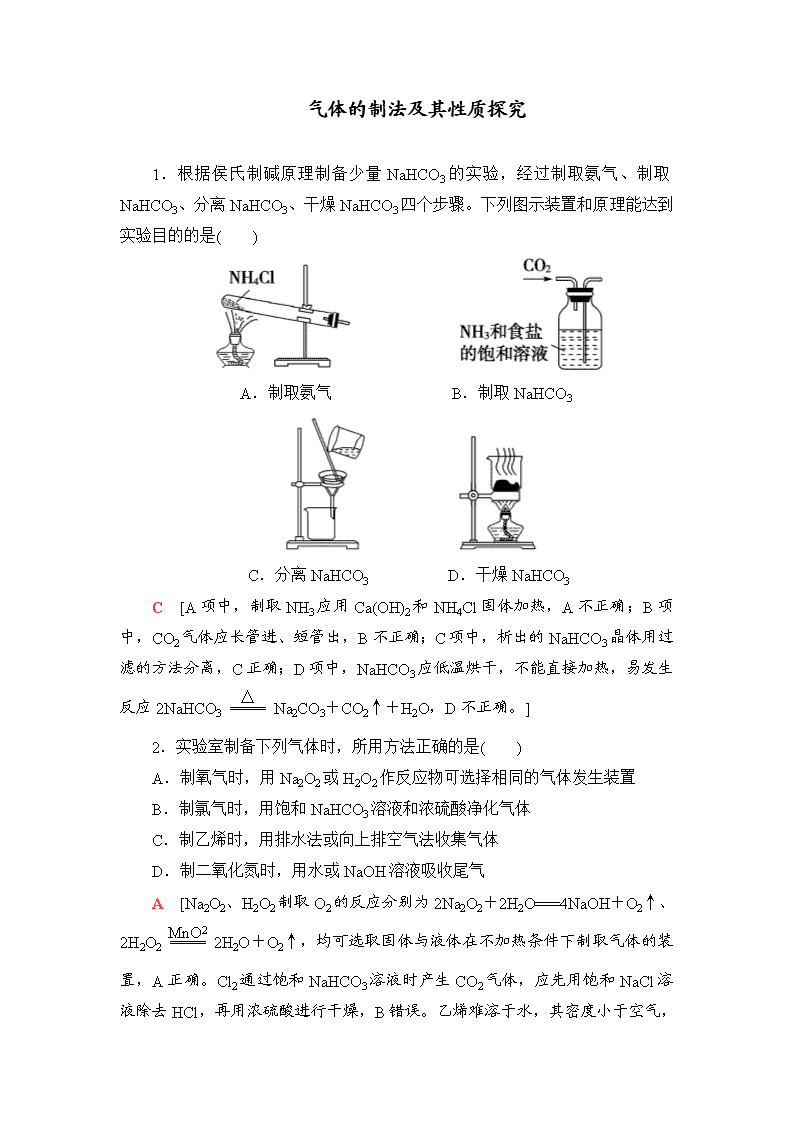
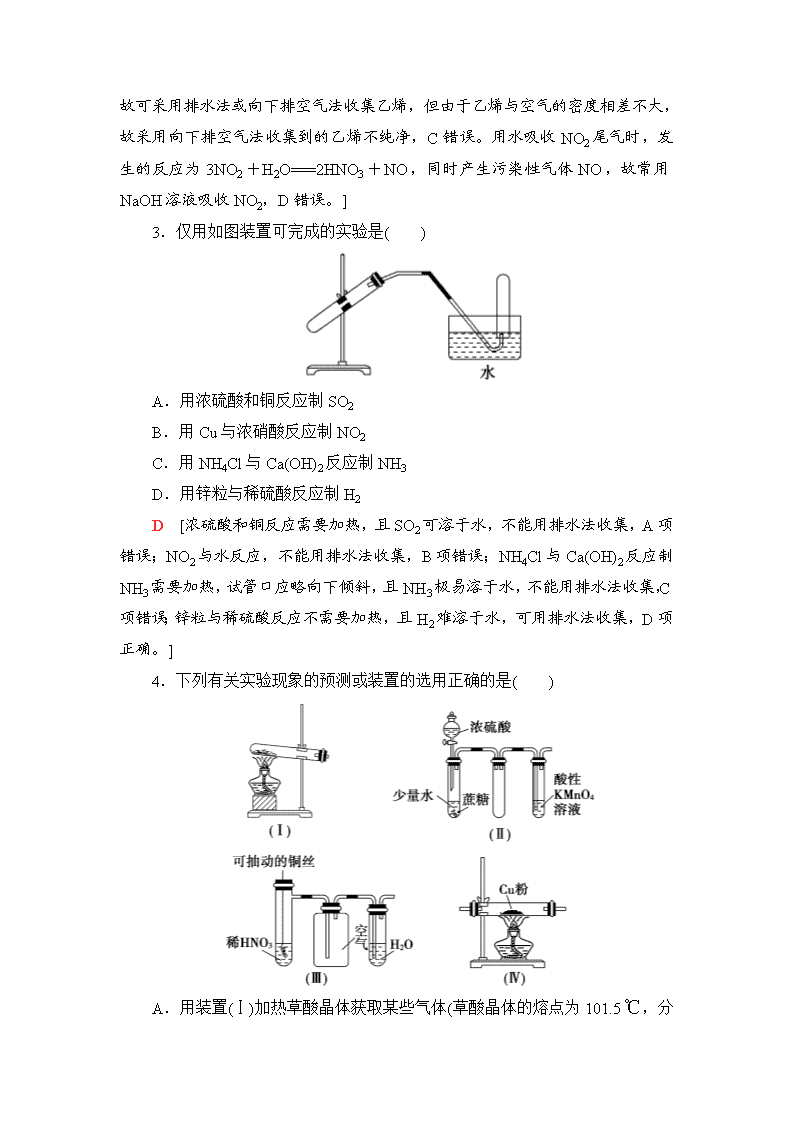
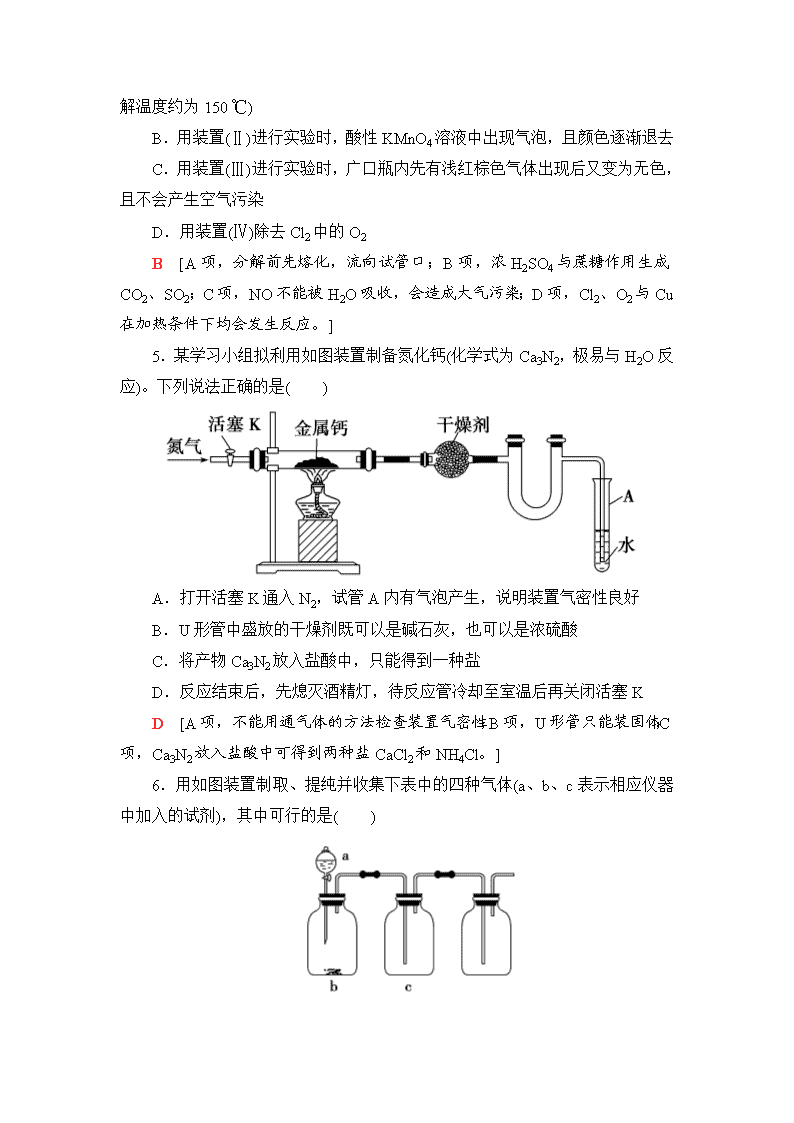
气体的制法及其性质探究 1.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( ) A.制取氨气 B.制取NaHCO3 C.分离NaHCO3 D.干燥NaHCO3 C [A项中,制取NH3应用Ca(OH)2和NH4Cl固体加热,A不正确;B项中,CO2气体应长管进、短管出,B不正确;C项中,析出的NaHCO3晶体用过滤的方法分离,C正确;D项中,NaHCO3应低温烘干,不能直接加热,易发生反应2NaHCO3Na2CO3+CO2↑+H2O,D不正确。] 2.实验室制备下列气体时,所用方法正确的是( ) A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 C.制乙烯时,用排水法或向上排空气法收集气体 D.制二氧化氮时,用水或NaOH溶液吸收尾气 A [Na2O2、H2O2制取O2的反应分别为2Na2O2+2H2O===4NaOH+O2↑、2H2O22H2O+O2↑,均可选取固体与液体在不加热条件下制取气体的装置,A正确。Cl2通过饱和NaHCO3溶液时产生CO2 气体,应先用饱和NaCl溶液除去HCl,再用浓硫酸进行干燥,B错误。乙烯难溶于水,其密度小于空气,故可采用排水法或向下排空气法收集乙烯,但由于乙烯与空气的密度相差不大,故采用向下排空气法收集到的乙烯不纯净,C错误。用水吸收NO2尾气时,发生的反应为3NO2+H2O===2HNO3+NO,同时产生污染性气体NO,故常用NaOH溶液吸收NO2,D错误。] 3.仅用如图装置可完成的实验是( ) A.用浓硫酸和铜反应制SO2 B.用Cu与浓硝酸反应制NO2 C.用NH4Cl与Ca(OH)2反应制NH3 D.用锌粒与稀硫酸反应制H2 D [浓硫酸和铜反应需要加热,且SO2可溶于水,不能用排水法收集,A项错误;NO2与水反应,不能用排水法收集,B项错误;NH4Cl与Ca(OH)2反应制NH3需要加热,试管口应略向下倾斜,且NH3极易溶于水,不能用排水法收集,C项错误;锌粒与稀硫酸反应不需要加热,且H2难溶于水,可用排水法收集,D项正确。] 4.下列有关实验现象的预测或装置的选用正确的是( ) A.用装置(Ⅰ)加热草酸晶体获取某些气体(草酸晶体的熔点为101.5 ℃ ,分解温度约为150 ℃) B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐退去 C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产生空气污染 D.用装置(Ⅳ)除去Cl2中的O2 B [A项,分解前先熔化,流向试管口;B项,浓H2SO4与蔗糖作用生成CO2、SO2;C项,NO不能被H2O吸收,会造成大气污染;D项,Cl2、O2与Cu在加热条件下均会发生反应。] 5.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与H2O反应)。下列说法正确的是( ) A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 B.U形管中盛放的干燥剂既可以是碱石灰,也可以是浓硫酸 C.将产物Ca3N2放入盐酸中,只能得到一种盐 D.反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K D [A项,不能用通气体的方法检查装置气密性;B项,U形管只能装固体;C项,Ca3N2放入盐酸中可得到两种盐CaCl2和NH4Cl。] 6.用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) 选项 气体 a b c A NO2 浓硝酸 铜片 NaOH溶液 B CO2 稀硫酸 石灰石 饱和NaHCO3溶液 C O2 双氧水 二氧化锰 浓硫酸 D NH3 浓氨水 生石灰 碱石灰 C [氢氧化钠溶液吸收NO2,A项不可行;石灰石与稀硫酸反应生成的硫酸钙覆盖在石灰石表面,阻止反应进行,B项不可行;碱石灰不能盛装在c中,D项不可行。] 7.根据下列仪器制备中学常见的气体: 请回答下列问题: (1)选择仪器A制备气体并经后续装置测量气体体积时,其优点是________________________________________________ _____________________________________________________________; 制备气体并控制反应需要选择仪器________(填代号,下同)。 (2)实验室制备CO的原理:HCOOHCO↑+H2O,发生装置选择________;干燥装置选择________;收集装置选择________。 (3)实验室制备氨气,发生装置选择________;干燥装置选择________;收集装置选择________。 (4)FeC2O4·2H2O发生分解反应:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O↑ 为了检验草酸亚铁晶体分解的部分气态产物,选择仪器并排序(气流从左至右):________。不能检验的气体是________。 【解析】 (1)A仪器可保持烧瓶内气压与分液漏斗内气压相等,确保液体能顺利滴下;测量的气体体积等于发生反应生成的气体体积,扣除了加入液体时排出的气体的体积。B仪器能控制反应,实现随制随停(利用大气压原理,控制固体和液体接触与脱离)。(2)用浓硫酸或碱石灰干燥CO;CO有毒、密度与空气相近,选择排水法收集CO。(3)氨气密度小于空气,可以用向下排空气法收集,选择H,也可以用排煤油法收集,选择F或G。(4)实验室用无水硫酸铜检验水蒸气,用澄清石灰水检验CO2,所给仪器不能检验CO。可用炽热氧化铜和澄清石灰水检验CO。 【答案】 (1)液体顺利滴下、测定气体的体积已扣除加入液体所占体积 B (2)C G(或J) F(或G) (3)D J H(或F或G) (4)D、J、G CO 8.氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。 请回答下列问题: (1)请选择必要的装置,按气流方向连接顺序为_______________________ (填仪器接口的字母编号)。 (2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;________(请按正确的顺序填入下列步骤的标号)。 A.加热反应一段时间 B.收集气体并检验其纯度 C.关闭分液漏斗活塞 D.停止加热,充分冷却 (3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。 ①写出CaH2与水反应的化学方程式____________________________ _____________________________________________________________; ②该同学的判断不准确,原因是_________________________________ _____________________________________________________________。 (4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____________________________________________________ _____________________________________________________________ _____________________________________________________________ _____________________________________________________________。 (5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_____________________________________________________________ _____________________________________________________________。 【解析】 本题主要考查制取氢化钙的实验步骤、实验装置的连接以及氢化钙的鉴别与用途,意在考查考生的实验操作、探究能力。(1)用盐酸和锌反应制取氢气,再与钙反应得氢化钙,其中通氢气前要除去杂质HCl并干燥除去水,制取氢化钙的装置要与盛有无水氯化钙的干燥管连接,从而防止空气中的水蒸气与其反应。(2)首先收集氢气并验纯,然后加热反应,最后关闭活塞。(3)氢化钙与水反应生成氢氧化钙和氢气,方程式为CaH2+2H2O===Ca(OH)2+2H2↑,金属钙与水反应也生成氢氧化钙和氢气。(4)区别金属钙和氢化钙,可根据氢化钙中含有氢元素,让其燃烧生成水,并用无水硫酸铜来检验。 【答案】 (1)i→e,f→d,c→j(或k),k(或j)→a (2)BADC (3)①CaH2+2H2O===Ca(OH)2+2H2↑ ②金属钙与水反应也有类似现象 (4)取适量氢化钙,在加热条件下与干燥的氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管中,观察到固体由白色变为蓝色;取钙做类似实验,观察不到固体由白色变为蓝色 (5)氢化钙是固体,携带方便 9.三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33 ℃,沸点:73 ℃。实验室可用如图装置制取ICl3。 (1)仪器a的名称是________。 (2)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为_________________________________________________ _____________________________________________________________。 (3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象是___________________________________。 (4)试剂X为________。 (5)氯气与单质碘反应温度稍低于70 ℃,则装置D适宜的加热方式为_____________________________________________________________。 【解析】 (2)次氯酸钙与浓盐酸可发生氯元素的“归中反应”生成Cl2。(3)C中发生堵塞时,B中吸滤瓶内压强增大,可将饱和食盐水“压”入长颈漏斗。(5)低于100 ℃的反应适宜用水浴加热。 【答案】 (1)蒸馏烧瓶 (2)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O (3)吸滤瓶中液面下降,长颈漏斗中液面上升 (4)碱石灰 (5)水浴加热 10.某课题组设计实验检验生铁与浓硫酸反应的产物。 (1)设计如下方案,检验气体产物中的CO2、SO2和H2O。 ①干燥管中M的化学式是_________________________________。 ②C装置的作用是_______________________________________________。 ③能证明有二氧化碳生成的实验现象是_____________________________ _____________________________________________________________。 (2)该课题组同学认为生铁与浓硫酸反应可能有氢气生成。为了验证这一猜想,选择下列仪器和药品并结合上述装置,重新设计实验。 ①根据实验设计的简约性原则,气流从左至右,仪器排序为________________。 ②能证明有氢气生成的实验现象是_______________________________ _____________________________________________________________。 (3)待生铁与浓硫酸反应完毕后,取出A装置烧瓶中的溶液于两支试管中,一支试管中滴加铁氰化钾溶液,产生蓝色沉淀;另一支试管中滴加KSCN溶液,溶液变红色。对该溶液中金属离子的推断合理的是________。 a.一定含Fe2+,一定不含Fe3+ b.一定含Fe2+,可能含Fe3+ c.一定含有Fe2+和Fe3+ d.可能含Fe2+,一定含Fe3+ 【解析】 (1)①用无水硫酸铜检验产物中的水。②足量酸性高锰酸钾溶液有三个作用:检验SO2、除去SO2、检验SO2是否除尽。③SO2已除尽的依据是C中溶液颜色变浅,但不退色。若酸性高锰酸钾溶液退色,则SO2可能未完全反应,会干扰CO2的检验。C中溶液颜色变浅,D中溶液变浑浊可证明有CO2生成。(2)①用氢氧化钠溶液吸收SO2、CO2;用澄清石灰水检验CO2、SO2是否完全被除去;用浓硫酸除去水蒸气;用剩余的气体还原氧化铜;用无水硫酸铜检验是否有H2O生成。②若有氢气生成,则氧化铜会被还原成铜,无水硫酸铜吸水变成蓝色晶体。(3)铁氰化钾溶液检验有Fe2+存在,KSCN溶液检验有Fe3+存在。 【答案】 (1)①CuSO4 ②检验和除去SO2、确认SO2已除尽 ③C中溶液颜色变浅,D中溶液变浑浊 (2)①AEHFJG ②J中黑色粉末变成红色、G中白色粉末变成蓝色 (3)c 11.工业上常用亚硝酸钠(NaNO2)作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备NaNO2并探究NO、NO2的某一化学性质(A中加热装置已略去)。 已知:①2NO+Na2O2===2NaNO2; ②NO能被酸性KMnO4氧化成NO,MnO被还原为Mn2+。 请回答下列问题: (1)装置A三颈烧瓶中发生反应的化学方程式为________________________ _____________________________________________________________。 (2)用上图中的装置制备NaNO2,其连接顺序为:a→________→h(按气流方向,用小写字母表示),此时活塞K1、K2如何操作______________________ _____________________________________________________________。 (3)E装置发生反应的离子方程式是_________________________ _____________________________________________________________。 (4)通过查阅资料,NO2或NO可能与溶液中Fe2+发生反应。某同学选择上述装置并按A→C→E顺序连接,E中装入FeSO4溶液,进行如下实验探究。 步骤 操作及现象 ① 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色。 ② 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间。 ③ 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同。 步骤②操作的目的是________;步骤③C瓶中发生的化学方程式为____________________;通过实验可以得出:________(填“NO2、NO中的一种或两种”)和溶液中Fe2+发生反应使溶液呈深棕色。 【解析】 (1)Cu与浓HNO3反应生成NO2,配平方程式即可。 (2)A生成的NO2,根据已知①可知,生成的NO2先通入C中的水中生成NO,然后干燥除去H2O与Na2O2反应的干扰,制备NaNO2,最后用酸性KMnO4吸收尾气NO。在操作时注意反应装置中空气的排尽。 (3)根据化合价升降配平离子方程式。 (4)根据②③实验可知NO和Fe2+反应。 【答案】 (1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O (2)d→e→b(或c)→c(或b)→f(或g)→g(或f) 关闭K1,打开K2 (3)3MnO+4H++5NO===3Mn2++5NO+2H2O (4)排尽装置中残留的NO2 3NO2+H2O===2HNO3+NO NO查看更多