- 2021-07-06 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省三明市三地三校2019-2020学年高二上学期期中联考化学试题
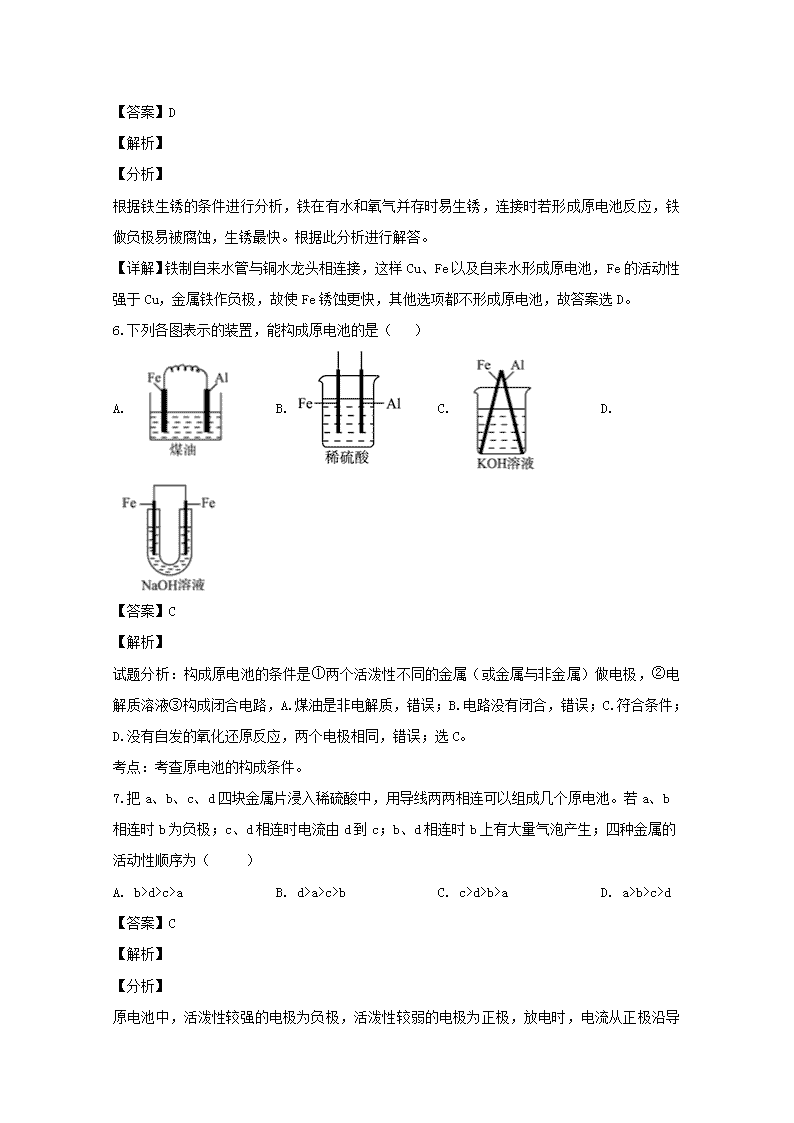
2019-2020学年第一学期三明市三地三校联考协作卷 高二化学 可能用到的相对原子质量:Cu:64 Ag:108 (满分100分,完卷时间90分钟) 一、 单选题(每小题只有一个正确答案,每小题2分,共44分) 1.下列有关能量转化的认识不正确的是( ) A. 人类使用照明设备,利用电能转化为光能 B. 燃料燃烧,只是将化学能转化成热能 C. 使用清洁能源是防止酸雨发生的措施之一 D. 通过植物的光合作用,太阳能转化为化学能 【答案】B 【解析】 【详解】A.照明需要光能,人类使用照明设备是将电能转化为光能,故A选项正确。 B.燃烧是剧烈的发光放热的氧化还原反应,过程中还可以变为光能、热能等,故B选项错误。 C.使用清洁能源可以减少化石燃料的使用,减少二氧化硫的排放,是防止酸雨发生的重要措施之一,故C选项正确。 D.植物的光合作用是绿色植物和藻类利用叶绿素等光合色素和某些细菌利用其细胞本身,在可见光的照射下,将二氧化碳和水(细菌为硫化氢和水)转化为有机物,并释放出氧气(细菌释放氢气)的生化过程,使得太阳能转化为了化学能,故D选项正确。 故答案选B。 2.下列反应属于吸热反应的是( ) A. 乙醇燃烧 B. 盐酸和氢氧化钠的中和反应 C. Ba(OH)2·8H2O与NH4Cl反应 D. 锌粒与稀H2SO4反应制取H2 【答案】C 【解析】 【详解】A.乙醇燃烧是氧化反应,是常见放热反应,故A错误; B.盐酸与氢氧化钠溶液是酸碱中和反应,是放热反应,故B错误; C.Ba(OH)2•8H2O与NH4Cl反应是吸热反应,故C正确; D.锌粒与稀H2SO4反应制取H2是金属与酸反应,放热反应,故D正确; 故答案选C。 3.燃烧0.5mol乙醇(液态)生成二氧化碳气体和液态水放出的热量为QkJ,则乙醇燃烧的热化学方程式书写正确的是( ) A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -2QkJ B. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H =- QkJ·mol—1 C. 1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -Q kJ·mol—1 D. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H =-2Q kJ·mol—1 【答案】C 【解析】 【详解】A.△H 的单位应该为 kJ·mol—1,故A错误; B.0.5mol乙醇(液态)生成二氧化碳气体和液态水放出的热量为QkJ,现1mol△H 乙醇(液态)生成二氧化碳气体和液态水,△H应该等于-2QkJ·mol—1,故B错误; C.由分析可知C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l) △H = -2Q kJ·mol—1,则1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -Q kJ·mol—1,故C正确; D.生成二氧化碳气体和液态水,不是气态水,故D错误; 故答案选C。 【点睛】注意燃烧热的概念为1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,故对于本题来说产物为气态二氧化碳和液态水。 4.在一定条件下,已知:C(s)+O2(g)═CO2(g)ΔH1 2C(s)+O2(g)═2CO(g)ΔH2 C(s)+CO2(g)═2CO(g)ΔH3 则ΔH3与ΔH1和ΔH2间的关系正确的是( ) A. ΔH3=ΔH1+2ΔH2 B. ΔH3=ΔH1+ΔH2 C. ΔH3=ΔH1-2ΔH2 D. ΔH3=ΔH2-ΔH1 【答案】D 【解析】 根据盖斯定律,反应③可由反应②—反应①得到,所以ΔH3=ΔH2-ΔH1,故本题正确答案为D。 5.电化学腐蚀带来了金属的巨大损失,下列材料制成的水龙头与铁制自来水管连接,自来水管生锈最快的是 ( ) A 铝水龙头 B. 塑料水龙头 C. 铁水龙头 D. 铜水龙头 【答案】D 【解析】 【分析】 根据铁生锈的条件进行分析,铁在有水和氧气并存时易生锈,连接时若形成原电池反应,铁做负极易被腐蚀,生锈最快。根据此分析进行解答。 【详解】铁制自来水管与铜水龙头相连接,这样Cu、Fe以及自来水形成原电池,Fe的活动性强于Cu,金属铁作负极,故使Fe锈蚀更快,其他选项都不形成原电池,故答案选D。 6.下列各图表示的装置,能构成原电池的是( ) A. B. C. D. 【答案】C 【解析】 试题分析:构成原电池的条件是①两个活泼性不同的金属(或金属与非金属)做电极,②电解质溶液③构成闭合电路,A.煤油是非电解质,错误;B.电路没有闭合,错误;C.符合条件;D.没有自发的氧化还原反应,两个电极相同,错误;选C。 考点:考查原电池的构成条件。 7.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b相连时b为负极;c、d相连时电流由d到c;b、d相连时b上有大量气泡产生;四种金属的活动性顺序为( ) A. b>d>c>a B. d>a>c>b C. c>d>b>a D. a>b>c>d 【答案】C 【解析】 【分析】 原电池中,活泼性较强的电极为负极,活泼性较弱的电极为正极,放电时,电流从正极沿导线流向负极,正极上得电子发生还原反应,H+可得电子反应生成H2。根据此分析进行解答。 【详解】若a、b 相连时b为负极,则活动性顺序b>a; c、d相连时电流由d→c,说明c是负极,则活动性顺序c>d; b、d相连时b上有大量气泡产生,说明b是正极,则活动性顺序d>b, 故活动性顺序是c>d>b>a。 故答案选C。 【点睛】本题的突破点为在原电池中,一般来说,较活泼的金属作负极,还可以根据电子、电流的流向及电极反应现象判断正负极。 8.下列物质间的反应,其能量变化符合如图的是( ) A. 铁与硫粉在加热条件下的反应 B. 灼热的碳与二氧化碳反应 C. 碳与水蒸汽的反应 D. 碳酸钙的分解 【答案】A 【解析】 【分析】 图中反应物总能量大于生成物总能量,所以为放热反应。根据此分析进行解答。 【详解】A、Fe+SFeS,是化合反应,多数化合反应是放热反应,故A正确; B、CO2+C2CO,是高中化学中少数的化合反应是吸热反应中的一个,反应过程是吸热的,故B错误; C、碳与水蒸汽的反应是吸热反应,故C错误; D、碳酸钙分解需要高温,是吸热反应,故D错误; 故答案选A。 【点睛】通过本类型题可以进行总结,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、多数的化合反应等,其△H<0.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等。 9.用石墨作电极电解1 mol / L下列物质的溶液,溶液的pH值保持不变的( ) A. HCl B. KOH C. K2SO4 D. NaCl 【答案】C 【解析】 【详解】A.电解氯化氢溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的pH增大,故A选项错误。 B. 电解氢氧化钾溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,导致溶液中水减小,氢氧化钾浓度增大,溶液的pH增大,故B选项错误。 C.电解硫酸钾溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,溶液中的溶质是强酸强碱盐,所以溶液pH不变,故C选项正确。 D.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH变大,故D选项错误。 故答案选C。 【点睛】本题主要考察给定电解质溶液的电解过程的分析,溶液的pH值保持不变的意思即为电解过程中主要是电解水,即对溶液的酸碱性强弱没有影响的选项。 10.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作 A. 负极 B. 阳极 C. 正极 D. 阴极 【答案】D 【解析】 电解池的两个电极是阳极和阴极,电镀池中,镀层金属做阳极,镀件作阴极,所以钢芯镀镍时,钢芯作阴极,镍做阳极,故选D。 11.反应A(g)+3B(g)2C(g)+2D(g)在不同情况下测得化学反应速率,其中最快的是 A. v(D) ="0." 4mol / (L·S) B. v(C) ="0." 5mol / (L·S) C. v(B) ="0." 6mol / (L·S) D. v(A) ="0." 15mol / (L·S) 【答案】B 【解析】 12.已知:可逆反应2SO2(g)+O2(g)2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是 A. 升温增压 B. 降温增压 C. 升温减压 D. 降温减压 【答案】B 【解析】 试题分析:升温平衡逆向移动,加压平衡正向移动,A项错误;降温平衡正向移动,加压平衡正向移动,B项正确;升温平衡正向移动,减压平衡逆向移动,C项错误;降温平衡正向移动,减压平衡逆向移动,D项错误。答案选A。 考点:外界条件对化学平衡移动的影响 点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。 13.下列叙述中不正确的是( ) A. 电解池的阳极发生氧化反应,阴极发生还原反应 B. 电镀时,电镀池里的阳极材料发生氧化反应 C. 电解池中,电子从电源负极流向电解池阳极 D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 【答案】C 【解析】 【详解】A.在电解池的阳极上发生失电子的氧化反应,在阴极发生得电子的还原反应,故A正确; B.电镀时,一般镀层金属作阳极,连接电源正极发生失电子的氧化反应,故B正确; C.电子从电解池的阳极流向电源正极,然后从电源的负极流向电解池的阴极,故C错误; D.电解饱和食盐水时,阴极上时氢离子发生得电子的还原反应,生成氢气,氢离子浓度减小,氢氧根离子浓度增大,钠离子移向该电极,该电极附近会产生大量的氢氧化钠,故D正确; 故答案选C。 14.已知某可逆反应在密闭容器中进行:A(g)+2B(g)⇌3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程。若使曲线b变为曲线a,可采取的措施是( ) ①增大A的浓度 ②缩小容器的容积 ③增大B的浓度 ④升高温度 ⑤加入合适的催化剂 A. ① B. ②④ C. ②⑤ D. ②③ 【答案】C 【解析】 【详解】该反应为等体积的可逆反应,且正反应方向为放热方向,由图可知,使曲线b变为曲线a,反应速率加快,但A的转化率不变,平衡不移动,改变的条件可能为缩小容器的容积(增大压强)、加入合适的催化剂,①③④均使平衡发生移动; 答案为C。 【点睛】本题解题关键是改变条件使曲线b变为曲线a,反应速率加快,但A的转化率不变,平衡不移动。 15.某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)Z(g)+W(s) ΔH>0。下列叙述中,正确的是( ) A. 加入少量W,逆反应速率增大 B. 当容器中气体压强不变时,反应达到平衡 C. 升高温度,平衡逆向移动 D. 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 【答案】B 【解析】 试题分析:A、因为W的是固体,浓度视为常数,因此反应速率不变,故错误;B、因为反应前后气体的系数之和不相等,压强跟物质的量成正比,因此当压强不再改变,说明反应达到平衡状态,故正确;C、根据勒夏特列原理,升高温度,平衡向正反应方向移动,故错误;D、化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,故错误。 考点:考查影响化学反应速率的因素、影响化学平衡的因素、化学平衡常数等知识。 16.工业上合成氨N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( ) ①提高H2的转化率 ②适当提高氨的合成速率 ③提高氨的产率 ④催化剂在700 K时活性最大 A. 只有① B. ②④ C. ②③④ D. ①② 【答案】B 【解析】 【详解】N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大。使用催化剂也能增大反应速率,但在700K左右时催化剂的活性最大,所以选择采用700K左右的温度。故选择②④,故答案选B。 17.在某温度下,可逆反应mA + nB pC + qD的平衡常数为K,下列说法正确的是( ) A. K随温度而改变 B. K越小,达到平衡时,反应物的转化率越大 C. K随反应物浓度的改变而改变 D. K越大,达到平衡时,反应进行的程度越小 【答案】A 【解析】 【详解】A.K与温度有关,改变温度K值也会改变,故A选项正确。 B.K用来表示反应进行的程度,K越小,达到平衡时,反应进行的程度小,反应物的转化率越小。故B选项错误。 C.K与温度有关,与反应物的浓度无关,故C选项错误。 D.K用来表示反应进行的程度,K值越大,反应进行的程度越大,故D选项错误。 故答案选A。 【点睛】本题的突破点为知道K用来表示反应进行的程度且知道K的大小只与反应本身以及反应温度有关。 18.已知在700 ℃时CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K1=2,则该温度下其逆反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2是( ) A. 2 B. 0.5 C. 4 D. 1 【答案】B 【解析】 【详解】由题意可得CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K1=2= 。而反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2= = =0.5。 故答案选B。 【点睛】注意某一个可逆反应,正反应化学平衡常数为K,那么逆反应的化学平衡常数为。 19.野外作业时,可利用原电池反应放出的热量来加热食品。由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑( ) A. 作正极,发生还原反应 B. 作阴极,发生还原反应 C. 作负极,发生氧化反应 D. 作阳极,发生还原反应 【答案】C 【解析】 【详解】由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑做负极,炭粒作正极,负极本身发生失电子的氧化反应,故答案选C。 20. 反应aA(g)+bB(g)⇌cC(g)△H,生成物C的质量分数与压强P和温度T的关系如图, 方式中的系数和△H的大小符合图象的是( ) A. a+b=c △H>0 B. a+b>c △H<0 C. a+b<c △H>0 D. a+b<c △H<0 【答案】D 【解析】 试题解析:由达到平衡所用时间可知T2>T1,p2>p1,升高温度,C的含量降低,说明平衡向逆反应方向移动,则正反应为放热反应,即△H<0;增大压强,C的含量降低,说明平衡向逆反应方向移动,则逆反应为体积减小的反应,所以a+b<c,故选D. 考点:化学平衡移动 21.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)达到化学平衡的标志是( ) A. NH3的生成速率与NH3的分解速率相等 B. 单位时间内生成a mol N2同时生成3a mol H2 C. 单位时间内生成a mol N2同时消耗a mol H2 D. 单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂 【答案】A 【解析】 【分析】 根据化学反应到达平衡时,正逆反应速率相等,各物质的物质的化学计量数之间的关系来进行判断。 【详解】A.因反应达到平衡时,正逆反应速率相等,NH3的生成速率与NH3的分解速率相等, 故A选项正确。 B.单位时间内生成a mol N2必定同时生成3a mol H2只说明反应在逆向进行,不表示达到平衡,故B选项错误。 C.当反应达到平衡时,单位时间内生成a mol N2同时消耗3a mol H2,故C选项错误。 D.单位时间内有1 mol N≡N键断裂同时有3 mol H—H键断裂只能表示反应在正向进行,不能表示平衡,故D选项错误。 故答案选A。 【点睛】本题需要根据化学反应到达平衡时,正逆反应同时发生,且反应速率之比等于化学计量数之比来判断。 22.氢镍电池是近年开发出的可充电电池,电池的总反应式为1/2 H2 + NiO(OH) Ni(OH)2 ,下列叙述正确的是( ) A. 电池充电时,Ni元素被还原 B. 电池放电时,镍元素被氧化 C. 电池充电时,只有H元素被氧化 D. 电池放电时,氢气中氢元素被氧化 【答案】D 【解析】 【分析】 可充电电池放电时发生的是原电池反应,充电时发生的是电解池反应。该电解池反应中,阴极发生还原反应,电极反应式应为2H2O+2e-=OH-+H2↑;阳极发生氧化反应,电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O。原电池反应中的还原剂H2在负极上失电子发生氧化反应,H2-2e-2H+。根据此分析进行解答。 【详解】A.电池充电时,阳极反应为:Ni(OH)2 + OH--e-= NiO(OH) +H2O,Ni 元素化合价升高,被氧化,故A选项错误。 B.放电时,镍元素化合价降低,被还原,故B选项错误。 C.充电时发生的是电解池反应。阴极发生还原反应,电极反应式应为2H2O+2e-=OH-+H2↑,H元素化合价降低,被还原,Ni元素被氧化,故C选项错误。 D.原电池反应中的还原剂H2在负极上失电子发生氧化反应,H2-2e-2H+,故D选项正确。 【点睛】本题需要注意①充电电池在放电时是一个电源(原电池),发生原电池反应,在这个反应方程式中从左到右是放电,根据发生氧化反应的是负极,发生还原反应的是正极,②充电时发生的是电解池反应,阳极发生氧化反应,阴极发生还原反应。 二、填空题(本大题共5小题,共56分) 23.(1)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,写出该反应的热化学方程式为_______________ (2)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知: N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔΗ= -534 kJ/mol N2(g)+2O2(g)=2NO2(g) ΔΗ= +67.7 kJ/mol ; 写出肼和二氧化氮反应的热化学方程式_____________ 。 【答案】 (1). 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol (2). 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH= -1135.7kJ/mol 【解析】 【详解】(1)放出571.6 kJ的热量则△H=-571.6kJ/mol,而1 mol O2会与2mol H2进行反应,故热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol; 故答案为 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol。 (2)已知反应①N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔΗ= -534 kJ/mol 反应② N2(g)+2O2(g)=2NO2(g) ΔΗ= +67.7 kJ/mol ; 将①×2-②可得肼和二氧化氮反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH= (-534 kJ/mol)×2-(67.7 kJ/mol)= -1135.7kJ/mol; 故答案为 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH= -1135.7kJ/mol。 24.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。 (1)下列哪个装置可防止铁棒被腐蚀________________。 (2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答: ①铁件应与电源的________极相连(写正或负),B电极的电极反应式是______。 ②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为________mol。 ③电镀结束后CuSO4溶液的浓度______(填变大,变小,不变) ④镀层破损后,铁不易被腐蚀的是___________(填序号)。 A 镀铜铁 B 镀锌铁 C 镀锡铁 【答案】 (1). BD (2). 负 (3). Cu2++2e_= Cu (4). 0.16 (5). 不变 (6). B 【解析】 【分析】 在铁件上镀铜时,铜作阳极,与正极相连,铁件作阴极,Cu2+得电子生成Cu:Cu2++2e-=Cu,镀层破损后,镀铜铁形成的原电池中铁作负极,腐蚀加快,镀锌铁形成的原电池中铁作正极被保护。 【详解】(1)铁作原电池的正极或电解池的阴极时可防止被腐蚀,B为原电池,锌作负极被腐蚀,铁作正极被保护,D为电解池,铁与电源的负极相连,作阴极被保护; 故答案为 BD (2)①在铁件上镀铜时,铜作阳极,与正极相连,铁棒作阴极,B电极为阴极,阴极发生还原反应,Cu2+得电子生成Cu:Cu2++2e-=Cu; ②A极为阳极,发生氧化反应阳极反应离子方程式:Cu-2e-=Cu2+,故阳极固体质量减少,阴极固体质量增加,二者质量差为10.24 g,则阴极表面增加的铜的质量为5.12g ,转换为物质的量为0.08mol,已知每生成1mol铜转移2mol电子,故电路中通过的电子为0.16mol; ③A极为阳极,发生氧化反应阳极反应离子方程式:Cu-2e-=Cu2+,这样溶液中Cu离子的浓度就不会改变; ④镀层破损后,镀铜铁、镀锡铁形成的原电池中铁作负极,腐蚀加快,镀锌铁形成的原电池中铁作正极被保护; 故答案为负 Cu2++2e-= Cu 0.16 不变 B。 【点睛】本题的解题关键在于铁(被镀金属)作原电池的正极或电解池的阴极时可防止被腐蚀。镀层金属要做阳极,含有镀层金属离子的电解质溶液,进行电镀,就可以在镀件上镀一层镀层金属。 25.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空: (1)反应开始至2min,以气体Z表示的平均反应速率为_________。 (2)该反应的化学方程式为_________。 (3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时,此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填“增大”“减小”或(相等))。 【答案】 (1). 0.05 mol·L-1·min-1 (2). 3X+Y⇌2Z (3). 0.9 (4). 增大 【解析】 【详解】(1)反应开始至2min,气体Z的平均反应速率为v= =0.05mol/(L·min); (2)由图象可以看出,X、Y物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X):△n(Y):△n(Z)=(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,则化学方程式为3X+Y⇌2Z; (3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,此时体系的压强是开始时的0.9倍; ②平衡时,混合气体的平均摩尔质量为 = ,气体的总质量不变,总物质的量减少,混合气体的平均摩尔质量增大,气体的摩尔质量数值上等于相对分子质量,故达平衡时,容器内混合气体的平均相对分子质量比起始投料时增大。 26.在如图所示实验装置,X为直流电源的负极。甲池中充满H2SO4溶液,再分别插入铂电极。乙池中盛有AgNO3溶液,F、G为石墨电极。 切断开关S2,闭合开关S1,通直流电一段时间 ①甲池总反应方程式:____________; ②F电极反应方程式:___________; ③G电极的现象:______________; ④若F电极增重10.8g,B极上放出气体的体积(STP)是_______L; ⑤切断电源开关S1,闭合开关S2,此时甲池为__________(填原电池、电解池),A电极反应方程式:______。 【答案】 (1). 2H2O2H2↑+O2↑ (2). Ag++e-=Ag (3). 有气体产生 (4). 0.56 (5). 原电池 (6). H2-2e-=2H+ 【解析】 【分析】 切断开关S2,闭合开关S1,通直流电时,该装置为电解池,X为直流电源的负极,则A为阴极,发生还原反应4H++4e-=2H2↑,B为阳极,且OH-比SO42-更容易失去电子被氧化4OH--4e-=O2↑+2H2O,乙池中,F为阴极发生还原反应Ag++e-=Ag,G为阳极发生氧化反应4OH--4e-=O2↑+2H2O。 切断电源开关S1,闭合开关S2时,甲池中为原电池装置,A极为负极,发生氧化反应:H2-2e-=2H+,B为正极,发生还原反应:O2+4e-+4H+=2H2O。根据此分析进行解答。 【详解】(1)切断电源开关S2,闭合开关S1时,甲池为电解池,X为直流电源的负极,则A为阴极,发生还原反应4H++4e-===2H2↑,B为阳极,且OH-比SO42-更容易失去电子被氧化4OH--4e-=O2↑+2H2O,故甲池总反应方程式为2H2O2H2↑+O2↑。 故答案为2H2O2H2↑+O2↑; (2)乙池中,F为阴极,银离子得电子发生还原反应Ag++e-=Ag。 故答案为Ag++e-=Ag; (3)G为阳极,氢氧根发生氧化反应生成氧气和水4OH--4e-===O2↑+2H2O,故G电极上会有气体放出。 故答案为有气体产生; (4)F为阴极,银离子得电子发生还原反应Ag++e-=Ag,F电极增重10.8g为银的质量,转换为银的物质的量为0.1mol,故反应转移电子0.1mol,B为阳极发生氧化反应4OH--4e-===O2↑+2H2O,故产生氧气0.025mol,体积为0.025mol×22.4L/mol=0.56L。 故答案为0.56L; (5)若切断电源开关S1,闭合开关S2时,甲池中变换为原电池装置,A极为负极,氢气发生氧化反应:H2-2e-=2H+,B为正极,氧气发生还原反应:O2+4e-+4H+=2H2O。 故答案为H2-2e-=2H+。 【点睛】电化学题目解答过程中要注意: ①判断是原电池还是电解池②如果是原电池,头脑中就浮现相关知识③如果是电解池,就先看是惰性电极还是活性电极,如果是隋性电极:①是熟悉的电解装置(电解氯化铜溶液、盐酸、氯化钠溶液、硫酸铜溶液、硝酸银溶液、硫酸溶液、氢氧化钠溶液、硫酸钠溶液),就直接背出相应的知识②如果是活性电极,阳极是金属电极失电子变成金属阳离子,阴极用放电顺序分析(要注意水电离的氢氧根离子也要进行放电顺序的比较)。只需在阳极考虑活性电极,不需要阴极考虑活性电极。 27.已知 H2S与CO2高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610 K时,将0.40 mol H2S与0.10 mol CO2 充入2L的空钢瓶中,反应平衡后水的物质的量分数为0.02。 (1)该反应的化学平衡常数表达式K=____________ 。 (2)向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。 A H2S B COS C CO2 D N2 (3)CO2的平衡转化率α1=_____%,反应平衡常数K=__________。(保留两位有效数字) (4)在600 K重复实验,平衡后水的物质的量分数为0.03,CO2的转化率α2________α1,该反应的ΔH______0(填“>”“<”或“=”)。 【答案】 (1). (2). C (3). 10% (4). 2.8×10-3 (5). > (6). < 【解析】 【分析】 由题意知①通入H2S,平衡正向移动,但自身转化率减小;通入CO2,平衡正向移动;通入COS,平衡逆向移动;恒容条件下通入N2,平衡不移动。②在600 K重复实验,平衡后水的物质的量分数为0.03,说明升高温度平衡逆向移动;③利用“三段式”计算平衡转化率以及反应平衡常数。 【详解】(1)反应方程式为H2S(g)+CO2(g)COS(g)+H2O(g)则化学平衡常数表达式; 故答案为; (2)A.充入H2S,浓度增大,平衡正向移动,H2S的转化率减小,故A选项错误; B.充入COS,平衡逆向移动,H2S的转化率减小,故B选项错误; C.充入CO2,平衡正向移动,H2S的转化率增大,故C选项正确; D.充入N2,平衡不移动,H2S的转化率不变,故D选项错误; 故答案选C; (3)由题意设H2S转化的物质的量为x, H2S(g)+CO2(g)COS(g)+H2O(g) 起始(mol)0.40 0.10 0 0 转化(mol) x x x x 平衡(mol)0.40-x 0.10-x x x 已知反应平衡后水的物质的量分数为0.02,则=0.02,解得x=0.01,故CO2的平衡转化率a1=×100%=10%;反应平衡常数K=≈2.8×10-3; 故答案10% 2.8×10-3; (4)水的物质的量分数增大,说明升高温度平衡逆向移动,CO2的转化率a2>a1,且正反应放热,即△H<0; 故答案为> <。 【点睛】题目考查化学平衡影响因素和计算等问题,检验学生的分析能力和计算能力,解题方法:列出化学平衡三段式,根据平衡常数、平衡移动原理等分析和计算,难度中等。 查看更多