- 2021-07-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年内蒙古翁牛特旗乌丹第二中学、呼和浩特市第二十一中学高二上学期期末联考化学试题 Word版
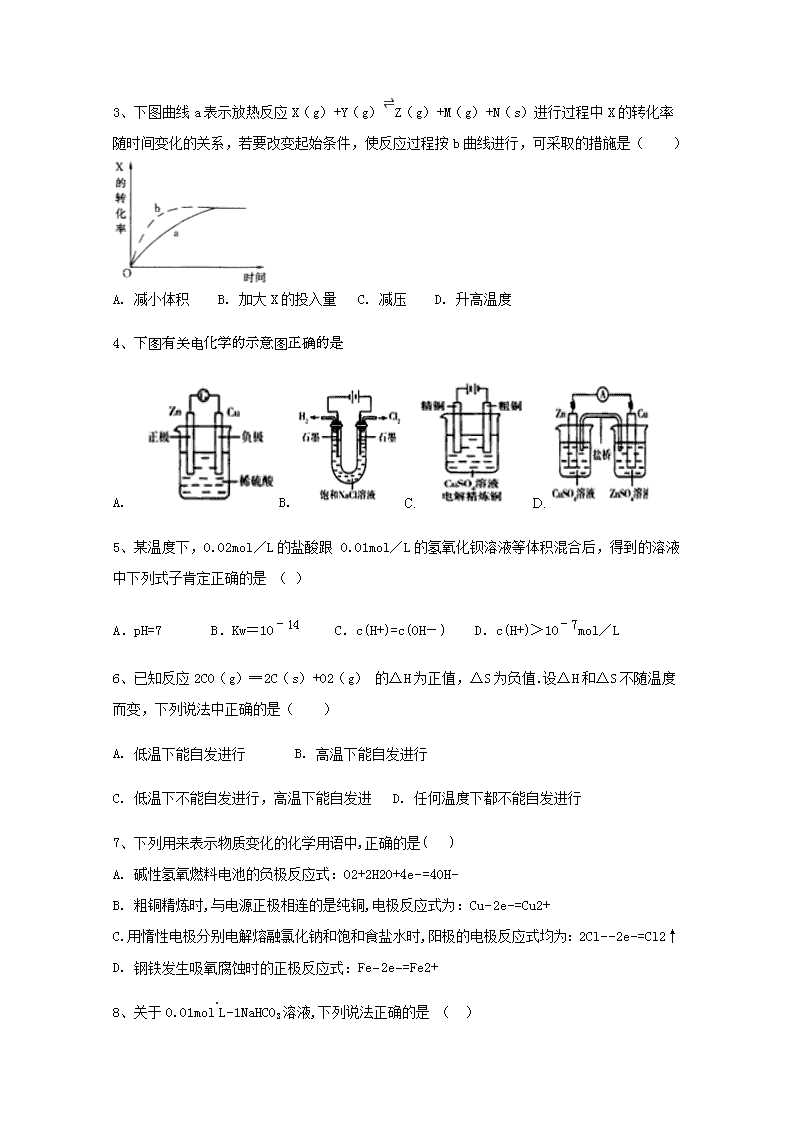
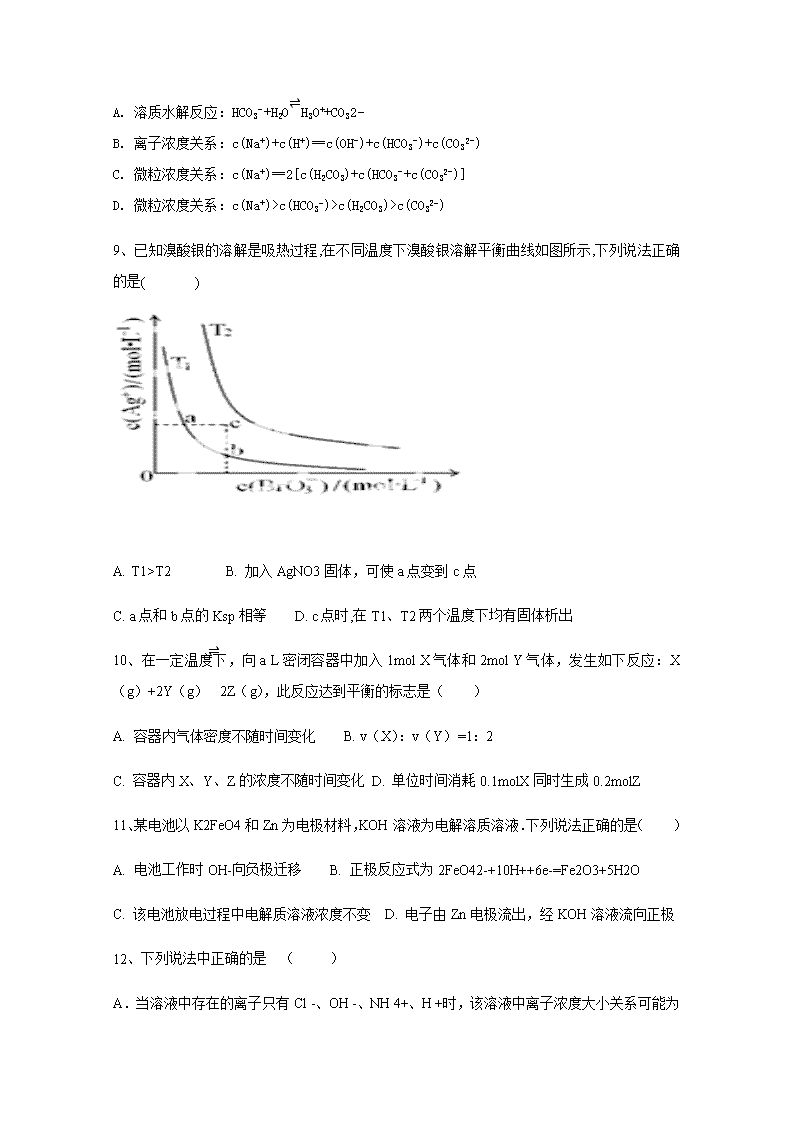
2017-2018学年内蒙古翁牛特旗乌丹第二中学、呼和浩特市第二十一中学高二上学期期末联考化学试卷 本卷满分100分,考试时间90分钟 第Ⅰ卷 选择题 本卷共有14个小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1、下列说法正确的是() A. 如图可表示水分解过程中的能量变化 B. 若2C(s)+O2(g)=2CO(g)△=−221.0kJ/mol,则碳的燃烧热为110.5kJ/mol C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 D. 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=−akJ/mol II: 且a、b、c均大于零,则断开1mol H−Cl键所需的能量为(−a−b−c)kJ/mol 2、可以证明乙酸是弱酸的事实是( ) A. 乙酸和水能任意比例混溶 B. 醋酸溶液中存在醋酸分子 C. 醋酸能与碳酸钠溶液反应生成CO2气体D. 1摩/升的醋酸水溶液能使紫色石蕊试液变红色 3、下图曲线a表示放热反应X(g)+Y(g)⇌Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( ) A. 减小体积 B. 加大X的投入量 C. 减压 D. 升高温度 4、下图有关电化学的示意图正确的是 A. B. C. D. 5、某温度下,0.02mol/L的盐酸跟 0.01mol/L的氢氧化钡溶液等体积混合后,得到的溶液中下列式子肯定正确的是 ( ) A.pH=7 B.Kw=10-14 C.c(H+)=c(OH-) D.c(H+)>10-7mol/L 6、已知反应2CO(g)═2C(s)+O2(g) 的△H为正值,△S为负值.设△H和△S不随温度而变,下列说法中正确的是( ) A. 低温下能自发进行 B. 高温下能自发进行 C. 低温下不能自发进行,高温下能自发进 D. 任何温度下都不能自发进行 7、下列用来表示物质变化的化学用语中,正确的是( ) A. 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e−=4OH− B. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu−2e−=Cu2+ C. 用惰性电极分别电解熔融氯化钠和饱和食盐水时,阳极的电极反应式均为:2Cl−−2e−=Cl2↑ D. 钢铁发生吸氧腐蚀时的正极反应式:Fe−2e−=Fe2+ 8、 关于0.01mol⋅L−1NaHCO3溶液,下列说法正确的是 ( ) A. 溶质水解反应:HCO3−+H2O⇌H3O++CO32− B. 离子浓度关系:c(Na+)+c(H+)═c(OH−)+c(HCO3−)+c(CO32−) C. 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3−+c(CO32−)] D. 微粒浓度关系:c(Na+)>c(HCO3−)>c(H2CO3)>c(CO32−) 9、已知溴酸银的溶解是吸热过程,在不同温度下溴酸银溶解平衡曲线如图所示,下列说法正确的是( ) A. T1>T2 B. 加入AgNO3固体,可使a点变到c点 C. a点和b点的Ksp相等 D. c点时,在T1、T2两个温度下均有固体析出 10、在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( ) A. 容器内气体密度不随时间变化 B. v(X):v(Y)=1:2 C. 容器内X、Y、Z的浓度不随时间变化 D. 单位时间消耗0.1molX同时生成0.2molZ 11、某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( ) A. 电池工作时OH-向负极迁移 B. 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O C. 该电池放电过程中电解质溶液浓度不变 D. 电子由Zn电极流出,经KOH溶液流向正极 12、下列说法中正确的是 ( ) A.当溶液中存在的离子只有Cl -、OH -、NH 4+、H +时,该溶液中离子浓度大小关系可能为c(Cl -)>c(NH 4+)>c(OH -)>c(H +) B.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 C.常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ D.常温下,pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) 13、某温度时,在体积为1L的密闭容器中,A、B. C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是( ) A. 该反应的热化学方程式为:A(g)+3B(g)⇌2C(g);△H>0 B. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 C. 达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动 D. 若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小 14、25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( ) A. 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 B. 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 C. 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO−) D. 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10−11 mol⋅L−1 第Ⅱ卷 非选择题 本卷包括5个小题,每空2分,共44分,请在相应位置作答 15、 (1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___. (2)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1① CO(g)+O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1② C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③ 则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为___ 16、将0.2mol⋅L−1 HA溶液与0.1mol⋅L−1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A−),则: (1)混合溶液中c(A−)___c(HA)(填“>”“<”或“=”,下同). (2)混合溶液中c(HA)+c(A−)___0.1mol⋅L−1. (3)混合溶液中,由水电离出的c(OH−)___0.2mol⋅L−1 HA溶液中由水电离出的c(H+). (4)25℃时,如果取0.2mol⋅L−1 HA溶液与0.1mol⋅L−1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度___NaA的水解程度。 17、 利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。 (1)p1___p2(填“>”、“<”或“=”),理由是___. (2)该甲醇合成反应在A点的平衡常数K=___(用a和V表示). (3)该反应达到平衡时,反应物转化率的关系是CO___H2.(填“>”、“<”或“=”) (4)下列措施中能够同时满足增大反应速率和提高CO转化率的是___(填字母). A. 使用高效催化剂 B.降低反应温度 C. 增大体系压强 D.不断将CH3OH从反应混合物中分离出来 18、(1)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。 ①三种溶液pH由大到小的顺序为: (填序号)。 ②溶液a的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“<”或“=”)。 (2) 已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 。 (填写序号);b中氯离子的浓度为 mol/L。 19、如图是一个化学过程的示意图,回答下列问题: (1)甲池是 装置,电极A的名称是 。 (2)甲装置中通入CH4的电极反应式为 ,乙装置中B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式), (3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃ 时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。 若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。 [] 2017-2018学年度第一学期赤峰呼市校际期末联考 高二化学参考答案 1-5 ABDBC 6-10DCDCC 11-14ACDD 15、 (1)2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=−290kJ⋅mol−1;[来源:] (2) -1 641.0 kJ·mol-1 16、 (1) < (2) =; (3) > ; (4)>. 17、(1)<;甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高; (2)12V2 / a2; (3)= (4)C. 18、(1)b>a>c ; > (2) b>a>d>c ,9×10-10 19、 (1) 原电池 阳极 (2)CH4+10OH--8e-=CO32-+7H2O Ag++e-=Ag H2和NaOH (3)12 HCl查看更多