- 2021-07-06 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)试题(解析版)
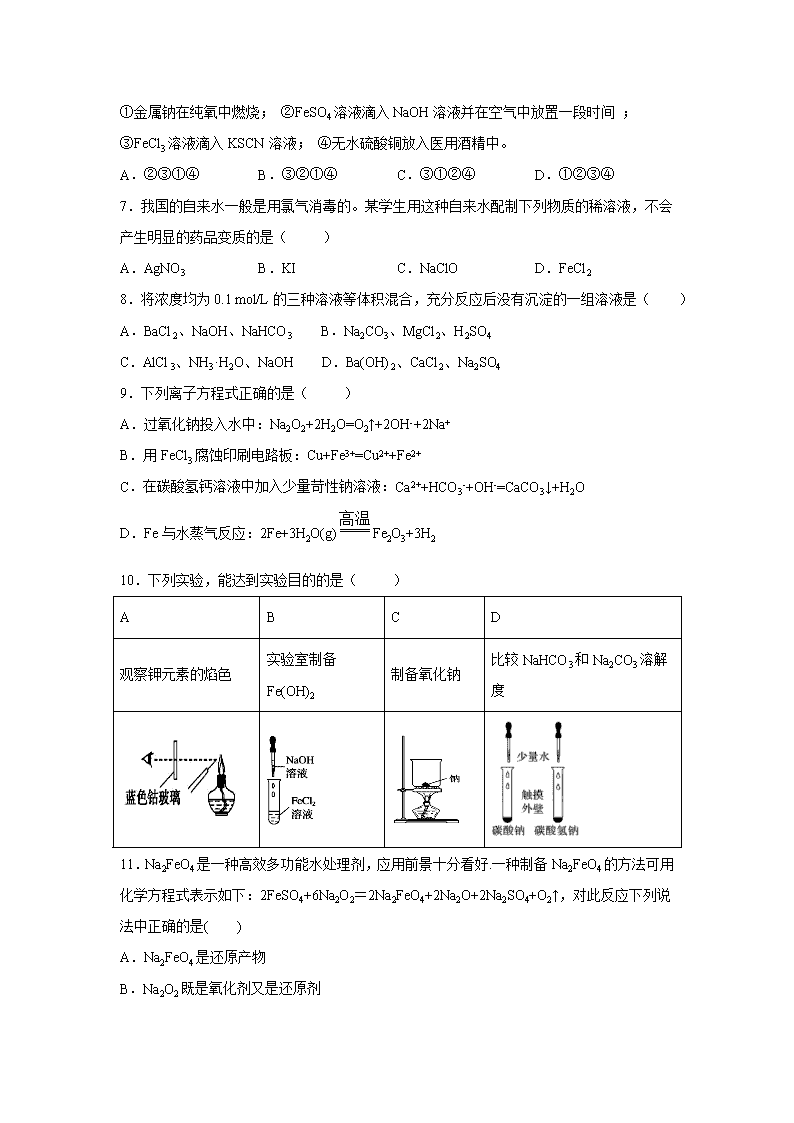
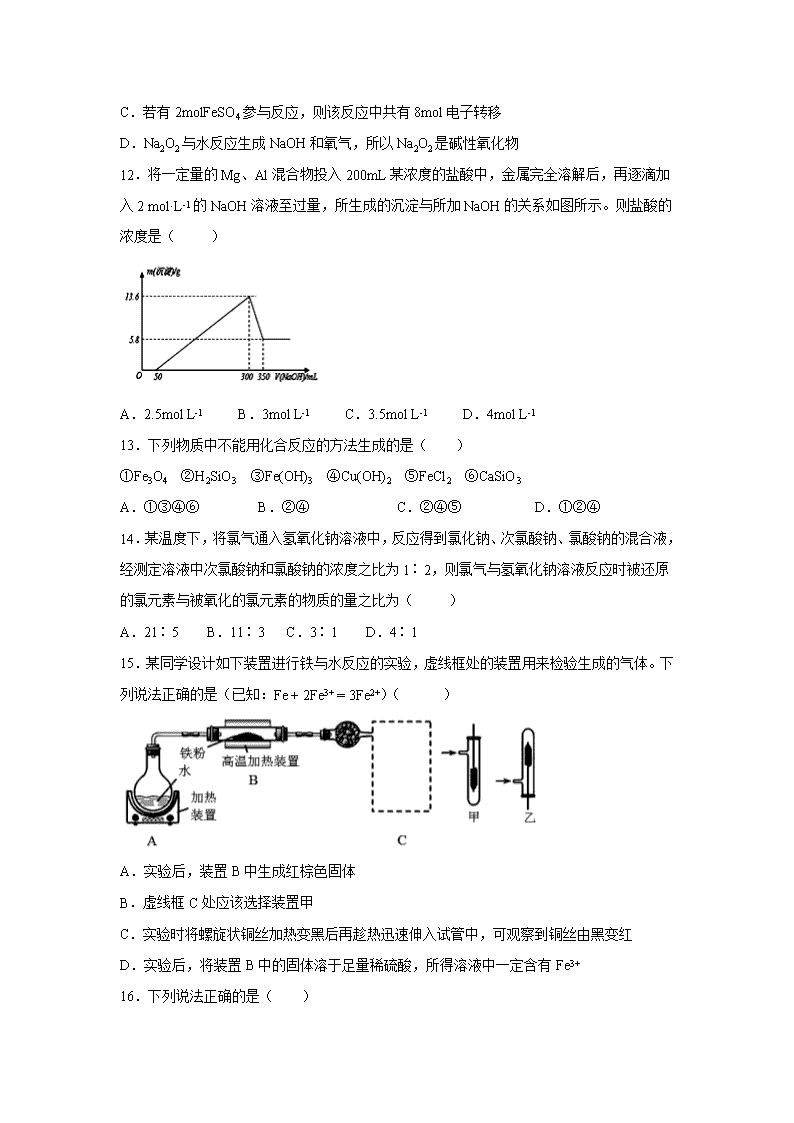
安徽省六安市第一中学 2019-2020 学年高一下学期疫情防 控延期开学期间辅导测试(二)试题 可能用到的相对原子质量:Cl:35.5 一、选择题(每一题只有一个正确选项,每一题 3 分,共 48 分) 1.NA 表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.在标准状况下,1 mol SO3 体积等于 22.4 L B.标准状况下,7.1 g 氯气与足量氢氧化钠稀溶液反应转移的电子数为 0.1NA C.1 mol Fe(OH)3 胶体中含有的胶粒数目为 NA D.2 L 0.5 mol·L−1 硫酸钾溶液中阴离子所带电荷数为 NA 2.下列叙述不正确的是( ) 选项 被提纯物质 杂质 除杂试剂或方法 A FeCl3 溶液 FeCl2 通入适量 Cl2 B Cl2 H2O (蒸气) 通入浓硫酸中 C 铜粉 铁粉 加入过量盐酸并过滤 D CO2 HCl 通入饱和的碳酸钠溶液中 3.下列各离子能大量共存的是( ) A.无色透明的溶液中:Cu2+、K+、SO42-、NO3- B.使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- C.NH4Cl 溶液中:K+、OH-、SO42-、Cl- D.pH=1 的溶液中:Na+、K+、HCO3-、NO3- 4.下列关于 Fe(OH)3 胶体的说法中,不正确的是 ( ) A.分散质粒子直径在 10-9~10-7m 之间 B.是一种纯净物 C.具有丁达尔效应 D.具有净水作用 5.为了防止食品受潮及富脂食品氧化变质,在包装袋中应放入的独立包装的物质是( ) A.无水硫酸铜、蔗糖 B.食盐、硫酸亚铁 C.生石灰、还原铁粉 D.生石灰、食盐 6. 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( ) ①金属钠在纯氧中燃烧; ②FeSO4 溶液滴入 NaOH 溶液并在空气中放置一段时间 ; ③FeCl3 溶液滴入 KSCN 溶液; ④无水硫酸铜放入医用酒精中。 A.②③①④ B.③②①④ C.③①②④ D.①②③④ 7.我国的自来水一般是用氯气消毒的。某学生用这种自来水配制下列物质的稀溶液,不会 产生明显的药品变质的是( ) A.AgNO3 B.KI C.NaClO D.FeCl2 8.将浓度均为 0.1 mol/L 的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( ) A.BaCl2、NaOH、NaHCO3 B.Na2CO3、MgCl2、H2SO4 C.AlCl3、NH3·H2O、NaOH D.Ba(OH)2、CaCl2、Na2SO4 9.下列离子方程式正确的是( ) A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+ B.用 FeCl3 腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+ C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O D.Fe 与水蒸气反应:2Fe+3H2O(g) Fe2O3+3H2 10.下列实验,能达到实验目的的是( ) A B C D 观察钾元素的焰色 实验室制备 Fe(OH)2 制备氧化钠 比较 NaHCO3 和 Na2CO3 溶解 度 11.Na2FeO4 是一种高效多功能水处理剂,应用前景十分看好.一种制备 Na2FeO4 的方法可用 化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说 法中正确的是( ) A.Na2FeO4 是还原产物 B.Na2O2 既是氧化剂又是还原剂 高温 C.若有 2molFeSO4 参与反应,则该反应中共有 8mol 电子转移 D.Na2O2 与水反应生成 NaOH 和氧气,所以 Na2O2 是碱性氧化物 12.将一定量的 Mg、Al 混合物投入 200mL 某浓度的盐酸中,金属完全溶解后,再逐滴加 入 2 mol·L-1 的 NaOH 溶液至过量,所生成的沉淀与所加 NaOH 的关系如图所示。则盐酸的 浓度是( ) A.2.5mol L-1 B.3mol L-1 C.3.5mol L-1 D.4mol L-1 13.下列物质中不能用化合反应的方法生成的是( ) ①Fe3O4 ②H2SiO3 ③Fe(OH)3 ④Cu(OH)2 ⑤FeCl2 ⑥CaSiO3 A.①③④⑥ B.②④ C.②④⑤ D.①②④ 14.某温度下,将氯气通入氢氧化钠溶液中,反应得到氯化钠、次氯酸钠、氯酸钠的混合液, 经测定溶液中次氯酸钠和氯酸钠的浓度之比为 1∶2,则氯气与氢氧化钠溶液反应时被还原 的氯元素与被氧化的氯元素的物质的量之比为( ) A.21∶5 B.11∶3 C.3∶1 D.4∶1 15.某同学设计如下装置进行铁与水反应的实验,虚线框处的装置用来检验生成的气体。下 列说法正确的是(已知:Fe + 2Fe3+ = 3Fe2+)( ) A.实验后,装置 B 中生成红棕色固体 B.虚线框 C 处应该选择装置甲 C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑变红 D.实验后,将装置 B 中的固体溶于足量稀硫酸,所得溶液中一定含有 Fe3+ 16.下列说法正确的是( ) A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C.铁与水蒸气在高温下的反应产物为 Fe2O3 和 H2 D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 二、非选择题(除特别标明外,每空 2 分,共 52 分) 17.(8 分)KClO3 和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其 变化可以表示为: KClO3+ HCl(浓)―→ KCl+ ClO2↑+ Cl2↑+ H2O (1)请配平该化学方程式(未知系数填入框内)_____。 (2)浓盐酸在反应中显示出来的性质是________(填编号)。 ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (3)5 ℃ 下将产物氯气 0.1 mol 溶于水配成 1 L 溶液,请写出氯气溶于水的化学反应方程式 ____________________。 (4)若改变温度至 70 ℃,发现 KClO3 和浓盐酸反应的氧化产物和还原产物均为二氧化氯气 体,试写出反应的化学方程式:______________________________________________。 18.(12 份)实验室用下图装置测定 FeO 和 Fe2O3 固体混合物中 Fe2O3 的质量,D 装置的硬 质双通玻璃管中的固体物质是 FeO 和 Fe2O3 的混合物。 (1)装置 B 的作用是______________ ,装置 C 中盛装的液体是______________。(2 分) (2)在硬质双通玻璃管中发生的化学反应方程式是________________________________、 __________________________。 (3)若为 FeO 和 Fe2O3 物质的量之比 1∶1 的固体混合物,反应完全后,U 型管的质量增加 7.2 g,则混合物中 Fe2O3 的质量为______________。 (4)U 型管 E 右边连接干燥管 F 的目的是________________,若无干燥管 F,测得 Fe2O3 的质 量将_____________(填“偏大”“偏小”或“无影响”)。 19.(8 分)把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色 沉淀,再向所得浊液中逐渐加入 1.00 mol·L -1HCl 溶液,加入 HCl 溶液的体积与生成沉淀的关 系如图所示。 试回答: (1)A 点沉淀的化学式为______。 (2)写出 A 点至 B 点发生反应的离子方程式_______。 (3)求原混合物中 AlCl3 的质量____和 NaOH 的物质的量____。 20.(12 分)黄铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2 等)是生产硫酸的工业废渣, 其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3) 的流程如下: 回答下列问题: (1)“焙烧”时所添加的最佳还原剂是________(填序号)。 a.焦炭 b.硫黄 c.镁粉 d.锌粉 (2)“过滤 1”后的滤液中溶质的主要成分是________________(填化学式)。 (3)“沉淀反应”时不宜混入过多空气,其原因为 (用化学方程式表示)。 (4)为检验 FeCO3 是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。 (5)在空气中煅烧 FeCO3 生成铁红和另一种氧化物,反应的化学方程式为________。 (6)现有黄铁矿烧渣 500t,铁元素的质量分数为 16.8%,经过一系列转化后,得到 90t 铁红, 该产品的产率为________。(提示: ) 21.(12 分)为探究 Na 与 CO2 反应的产物,某化学兴趣小组按如图所示装置进行实验。 己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3 100= ×量率 %理 量 实际产产 论产 回答下列问题: (1)B 中的溶液为______________。 (2)先称量硬质玻璃管的质量为 ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管 的总质量是 m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述 操作步骤,直至硬质玻璃管恒重,称得质量为 m3 g。 a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管 d.打开 K1 和 K2,通入 CO2 至 E 中出现浑浊 e.关闭 K1 和 K2 f.冷却到室温 (3)加热硬质玻璃管一段时间,观察到以下现象: ①钠块表面变暗,熔融成金属小球; ②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质; ③F 中试管内壁有银白物质产生。 产生上述②现象的原因是____________________________________________________; (4)探究固体产物中钠元素的存在形式 假设一:只有 Na2CO3; 假设二:只有 Na2O; 假设三:Na2O 和 Na2CO3 均有; 完成下列实验设计,验证上述假设: 步骤 操作和现象 结论 1 将硬质玻璃管中的固体产物溶于水后过滤; 2 往步骤 1 所得滤液中_________________________________; 现象:____________________________________。 假设一成 立 (5)根据上述实验现象及下表实验数据,写出 Na 与 CO2 反应的总化学方程式_________。 m1 m2 m3 66.7g 69.0g 72.1g 【参考答案】 1.B A.标况下 不是气体,因此无法计算体积; B.氯气在碱液中反应,得到+1 价的氯和-1 价的氯,因此 1 个氯气分子在碱液中转移 1 个电 子,又因为 ,则一共转移 0.1mol 电子; C. 胶体是很多氢氧化铁胶体粒子集合体,因此 1mol 胶体中的胶粒将远远小于 1mol; D. 算出 的物质的量,因此一共带 2NA 个负电荷; 2.D A、FeCl2 与氯气反应生成 FeCl3,通入氯气可除去 FeCl3 溶液中的 FeCl2; B、浓硫酸具有吸水性,可除去氯气中的水蒸气; C、铜与盐酸不反应、铁与盐酸反应生成氯化亚铁和氢气,可用盐酸除去铜中的铁粉; D、二氧化碳与碳酸钠溶液反应生成碳酸氢钠,不能用碳酸钠溶液除去二氧化碳中的氯化氢; 3.B A. Cu2+为有色离子,与题意要求不符; B. 溶液中存在大量氢氧根离子,Na+、K+、SO42−、CO32−之间不反应,在溶液中能大量共存; C. NH4Cl 与 OH−发生反应,在溶液中不能大量共存; D. pH=1 溶液呈酸性,溶液中存在大量氢离子,与 HCO3−反应,在溶液中不能大量共存; 4.B A. 氢氧化铁胶体胶粒的直径在 10-9~10-7m 之间; B. 氢氧化铁胶体是氢氧化铁和水的混合物; C. 胶体具有丁达尔效应; D. 氢氧化铁胶粒能吸附水中的杂质颗粒,有净水的作用; 5.C A.无水硫酸铜能吸收水分,一般不用做干燥剂,且蔗糖不能防止食品被氧化; B.食盐不能防止食品受潮,硫酸亚铁能防止食物被氧化; C.生石灰能防止食品受潮,还原铁粉能防止食物被氧化; D.生石灰能防止食品受潮,但食盐不能防止食品被氧化。 3SO 7.1g =0.1mol71g/mol 3Fe(OH) 2L 0.5mol/L=1mol× 2- 4SO 6.B ①金属钠在纯氧中燃烧生成淡黄色的过氧化钠;②FeSO4 溶液和 NaOH 溶液反应生成氢氧化 亚铁沉淀,然后迅速变为灰绿色,最终被氧化为氢氧化铁红褐色物质;③FeCl3 溶液中滴入 KSCN 溶液,发生络合反应,溶液呈红色;④医用酒精中含有水,无水硫酸铜放入医用酒精 中,变蓝色; 7.C 氯气部分溶于水,Cl2+H2O HCl+HClO,所以溶液中存在氯气、盐酸、次氯酸等。 A、AgNO3 与盐酸反应生成难溶的氯化银而变质; B、碘化钾被氯气氧化而变质; C、由于次氯酸钠起漂白作用时需要转化为次氯酸,所以可以用自来水配制次氯酸钠溶液; D、氯化亚铁易被氧化为氯化铁而变质; 8.B A、NaOH、NaHCO3 恰好反应生成碳酸钠,BaCl2 和碳酸钠后反应生成碳酸钡沉淀; B、Na2CO3、MgCl2、H2SO4 等物质的量混合后碳酸钠和稀硫酸恰好反应生成硫酸钠; C、AlCl3、NH3•H2O、NaOH 等物质的量混合,1mol 铝离子需要 3mol 氢氧根离子完全沉淀, 根据题意碱不足,所以一定有沉淀生成; D、Ba(OH)2、CaCl2、Na2SO4 等物质的量混合可以生成硫酸钡沉淀,所以一定有沉淀生成,; 9.C A. 方程式 Na2O2+2H2O=O2↑+2OH-+2Na+,H 原子不守恒; B. 方程式 Cu+Fe3+=Cu2++Fe2+,电荷不守恒、电子不守恒; C. 在碳酸氢钙溶液中加入少量苛性钠溶液,则 Ca2+与 HCO3-都过量,由 OH-的量确定 Ca2+ 与 HCO3-的用量; D. Fe 与水蒸气反应,生成 Fe3O4 和 H2; 10.A A、透过蓝色钴玻璃观察钾元素的焰色; B、氢氧化亚铁易被氧化,应把胶头滴管伸入氯化亚铁溶液中滴加氢氧化钠; C、钠与氧气加热生成过氧化钠; D、溶解度与溶解放热多少无关; 11.B 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中 Fe 元素化合价由+2 价变为+6 价、 O 元素化合价由-1 价变为 0 价和-2 价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是 还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,据此分析解答。 A.反应中 FeSO4 在反应中作还原剂,则 Na2FeO4 为氧化产物; C.反应中元素化合价升高的数目为:2×(6-2)+2×[0-(-1)]=10,所以 2molFeSO4 发生反应时, 反应中转移电子的数目为 10mol; D.Na2O2 与水反应生成 NaOH,同时生成氧气,因此 Na2O2 不是碱性氧化物。 12.B 沉淀量最大时,溶液为氯化钠溶液,由原子守恒可知, n(HCl)=n(NaCl)=n(NaOH)=0.3L×2mol/L=0.6mol,可知盐酸的浓度为 =3mol/L。 13.B ①可由铁在氧气中燃烧制得;② 不与水反应,无法通过化合反应制得硅酸;③ 可由 氧化得到;④无法通过化合反应得到;⑤可由 和 高温下反应得到; 因此②④无法通过化合反应得到。 14.B Cl2 生成 ClO-与 ClO3-是被氧化的过程,化合价分别由 0 价升高为+1 价和+5 价,ClO-与 ClO3- 的物质的量浓度之比为 1:2,则可设 ClO-为 1mol,ClO3-为 2mol,被氧化的 Cl 共为 3mol。 失去电子的总物质的量为 1mol×(1-0)+2mol×(5-0)=11mol,氧化还原反应中氧化剂和还 原剂之间得失电子数目相等,Cl2 生成 NaCl 是被还原的过程,化合价由 0 价降低为-1 价, 则得到电子的物质的量也应为 11mol,因此被还原的 Cl 的物质的量为 11mol,所以被还原 的氯元素和被氧化的氯元素的物质的量之比为 11mol:3mol=11:3。 15.C A. 实验后,装置 B 中生成黑色的四氧化三铁固体; B. 虚线框 C 处为验证生成的为氢气,其密度小于空气,应该选择装置乙; C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,生成的氢气可与氧化铜反应生 成单质铜,则可观察到铜丝由黑变红; D. 实验后,将装置 B 中的固体溶足量稀硫酸,所得溶液中可能含有 Fe3+,若铁粉过量时可 能不含有 Fe3+; 16.B A.氯水中生成了盐酸和次氯酸,盐酸具有酸性,次氯酸具有强氧化性漂白,所以向新制氯 0.6mol 0.2L 2SiO 3Fe(OH) 2Fe(OH) 2SiO CaO 水中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色; B.硝酸分解生成二氧化氮、氧气和水,二氧化氮是红棕色气体,浓硝酸溶解了二氧化氮而 呈黄色; C.铁与水蒸气在高温下的反应产物为 Fe3O4 和 H2; D.浓硫酸能将有机物中 H、O 元素以 2:1 水的形式脱去而体现脱水性,故浓硫酸具有脱 水性,可使蔗糖脱水生成炭黑; 17.(1)2 4 2 2 1 2 (2)② (3)H2O+Cl2==HCl+HClO (4)5KClO3+6HCl(浓) 5KCl+6ClO2↑+3H2O 18.(1)除 HCl 、浓 H2SO4 (2)Fe2O3+3H2 2Fe+3H2O FeO+H2 Fe+H2O (3)16 g (4)防止空气中水蒸气进入 偏大 【解析】(4)U 型管质量增加的 7.2g 是水,物质的量是 7.2g÷18g/mol=0.4mol,其中氧原子 的物质的量是 0.4mol。设 FeO、Fe2O3 物质的量均为 xmol,根据氧原子守恒可知 x+3x=0.4, 解得 x=0.1,则混合物中 Fe2O3 的质量为 160g/mol×0.1mol=16g;(5)干燥管 F 的作用防 空气中水蒸气对实验干扰,若无干燥管 F,空气中的水蒸气被 E 吸收则所测生成水的质量增 大,导致氧的含量增大,Fe2O3 的质量将偏大; 19.(1)Mg(OH)2 (2)AlO2-+H++H2O=Al(OH)3↓ (3)2.67g 0.13mol 【详解】(1)由上述分析可知,A 为 Mg(OH)2,因为加入 10 mL 盐酸恰好中和过量的 NaOH,再加盐酸沉淀增多,说明 AlO2-转化为 Al(OH)3,故 A 点沉淀物为 Mg(OH)2; (2)由上述分析可知,A 点至 B 点发生反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓; (3)AB 段发生反应:AlO2-+H+=Al(OH)3↓,则 n[Al(OH)3]=n(HCl)=1mol/L× (0.03-0.01)L=0.02mol,根据铝原子守恒得 n(AlCl3)=n[Al(OH)3]=0.02mol,氯化铝的 质量为:0.02mol×133.5g/mol=2.67g; A 点沉淀的是氢氧化镁,则 n(Mg(OH)2)= =0.02mol,根据 Mg 原子守恒得 n(MgCl2)=n[Mg(OH)2]=0.02mol,B 点溶液1.16 58 / g g mol 中存在的溶质是 NaCl,由 Na+离子和 Cl-离子守恒得,原混合物中 n(NaOH)=n(NaCl)=n (Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol。 20.(1)a (2) (3) (4)稀盐酸和 (5) (6)37.5% 【详解】(1)焙烧时加入焦炭是最好的选择,焦炭可以还原铁的氧化物和硅的氧化物,过量 的焦炭在酸浸时不溶于硫酸,过滤即可除去,答案选 a; (2)根据分析,过滤 1 后的溶液主要是 溶液; (3) 极易被空气中的氧气氧化; (4)只要检验沉淀中是否含有 即可,因此我们可以取最后一次洗涤液,加入稀盐酸和 溶液,若无白色沉淀产生则证明已经洗涤干净; (5)空气中有氧气,氧气可将 氧化成 ,另一种氧化物应该是碳元素形成的; (6)首先根据 算出铁元素的质量,铁的质量与氧化铁的摩尔质量比为 ,因此理论上能产生 240t 的铁红,产率为 。 21.(1)饱和碳酸氢钠溶液 (2)d、a、b、f 、e、c (3)钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 (4)加入足量 BaCl2 溶液(或足量 CaCl2 溶液)后滴入酚酞试液(或测 pH) 有白色沉淀产生,酚酞不变红(pH=7) (5)12Na+11CO2=6Na2CO3+C+4CO 【详解】(1)装置 B 为吸收 HCl 气体,且不能吸收二氧化碳,则溶液为饱和的碳酸氢钠溶液; (2) Na 能和空气中的氧气反应,则需先通入一定量的二氧化碳排净装置中的空气,再点燃酒 精灯,使 Na 与二氧化碳反应;熄灭酒精灯,待装置恢复至室温时,关闭 K1 和 K2 ,称量硬 质玻璃管的质量; (3)根据实验现象,钠能在二氧化碳中燃烧,产生黄色火焰,且生成黑色的单质碳; (4)若只有碳酸钠,向步骤 1 中加入氯化钡时,能产生溶于酸的白色沉淀和 NaCl 溶液,则在 室温时溶液的 pH 为 7; (5)m(Na)=69.0-66.7=2.3g,固体增重为 72.1-69.0=3.1g,根据 Na 原子守恒,碳酸钠的质量为 4FeSO 2+ + 3+ 2 24Fe +O +4H =4Fe +2H O 2BaCl 3 2 2 3 24FeCO +O 2Fe O +4CO煅烧 4FeSO 2+Fe 2- 4SO 2BaCl 2+Fe 3+Fe 500t 16.8%=84t× 56:160=7:20 90t 100%=37.5%240t × 5.3g,则 C 的质量为 0.1g,n(Na2CO3):n(C)= : =6:1。 5.3 106 0.1 12查看更多