- 2021-07-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届山东省泰安市宁阳一中高二上学期阶段性考试一(2017
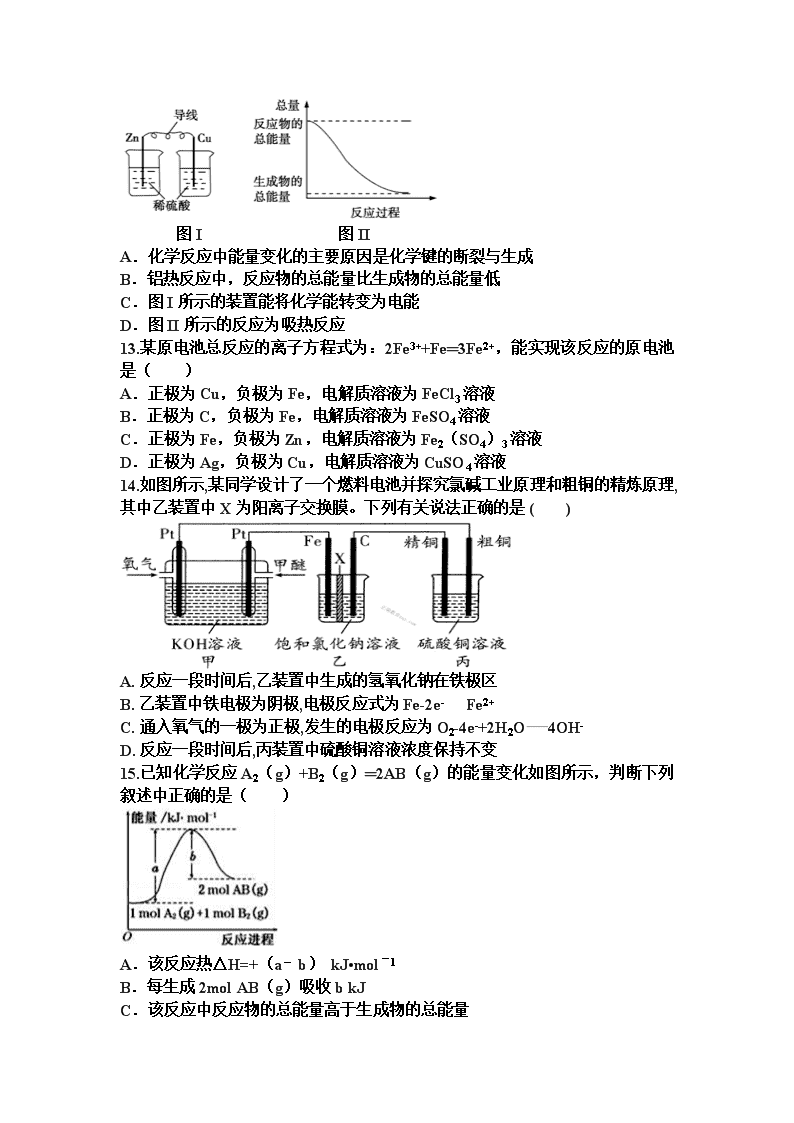
2017-2018 学年上学期高二阶段性考试一 化 学 试 题 2017 年 9 月 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷 1-5 页 和第Ⅱ卷 6-8 页。满分 100 分,考试时间 90 分钟 相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56 Zn 65 Cu 64 第Ⅰ卷 (共 50 分) 选择题(每题 2 分,共 50 分) 1.下列能源组合中,均属于新能源的一组是( ) ①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢 能. A.①②③④ B.①⑤⑥⑦⑧ C.③④⑤⑥⑦⑧ D.③⑤⑥⑦⑧ 2.下列关于盖斯定律的说法不正确的是( ) A.不管反应是一步完成还是分几步完成,其反应热相同 B.反应热只与反应体系的始态和终态有关,而与反应的途径无关 C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 D.根据盖斯定律,热化学方程式中△H 直接相加即可得总反应热 3.已知化学反应 A2(g)+B2(g)═2AB(g)△H=Q kJ•mol﹣1,其能量变化如 图所示,则 Q 的值正确的是( ) A.a﹣b B.a C.﹣b D.b﹣a 4.已知在 298K 时下述反应的有关数据如下: C(s)+ O2(g)═CO(g)△H1=﹣110.5kJ•mol﹣1 C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ•mol﹣1 则 C(s)+CO2(g)═2CO (g)的△H 为( ) A.+283.5 kJ•mol﹣1 B.﹣172.5 kJ•mol﹣1 C.+172.5 kJ•mol﹣1 D.﹣504 kJ•mol﹣1 5.已知 1g 氢气完全燃烧生成水蒸气时放出热量 121kJ,且氧气中 1mol O=O 键 完全断裂时吸收热量 496kJ,水蒸气中 1mol H﹣O 键形成时放出热量 463kJ,则 氢气中 1mol H﹣H 键断裂时吸收热量为( ) A.920kJ B.557kJ C.436kJ D.188kJ 6.以下几个热化学方程式,能表示燃烧热的热化学方程式是( ) 2 1 A.C(s)+ O2(g)═CO(g)△H=110.5 kJ•mol﹣1 B.C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1 C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1 D.H2(g)+ O2(g)═H2O(g)△H=﹣241.8 kJ•mol﹣1 7.实验室用 4mol SO2 与 2mol O2 进行下列反应:2SO2(g)+O2(g) 2SO3 (g);△H=﹣196.64kJ/mol,当放出 314.624kJ 热量时,SO2 的转化率为( ) A.40% B.50% C.80% D.90% 8.已知:H2(g)+F2(g)═2HF(g)△H=﹣270kJ/mol,下列说法正确的是( ) A.2L 氟化氢气体分解成 1L 的氢气和 1L 的氟气吸收 270kJ 热量 B.1mol 氢气与 1mol 氟气反应生成 2mol 液态氟化氢放出的热量小于 270kJ C.在相同条件下,1mol 氢气与 1mol 氟气的能量总和大于 2mol 氟化氢气体的 能量 D.1 个氢气分子与 1 个氟气分子反应生成 2 个氟化氢分子放出 270kJ 热量 9.已知反应:①101kPa 时,C(s)+ O2(g)═CO(g)△H1=﹣110.5kJ/mol ②稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H2=﹣57.3kJ/mol. 下列结论正确的是( ) A.若碳的燃烧热用△H3 来表示,则△H3<△H1 B.若碳的燃烧热用△H3 来表示,则△H3>△H1 C.浓硫酸与稀 NaOH 溶液反应的中和热为 57.3kJ/mol D.稀醋酸与稀 NaOH 溶液反应生成 1mol 水,放出 57.3kJ 热量 10.已知充分燃烧 a g 乙炔气体时生成 1mol 二氧化碳气体和液态水,并放出热量 b kJ,则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol B.C2H2(g)+ O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol 11.室温下将 1mol 的 CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△ H1,将 1mol 的 CuSO4 (s)溶于水会使溶液温度升高,热效应为△H2 ; CuSO4•5H2O 受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O (l),热效应为△H3.则下列判断正确的是( ) A.△H2>△H3 B.△H1>△H3 C.△H1=△H2+△H3 D.△H1+△H2>△H3 12.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法 正确的是( ) 2 1 2 1 2 1 2 5 图 I 图 II A.化学反应中能量变化的主要原因是化学键的断裂与生成 B.铝热反应中,反应物的总能量比生成物的总能量低 C.图 I 所示的装置能将化学能转变为电能 D.图 II 所示的反应为吸热反应 13.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池 是( ) A.正极为 Cu,负极为 Fe,电解质溶液为 FeCl3 溶液 B.正极为 C,负极为 Fe,电解质溶液为 FeSO4 溶液 C.正极为 Fe,负极为 Zn,电解质溶液为 Fe2(SO4)3 溶液 D.正极为 Ag,负极为 Cu,电解质溶液为 CuSO4 溶液 14.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理, 其中乙装置中 X 为阳离子交换膜。下列有关说法正确的是 ( ) A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 B. 乙装置中铁电极为阴极,电极反应式为 Fe-2e- Fe2+ C. 通入氧气的一极为正极,发生的电极反应为 O2-4e-+2H2O 4OH- D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 15.已知化学反应 A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列 叙述中正确的是( ) A.该反应热△H=+(a﹣b) kJ•mol﹣1 B.每生成 2mol AB(g)吸收 b kJ C.该反应中反应物的总能量高于生成物的总能量 D.断裂 1mol A﹣A 和 1mol B﹣B 键,放出 a kJ 能量 16.利用人工光合作用合成甲酸的原理为 2CO2+2H2O 2HCOOH+O2,装置如 图所示,下列说法不正确的是( ) A.该装置将太阳能转化为化学能和电能 B.电极 1 周围 pH 减小 C.电极 2 上发生的反应为 CO2+2H++2e﹣═HCOOH D.H+由电极 2 室经过质子膜流向电极 1 室 17.锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( ) ①锌极有气泡产生 ②电子由 Zn 经外电路流向 Cu ③负极:Zn+2e﹣=Zn2+④Cu2+在溶液中由 Cu 棒向 Zn 棒迁移. A.①②④ B.①②③ C.② D.②④ 18.如图所示装置中,观察到电流计指针偏转;M 棒变粗;N 棒变细,由此判断 表中所列 M、N、P 物质,其中可以成立的是( ) M N P A Zn Cu 稀 H2SO4 溶液 B Cu Fe 稀 HCl 溶液 C Ag Zn AgNO3 溶液 D Zn Fe Fe(NO3)3 溶液 19.如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极 X、Y,外电路中电 子流向如图所示,关于该装置的下列说法正确的是( ) A.外电路的电流方向为:X→外电路→Y B.若两电极分别为 Fe 和碳棒,则 X 为碳棒,Y 为 Fe C.X 极上发生的是还原反应,Y 极上发生的是氧化反应 D.若两电极都是金属,则它们的活动性顺序为 X>Y 20.X、Y、Z、W 四块金属分别用导线两两相连浸入稀硫酸中组成原电池.X、Y 相连时,X 为负极;Z、W 相连时,电流方向是 W→Z ;X、Z 相连时,Z 极上 产生大量气泡;W、Y 相连时,W 极发生氧化反应.据此判断四种金属的活动 性顺序是( ) A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X 21.某锂离子电池用含有 Li+的导电固体作为电解质.充电时,Li+还原为 Li,并 以原子形式嵌入电极材料碳 C6 中,以 LiC6 表示,电池反应为 CoO2+Li C6 LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时 C6 电极是作 为( ) A.阴极 B.阳极 C.负极 D.正极 22.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐 蚀,示意图如图.下列说法不正确的是( ) A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B.若水膜中溶解了 SO2,则铁铆钉腐蚀的速率变小 C.铜极上的反应是 2H++2e﹣═H2↑,O2+4e﹣+4H+═2H2O D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 23.铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe (OH)2+2Ni(OH)2.下列有关该电池的说法错误的是( ) A.电池的电解液为碱性溶液,负极为 Fe B.电池放电时,负极反应为 Fe+2OH﹣﹣2e﹣═Fe(OH)2 C.电池充电过程中,阴极附近溶液的 pH 减小 D.电池充电时,OH﹣向阳极迁移 24.如图所示,甲池的总反应式为:CH4+2O2+2KOH=K2CO3+3H2O,下列说法 正确的是( ) A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 B.甲池中正极的电极反应式是 O2+4e﹣+4H+=2H2O C.反应过程中,乙池的 pH 逐渐减小 D.甲池中消耗 O2 的体积与丙池生成气体的总体积在相同条件下的比值为 1:2 25.用惰性电极电解 M(NO3)x 的水溶液,当阴极上增重 a g 时,在阳极上同时产 生 b L(标准状况)氧气,从而可知 M 的相对原子质量是( ) A. B. C. D. 第 II 卷 本卷共 4 题,共 50 分 26. (共 14 分)50mL 0.50mol•L﹣1 盐酸与 50mL 0.55mol•L﹣1 NaOH 溶液在图示 的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列 问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是 . (2)烧杯间填满碎纸条的作用是 . (3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小” 或“无影响”). (4)实验中改用 60mL 0.50mol•L﹣1 盐酸跟 50 mL 0.55mol•L﹣1 NaOH 溶液进行 反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所 求中和热 (填“相等”或“不相等”),简述理由: . (5)用相同浓度和体积的氨水代替 NaOH 溶液进行上述实验,测得的中和热的 数值会 . b ax4.22 b ax4.22 b ax6.5 b ax5.2 27.(共 10 分)A、B、C、D 是元素周期表中的短周期元素,且原子序数依次增 大.A 元素原子中无中子,B 元素的一种同位素常用于文物考古,且该元素形成 的化合物种类最多,D 元素的原子核外最外层电子数是次外层电子数的三倍.回 答下列问题: (1)D 元素的符号是 ,C 元素组成的单质 C2 的电子式是 . (2)C2A4 可作为火箭发动机的燃料,与氧化剂 C2D4 反应生成 C2 和 A2D.已知: ①C2(g)+2D2(g)═C2D4(l)△H1═﹣19.5kJ/mol ②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═﹣534.2kJ/mol 写出液体燃料 C2A4 与液态 C2D4 反应的热化学方程式: . (3)在230℃和催化剂存在的条件下,将 BD2 与 A2 转化为 BA3DA(g)和 A2D(g) .如图为生产 1mol BA3DA(g)的能量变化示意图: 已知破坏 1mol 不同共价键的能量(kJ)分别是: B﹣A B﹣D B=D A﹣A A﹣D 413.4 351 745 436 462.8 ①写出 BD2 和 A2 转化为 1mol BA3DA(g)和 A2D(g)的热化学方程式: ②已知 E1=8.2kJ•mol﹣1,则 E2= 。 28.(共 16 分)如图所示,U 形管内盛有 100mL 的溶液,按要求回答下列问题: (1)打开 K2,闭合 K1,若所盛溶液为 CuSO4 溶液:则 A 为 极,B 极 的电极反应式为 .若所盛溶液为 KCl 溶液:则 B 极的电极反应式为 ,K+移向 极(填 A、B) (2)打开 K1,闭合 K2,若所盛溶液为滴有酚酞的 NaCl 溶液,则: ①A 电极附近可观察到的现象是 . ②反应一段时间后打开 K2,若忽略溶液的体积变化和气体的溶解,B 极产生气体 的体积(标准状况)为 11.2mL 若要使电解质溶液恢复到原状态,需向 U 形管内 加入或通入一定量的 . (3)如要用电解方法精炼粗铜,打开 K1,闭合 K2,电解液选用 CuSO4 溶液,则 A 电极的材料应换成是 ,反应一段时间后电解质溶液中 Cu2+浓度 ( 填“增大”、“减小”、“不变”). 29.(每空 2 分,共 10 分)如图,A 为直流电源,B 为浸透饱和氯化钠溶液和酚 酞试液的滤纸,C 为电镀槽,接通电路后,发现 B 上的 c 点显红色,请填空: (1)电源 A 上的 a 为 极(填正或负); (2)滤纸 B 上发生的总化学方程式为: (3)欲在电镀槽中实现铁上镀锌,接通 K 点,使 c、d 两点短路,则电极 e 上 发生的反应为: ,电极 f 上发生的反应为: ,C 槽中盛放的电镀液可以是 溶液(填一种即可). 2017-2018 学年高二上学期段考考试 化学试题参考答案 2017.9 选择题(每题 2 分,共 50 分) 1.D 2.D 3.A 4.C 5.C 6.B 7. C 8.C 9.A 10.A 11.C 12.A 13.A 14.A 15.A 16.D 17.C 18.C 19.D 20.A 21.A 22.B 23.C 24.C 25.C 26.(每空 2 分,共 14 分) (1)环形玻璃搅拌棒; (2)隔热; (3)偏小; (4)不相等;相等;因为中和热是指稀强酸与稀强碱发生中和反应 生成 1 mol H2O 所放出的热量,与酸碱的用量无关; (5)偏小; 27.(各 2 分,共 10 分) (1)O; ; (2)2N2H4 (l)+N2O4 (l)=3N2 (g)+4H2O (g)△ H=﹣1048.9kJ/mol; (3)①CO2 (g)+3H2 (g)=CH3OH(g)+H2O(g)△H═ ﹣181.6kJ/mol; ②189.8 kJ•mol﹣1.(不带单位扣一分) 28.(每空 2 分,共 16 分) (1)负;Cu2++2e﹣═Cu;O2+2H2O+4e﹣=4OH﹣;B; (2)①产生无色气泡,溶液变红色; ②HCl(答盐酸不得分); (3)纯铜;减小. 5.(每空 2 分,共 10 分) (1)正; (2)2NaCl+2H2O 2NaOH+Cl2↑+H2↑; (3)Zn﹣2e﹣=Zn2+;Zn2++2e﹣=Zn;ZnSO4、Zn(NO3)2;(答一个合 理即可)查看更多