- 2021-07-06 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氮的循环(2) 教案
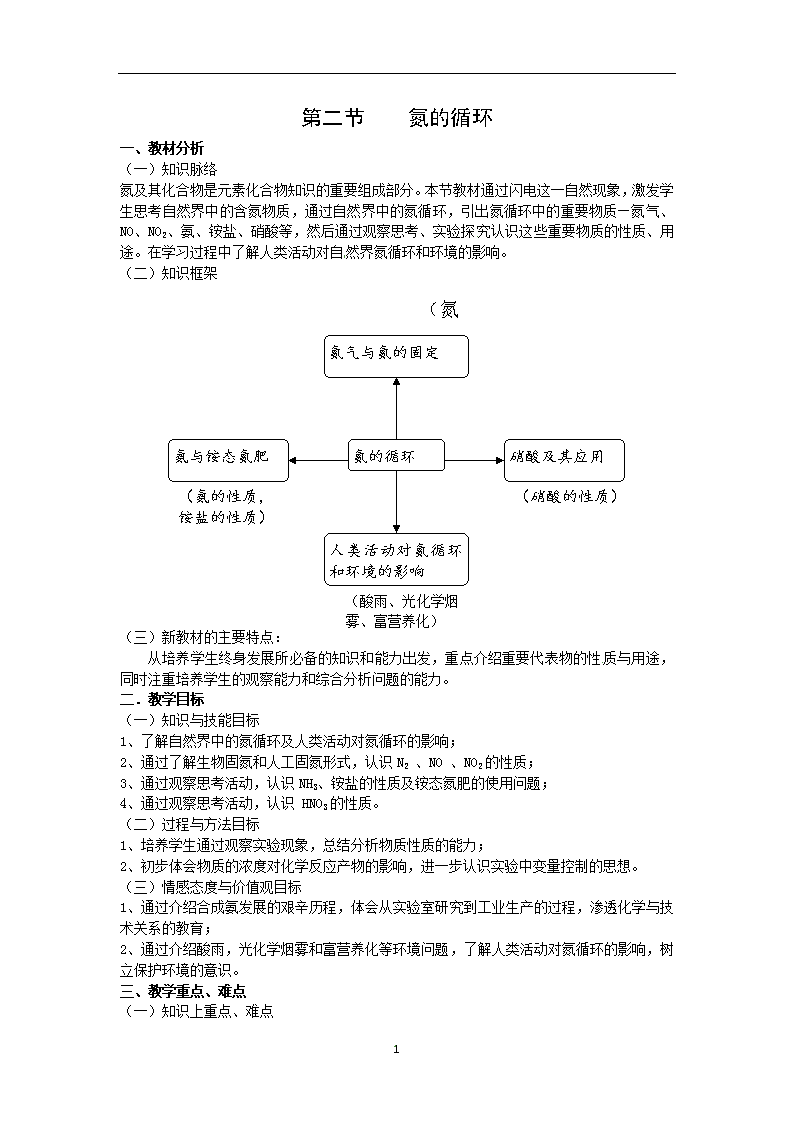
第二节 氮的循环 一、教材分析 (一)知识脉络 氮及其化合物是元素化合物知识的重要组成部分。本节教材通过闪电这一自然现象,激发学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO、NO2、氨、铵盐、硝酸等,然后通过观察思考、实验探究认识这些重要物质的性质、用途。在学习过程中了解人类活动对自然界氮循环和环境的影响。 (二)知识框架 (氮气的性质,氮的固定) 氮气与氮的固定 硝酸及其应用 氨与铵态氮肥 氮的循环 (硝酸的性质) (氨的性质, 铵盐的性质) 人类活动对氮循环和环境的影响 (酸雨、光化学烟雾、富营养化) (三)新教材的主要特点: 从培养学生终身发展所必备的知识和能力出发,重点介绍重要代表物的性质与用途,同时注重培养学生的观察能力和综合分析问题的能力。 二.教学目标 (一)知识与技能目标 1、了解自然界中的氮循环及人类活动对氮循环的影响; 2、通过了解生物固氮和人工固氮形式,认识N2 、NO 、NO2的性质; 3、通过观察思考活动,认识NH3、铵盐的性质及铵态氮肥的使用问题; 4、通过观察思考活动,认识 HNO3的性质。 (二)过程与方法目标 1、培养学生通过观察实验现象,总结分析物质性质的能力; 2、初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的思想。 (三)情感态度与价值观目标 1、通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育; 2、通过介绍酸雨,光化学烟雾和富营养化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。 三、教学重点、难点 (一)知识上重点、难点 3 重点:氮气、氨、铵盐和硝酸的性质。 难点:硝酸的氧化性。 (二)方法上重点、难点 培养学生通过观察实验现象总结分析物质性质的能力,并使学生初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的重要性。 四、教学准备 (一)学生准备 1、预习第二节-氮的循环 2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的? (二)教师准备 1、教学媒体、课件; 2、补充实验。 五、教学方法 实验引导,学生观察、归纳。 六、课时安排 三课时 七、教学过程 第2课时 【复习】高能固氮和工业固氮发生的主要反应有哪些? 【引入】氨是氮循环中的主要物质,它在人类的生产和生活中有着广泛的应用。下面我们一起来探讨氨和铵态氮肥的主要性质和用途。 【板书】 2、氨和铵态氮肥 【演示实验1】 氨的溶解性实验。 【演示实验2】 氨和氯化氢的反应。 【交流讨论】用多媒体投影所要讨论的问题: 通过观察实验现象,思考、归纳并回答下列问题: 1、完成下列表格 实 验 实验现象 结 论 实 验1 实 验2 2、通过观察实验现象,你获得了氨的哪些物理性质?是通过什么现象获得的? 3、氨的喷泉实验原理是什么?氨溶解于水仅是简单的溶解过程吗?由什么现象可以说明? 4、由[演示实验2]的现象,你能得出哪些结论? 5、氨除了能与盐酸反应外,还能与硫酸、硝酸反应吗?若能,请写出化学反应方程式。演示实验2中若将浓盐酸用浓硝酸、浓硫酸代替,会观察到同样的现象吗? 6、氨中氮元素的化合价是-3,请从化合价的角度分析,氨还可能具有什么性质?它可能与哪些物质反应? 7、氨水为何不大量用作化肥? 【归纳板书】 学生归纳,老师点评并板书。 一、氨的物理性质: 无色;有刺激性气味的气体;比空气轻;极易溶于水(1:700)。 二、氨的化学性质: 1、与水反应:NH3+H2O NH3·H2O (可逆反应) 3 NH3·H2O NH4++OH- (可逆过程) 2、与酸反应:NH3+HCl=NH4Cl NH3+HNO3=NH4NO3 2NH3+H2SO4=(NH4)2SO4 3、与氧气反应:4 NH3+5O2 4NO+6H2O 【讲解】 由于氨水易挥发,不易运输,因此氨水不大量用作化肥,而是常将氨制成各种固态的铵盐加以使用,如何科学的使用铵态氮肥呢?要解决这一问题,首先要了解铵态氮肥的主要成分——铵盐的主要性质。 【演示实验3】取少量氯化铵固体放在试管中加热。 【演示实验4】取少量碳酸氢铵固体放在试管中加热,并将生成的气体通入新制的石灰水中。 【演示实验5】在试管中加入少量氯化铵固体,再滴加适量的10%氢氧化钠溶液,加热,并将湿润的红色石蕊试纸贴在玻璃棒上靠近试管口,观察现象。 【交流讨论】用多媒体投影所要讨论的问题: 通过观察实验现象,思考、归纳并回答下列问题: 1、完成下列表格: 实 验 实验现象 结论及化学方程式 实验1 实验2 实验3 2、铵盐具有哪些物理、化学性质? 3、铵盐与碱溶液反应的本质是什么? 4、怎样合理地储存和施用铵态氮肥? 【归纳板书】 学生归纳,老师点评并板书 三、铵盐的物理性质:白色,易溶于水的晶体。 四、铵盐的化学性质: 1、受热易分解:NH4Cl NH3 ↑+HCl↑ NH4HCO3NH3 ↑ +CO2 ↑ +H2O 2、与碱溶液反应:NH4++OH- NH3 ↑+H2O NH4++OH-= NH3·H2O 保存方法:密封、阴凉通风处保存。 施用注意事项:不能与碱性物质如草木灰等混用;埋在土下以保持肥效。 【课堂小结】 学生整合本节课所学的内容。 【课堂练习】教材P80-81 1(3)(4)(5)、4(1) 【课外作业】教材P81 2、3 3查看更多