- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省宜宾四中2020届高三下学期第一次在线月考
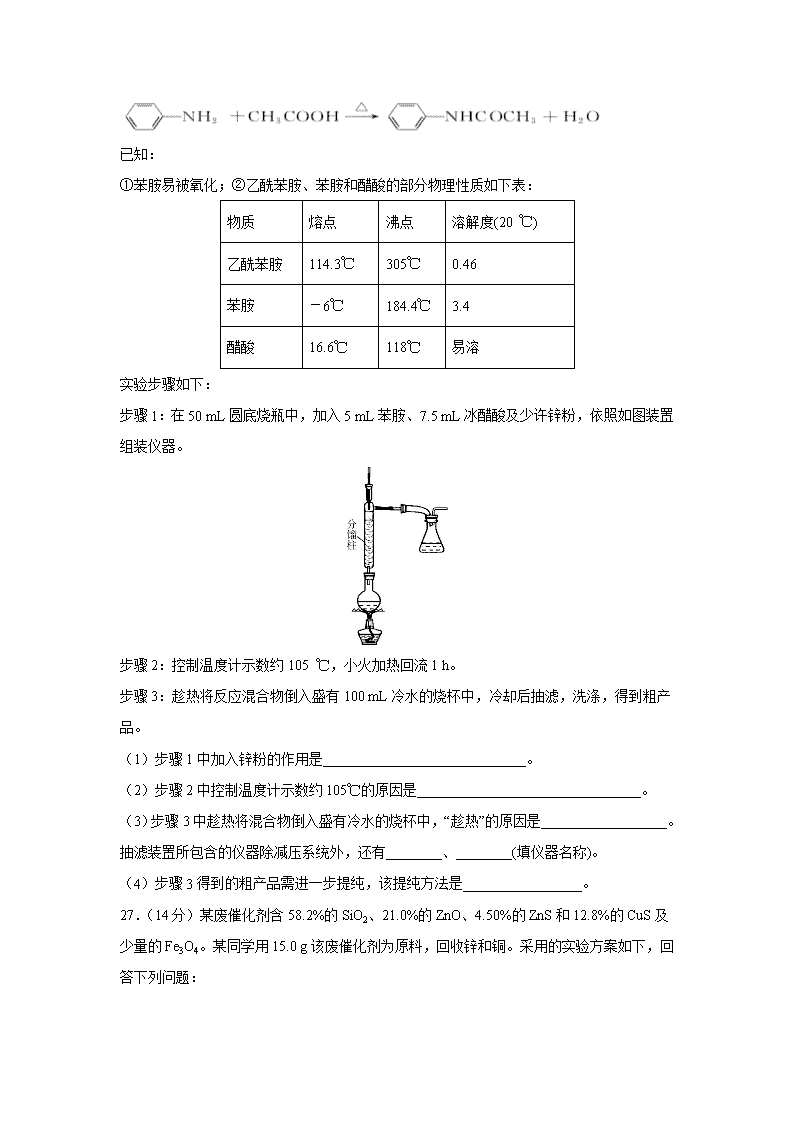
四川省宜宾四中2020届高三下学期第一次在线月考 7.十九大报告指出:建设生态文明是中华民族永续发展的千年大计。必须树立和践行绿水青山就是金山银山的理念.....,实行最严格的生态环境保护制度,形成绿色发展方式和生活方式。则下列说法不正确的是( ) A.PM2.5是指粒径不大于2.5µm的可吸入悬浮颗粒物 B.以液化石油气代替燃油可减少大气污染 C.生活污水可灌溉庄稼,所以能排放到自然界水体中 D.创新生产工艺,实现电动机车替代燃油机车符合绿色发展方式 8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是 ( ) A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L B.7.8gNa2S和Na2O2的混合物中含有的阴离子数等于0.1NA C.25℃,1.01×105 Pa,22.4LSO2中含有的原子数为3NA D.标准状况下,11.2L乙醇含有的分子数为0.5NA 9.为了除尽NaCl中所含杂质MgCl2、CaCl2和Na2SO4,先后向溶液中加入稍过量的NaOH、BaCl2和NaCO3,去除沉淀后再用盐酸调节pH=7。下列加入该三种试剂的先后顺序错误的是( ) A.NaOH、BaCl2、 Na2CO3 B.BaCl2、Na2CO3、 NaOH C.NaOH、Na2CO3、BaCl2 D.BaCl2、NaOH、Na2CO3 10.下列叙述正确的是 ( ) A.聚乙烯不能使酸性KMnO4溶液褪色 B.和 均是芳香烃,既是芳香烃又是芳香化合物 C.和分子组成相差一个—CH2—,因此是同系物关系 D.分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH 11.X、Y、Z、W是短周期主族元素,且原子序数依次增大,X元素的周期序数等于其主族序数,且X为同主族元素中唯一非金属元素,Y元素的单质是一种强力漂白剂,Z元素形成的简单离子是同周期半径最小的离子,含元素W的一种化合物是木材防火剂的原料,下列叙述错误的是 ( ) A.上述四种元素的原子半径大小:Z>W>Y>X B.Z的氢氧化物和NaHCO3均可中和过多的胃酸,治疗胃溃疡 C.X与Y可形成既含极性共价键又含非极性共价键的共价化合物 D.W与Y形成的化合物既是建筑材料,也是工艺品(玛瑙等)的原料 12.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,该电池在使用中石墨I电极上生成氧化物Y,下列说法错误的是( ) A.Y的化学式可能为NO B.石墨I极为负极,石墨Ⅱ极为正极 C.该电池放电时NO3-从右侧向左侧迁移 D.石墨I附近发生的反应为NO2+NO3ˉ-eˉ=N2O5 13.常温下,取0.1mol/L的NaA和NaB 两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( ) A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB B.常温下pH: NaA 溶液>NaB 溶液 C.X是HA,M是HB D.若常温下浓度均为0.1mol/L 的NaA和HA 的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L 26.(14分)乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下: 已知: ①苯胺易被氧化;②乙酰苯胺、苯胺和醋酸的部分物理性质如下表: 物质 熔点 沸点 溶解度(20 ℃) 乙酰苯胺 114.3℃ 305℃ 0.46 苯胺 -6℃ 184.4℃ 3.4 醋酸 16.6℃ 118℃ 易溶 实验步骤如下: 步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。 步骤2:控制温度计示数约105 ℃,小火加热回流1 h。 步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。 (1)步骤1中加入锌粉的作用是_____________________________。 (2)步骤2中控制温度计示数约105℃的原因是________________________________。 (3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。 (4)步骤3得到的粗产品需进一步提纯,该提纯方法是_________________。 27.(14分)某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题: 已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应 (1)在下列装置中,第一次浸出反应装置最合理的_______(填标号)。 (2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____________。 (提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水) (3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作__________。 (4)写出第二次浸出的化学反应方程式__________________________, 向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加_________________。 (5)滤渣2的主要成分是____________________________________。 浓缩、结晶得到硫酸锌晶体的主要仪器名称是______________________。 (6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为_____。 28.(15分)氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题: 航天领域中常用作为火箭发射的助燃剂。与氨气相似,是一种碱性气体,易溶于水,生成弱碱用电离方程式表示显碱性的原因是:______________________________________________。 在恒温条件下,和足量C发生反应,测得平衡时和的物质的量浓度与平衡总压的关系如图所示: 、B两点的浓度平衡常数关系:______填“”或“”或“” 、B、C三点中的转化率最高的是______填“A”或“B”或“C”点。 计算C点时该反应的压强平衡常数______是用平衡分 压代替平衡浓度计算,分压总压物质的量分数。 已知:亚硝酸性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数;的,在常温下向含有2mol碳酸钠的溶液中加入1mol的后,则溶液中、和的离子浓度由大到小的顺序是____________。 已知:常温下甲胺的电离常数为,且水溶液中有,常温下向溶液滴加稀硫酸至时,则溶液______。 一种煤炭脱硫技术可以把硫元素以的形成固定下来,但产生的CO又会与发生化学反应,相关的热化学方程式如下: ,反应______ 35.(15分)物质的结构决定性质。回答下列有关问题: (1)BF3的空间构型为_________。SO32-中心原子的杂化类型是______。 (2)H2S的沸点比H2O2的沸点______选填“高”或“低”;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是_________________。 (3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因_________________________________。 (4)CuCl难溶于水但易溶于氨水,其原因是______________________________;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_________。 (5)已知CaF2晶胞结构如图所示,晶体密度为g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含、NA的代数式表达) (6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是__________________;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。 36.(15分)二氢弥猴桃内酯(J)是一种调配烟草用香精,制备该物质的合成路线如下: 已知:A、B、C中含有一种相同的官能团,B和C中均含有两个甲基。 (1)A的化学名称是_________;Ⅰ中所含官能团的名称是_________。 (2)A生成B或C的反应类型是_________,G生成H的反应类型是_________。 (3)A在催化剂作用下发生加聚反应,生成的常见高分子化合物的结构简式为_________。 D生成E所用的试剂为乌洛托品,其相对分子质量为140,可由甲醛与氨气以物质的量之比3∶2反应脱去水得到,乌洛托品分子中有4个六元环,所有氢原子化学环境相同,乌洛托品的分子式为_______,结构简式为____。 (4)化合物E与足量H2 在催化剂及加热条件下反应的化学方程式为_____________________________________________。 (5)芳香族化合物X是J 的同分异构体,1mol X能与2mol NaOH 反应,X的核磁共振氢谱有5组峰,且峰面积之比为1∶1∶2∶6∶6,写出一种符合条件的X的结构简式:__________________。 (6)写出以1-丙醇为原料(其他试剂任选)制备2-丁烯酸的合成路线____________________。 【参考答案】 7.C 8.B 9.C 10.A 11.B 12.A 13.A 26.(14分) (1)防止苯胺被氧化,同时起着沸石的作用(3分) (2)温度过高,未反应的乙酸蒸出,降低反应物的利用率(2分);温度过低,又不能除去反应生成的水(2分) (3)若让反应混合物冷却,则固体析出沾在瓶壁上不易处理(2分) 吸滤瓶(1分) 布氏漏斗(1分) (4)重结晶(3分) 27. D 取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子 关小水龙头,使洗涤剂X缓缓通过沉淀物 CuS+H2O2+H2SO4=CuSO4+S+2H2O H2SO4 SiO2、S 蒸发皿 30% 28.N2 35.平面正三角形 sp3 低 BN 白磷是非极性分子,水是极性分子,CS2是非极性分子,相似相溶 Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4] 2+ 金属键 Cu3AuH8 36. 2-甲基-1,3-丁二烯(或异戊二烯) 碳碳双键和羧基 加成反应 消去反应 C6H12N4 +3H2 [或] CH3CH2CH2OHCH3CH2CHOCH3CH=CHCN CH3CH=CHCOOH查看更多