- 2021-07-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学平衡图象题的题型归纳分析学案(全国通用)
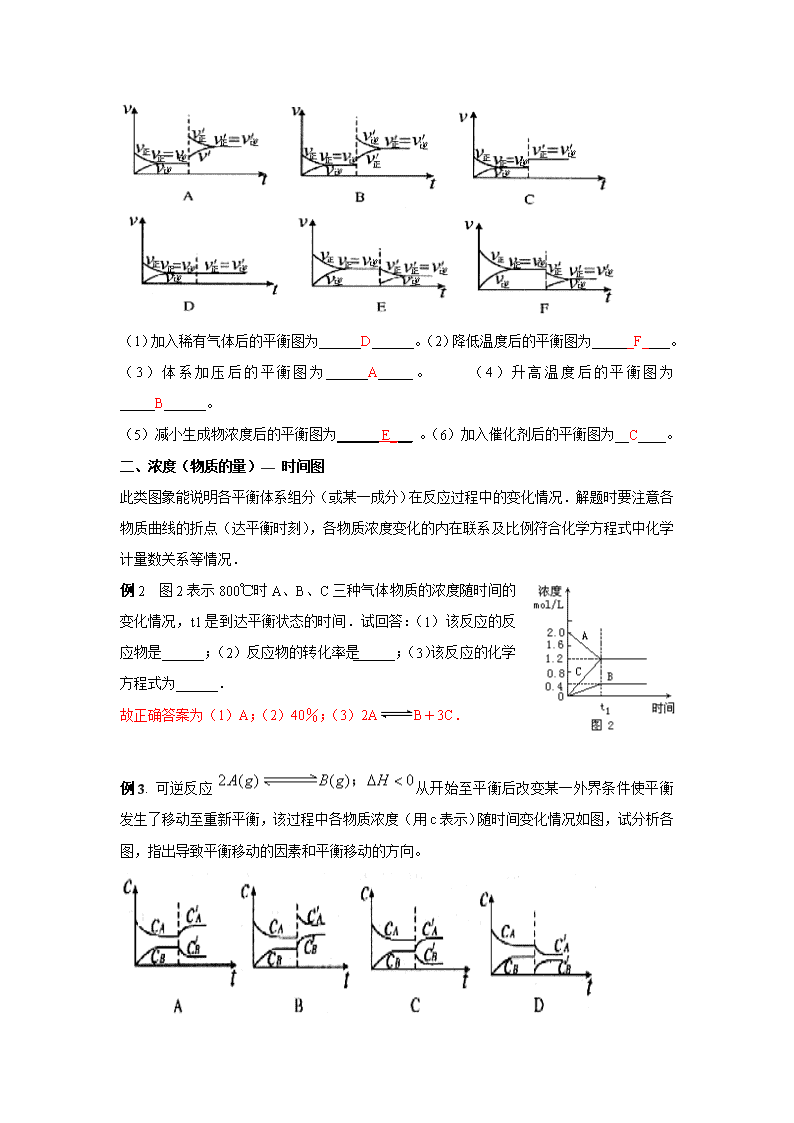
化学平衡图象题的题型归纳分析 对于化学平衡的有关图象问题,可按以下的方法进行分析: (1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。 (2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。 (3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。 (4)看清起点、拐点、终点,看清曲线的变化趋势。 (5)先拐先平。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。 (6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系 一、速率—时间图 此类图象定性地揭示了V正、V逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“逆、动、等、定、变”的基本特征,以及平衡移动的方向. 例1 对达到平衡状态的可逆反应X+YZ+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( ) A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C.X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体 答案:A 课后练习1: 已知可逆反应: 下列各图表示上述可逆反应建立平衡的过程及改变某一条件后建立起新的平衡过程的曲线: (1)加入稀有气体后的平衡图为______D______。(2)降低温度后的平衡图为______F____。 (3)体系加压后的平衡图为______A_____。 (4)升高温度后的平衡图为_____B______。 (5)减小生成物浓度后的平衡图为______ E___ 。(6)加入催化剂后的平衡图为__C____。 二、浓度(物质的量)— 时间图 此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况. 例2 图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为______. 故正确答案为(1)A;(2)40%;(3)2AB+3C. 例3. 可逆反应从开始至平衡后改变某一外界条件使平衡发生了移动至重新平衡,该过程中各物质浓度(用c表示)随时间变化情况如图,试分析各图,指出导致平衡移动的因素和平衡移动的方向。 解析: A. 改变平衡条件的瞬间,然后增大,减小,所以 平衡向逆反应方向移动,根据勒夏特列原理,只能是升高温度。 B. 改变平衡条件的瞬间,,均增大,然后减小,增大,所以 平衡向正反应方向移动,故只可能是给体系增加压强。 C. 与B相反,改变平衡条件的瞬间,、均减小,然后又增大,减小,所以 平衡向逆反应方向移动,可见C为给体系减小压强。 D. 改变平衡条件的瞬间,,减小,然后减小,增大,所以 平衡向正反应方向移动,根据勒夏特列原理,即为减小生成物的浓度。 ★三、含量—时间—温度(压强)图 这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征. 注意:先拐先平。图上先出现拐点的曲线先达到平衡,此时推理可得该曲线的温度更高、压强更大(或是浓度更大)、或加催化剂。 例3 同压、不同温度下的反应:A(g)+B(g)C(g)△H A的含量和温度的关系如图3所示,下列结论正确的是 ( ). A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0 答案:C 例4 现有可逆反应A(g)+2B(g)nC(g),△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 ( ). A.P1>P2,n>3 B.P 1<P2,n>3 C.P 1<P2,n<3 D.P 1>P2,n=3 答案:B 课后练习2:在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数( Ψ)与反应时间(t)的关系有以下图示,正确的是 A B C D 答案:B 3、在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L 此反应符合下面图像,下列叙述是正确的是 A 正反应吸热,L是气体 B 正反应吸热,L是固体 C 正反应放热,L是气体 D 正反应放热,L是固体或液体 答案:C ★四、恒压(温)线 该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强. 注意:定一议二:当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。可作一条垂直的辅助线帮助分析,(注意一定要讨论完两种情况才能给出结果:第一种T定,转化率随压强的变化;第二种P定,转化率随温度的变化)。 例5 对于反应2A(g)+B(g)2C(g),△H<0, 下列图象正确的是 ( AD ). 针对练习4、图中表示外界条件(T、P)的变化对下列反应的影响: L(s)+G(g) 2R(g);△H>0 ,y 轴表示的是 (A) 平衡时,混合气中R的百分含量 (B) 平衡时,混合气中G的百分含量 (C) G的转化率 (D) L的转化率 答案:B 五.速率—温度(压强)图 如对2SO2+O22SO3, △H<0的反应, 升温时V正、V逆的变化如图6所示. 例6 对于可逆反应:A2(g)+3B2(g)2AB3(g), △H<0下列图象中正确的是 ( AB ). 针对练习5: 下列各图是温度(或压强)对应;的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是( AC ) 化学平衡课后综合练习: 8、在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g) 2HI(g)+Q(Q>0) 即反应中各物质的浓度随时间变化情况如图1: (1)该反应的化学平衡常数表达式为 ; (2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ; (3)反应达到平衡后,第8分钟时:①若升高温度,化学平衡常数K (填写增大、减小或不变), HI浓度的变化正确 ;(用图2中a~c的编号回答) ②若加入I2,则H2浓度的变化正确的是 。(用图2中d~f的编号回答) (4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。 答案: (1)K= (2)0.167mol/L·min (3)①减小c ②f (4)查看更多