- 2021-07-05 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学(实验班)卷·2018届福建省莆田第六中学高二6月月考(2017
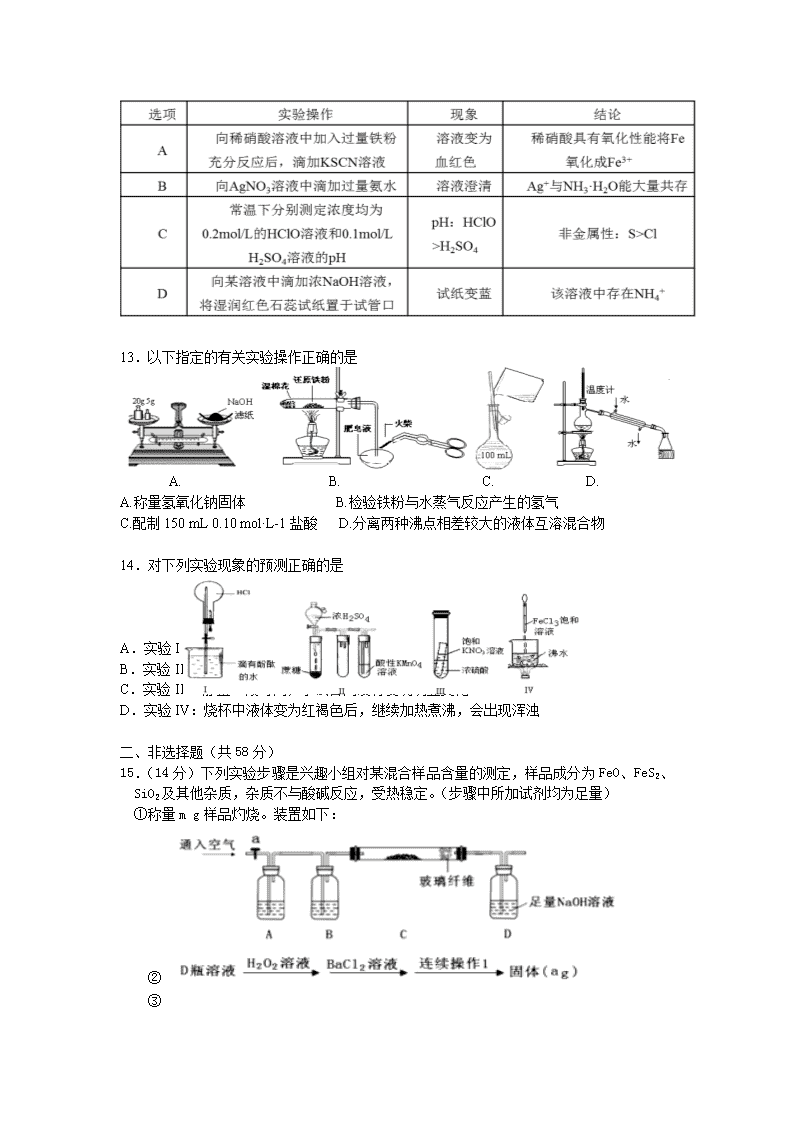
莆田第六中学2016-2017学年下6月月考试卷(实验班) 总分100分,考试时间90分钟 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 Fe-56 Cu-64 Zn-65 Ba-137 一、选择题(每小题3分,共42分) 1、近现代中国科学家在化学领域取得了卓越的成就,下列过程不涉及化学变化的是( ) 侯氏制碱法 人工合成牛胰岛素 用青蒿素治疗疟疾 独创无氰电镀新工艺 A.以NH3、CO2、NaCl为原料最终制得纯碱 B.由有机小分子合成有机高分子 C.用萃取原理从青蒿中提取青蒿素 D.以铜盐、碱等溶液为电解液镀铜 2、化学与生活密切相关,下列说法正确的是 ( ) A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 B.日常生活中,卤水点豆腐、花生中提取花生油、海水晒盐都是物理变化 C.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 D.铝比铁活泼,所以一般情况下,铁制品比铝制品更耐腐蚀 3、化学与社会、生产、生活紧切相关。下列说法错误的是 A、舞台上的幕布与布景多是用浓氯化铵溶液浸过制成的,可以防火 B、静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 C、用银器盛放鲜牛奶,能很好防止牛奶变质 D、PM2. 5对人体有害的主要原因是含有铅、铬、镉、钒、砷等金属元素 4、化学与生活密切相关。下列有关说法错误的是( ) A. 用灼烧的方法可以区分蚕丝和人造纤维 B. 食用油反复加热会产生稠环芳烃等有害物质 C. 加热能杀死流感病毒是因为蛋白质受热变性 D. 医用消毒酒精中乙醇的浓度为95% 5、以下所陈述的实验事实与原理解释均正确的是 ( ) 选项 实 验 事 实 原 理 及 解 释 A 用pH试纸测出新制氯水的pH为3 新制氯水有酸性 B SO2通入BaCl2溶液无明显现象 不符合离子反应的条件 C 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 生成的红棕色NO2气体部 分转化为无色气体NO D 甲苯能使酸性高锰酸钾溶液褪色 发生了萃取 6、在对下图所示实验装置进行的气密性检查中,一定漏气的是 7、下列说法正确的是 A.用钢瓶储存液氯或浓硫酸 B.通过灼热的铜网以除去H2中混有的O2 C.Cu与过量浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 D.用广泛pH试纸测得某溶液的pH为3.5 8、下列说法正确的是( ) A.葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 B.分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 C. 的单体是Cl-CH=CH2 D. 和 的分子式相同,化学性质也相同 9、下列关于有机化合物的结构、性质的叙述正确的是 A.糖类、油脂、蛋白质的水解产物都是非电解质 B.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 C.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 D.乙醇、乙酸分子中均含有官能团—OH,所以均有酸性,能与NaOH溶液反应 10、下列关于有机物的说法正确的是( ) A.葡萄糖与果糖、淀粉与纤维素均互为同分异构体 B. 的同分异构体中含有苯环且属于羧酸的有12种 C.2,2—二甲基丙烷可以由烯烃通过加成反应制得 D.用如右图所示的装置制取乙酸乙酯或进行Cu和浓硫酸的反应 11.吲哚-3-乙酸的结构简式如图所示,下列说法正确的是( ) A.能发生银镜发应 B.分子式为C10H10NO2 C.1mol 该物质最多可与5mol H2反应 D.吲哚-3-乙酸可发生加成反应和取代反应 12.下列有关实验操作、现象和结论都正确的是( D ) 13.以下指定的有关实验操作正确的是 A B C D A. B. C. D. A.称量氢氧化钠固体 B.检验铁粉与水蒸气反应产生的氢气 C.配制150 mL 0.10 mol·L-1盐酸 D.分离两种沸点相差较大的液体互溶混合物 14.对下列实验现象的预测正确的是 A.实验I:打开止水夹,烧瓶内出现红色喷泉 B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化 C.实验III:静置一段时间,小试管内没有发现明显变化 D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 二、非选择题(共58分) 15.(14分)下列实验步骤是兴趣小组对某混合样品含量的测定,样品成分为FeO、FeS2、SiO2及其他杂质,杂质不与酸碱反应,受热稳定。(步骤中所加试剂均为足量) ①称量m g样品灼烧。装置如下: ② ③ 请回答下列问题: (1)连接好仪器后,如何检查整套装置的气密性___________________________。 (2)A瓶内所盛试剂是_____________溶液。灼烧完成后熄灭酒精灯,若立即停止通空气,可能对实验的影响是(任写一点)____ ____________ 。 (3)步骤②中加入双氧水的离子方程式为_________________________________。若此步骤不加入双氧水对测定硫元素含量的影响是______ ____。 (填“偏高”、“偏低”或“无影响”) 。 (4)连续操作1为过滤、洗涤、干燥(烘干)、称量; 连续操作2为洗涤、_ ___、称量。 (5)从步骤③的b g滤渣入手,可测定SiO2的含量,下面各组试剂中不适合测定的是____ ____。 a. NaOH溶液、稀硫酸 b. Ba(OH)2溶液、盐酸 c. 氨水、稀硫酸 d. NaOH溶液、盐酸 (6)求样品中FeO的质量分数(列出算式即可)___ _____。 16.(14分)碘及其化合物在科研、生活等方面有广泛用途。回答下列问题: (1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。 取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表: V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00 E/mV -225 -200 -150 -100 50.0 175 275 300 325 ①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________(填序号)。 a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳 ②使用棕色滴定管的原因是____________________________________________。 ③根据表中数据,计算海带中碘的百分含量为____________。 (2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。 已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。 ① H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式, 反应甲: __________________________________________; 反应乙:_______________________________________________________。 ②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。 (3)HI不稳定,现设计实验验证上述性质。限选用0.lmol/LKI溶液、NH4I固体、pH试纸,简述实验方案。________________________________ 17. (15分) 【化学-选修3:物质结构与性质】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为: [Cu(NH3)2]OOCCH3 + CO + NH3 = [Cu(NH3)3(CO)]OOCCH3, (1)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,与CO互为等电子体的分子的电子式为 。 (2)硝酸钾中NO3-的空间构型 ,与NO3-互为等电子体的一种非极性分子化学式为 。 (3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配位体中提供孤对电子的原子是 。 (4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成. a.离子键 b.配位键 c.非极性键 d.σ键 (5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示, 写出该反应的化学方程式 。若两个最近的Fe原子间的距 离为s cm,则该晶体的密度是 g·cm-3。 18、【化学——选修5:有机化学基础】(15分) A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去): 已知: 回答下列问题: (1)A中官能团名称是 _______ B的结构简式为________,。 (2)写出反应①的化学方程式:____________________________________。 (3)D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原 子,D中氧元素的质量分数约为13.1%,则D相对分子质量为___________ ⑥的反应类型 (4)请写出满足下列条件的苯乙醛的同分异构体的结构简式(任写一种) i .含有苯环和结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1 (5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3 溶液显色的E的所有同分异构体共有(不考虑立体异构) ______种。 (6)参照的合成路线,写出由2-氯丙烷和必要的无机试剂制备的合成流程图:_______________________________________ 合成流程图示例如下:CH2 = CH2CH3CH2BrCH3CH2OH 19、【化学-选修3:物质结构与性质】(15分) 钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题: (1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°, γ=120°。 金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。 (2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知 TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为 136℃,可知TiCl4为______晶体。 (3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似, 且知两种离子晶体的晶格能数据如下: 离子晶体 KCl CaO 晶格能(kJ/mol) 715 3401 解释KCl晶格能小于CaO的原因_________________________。 钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是_ _______。 (4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。 晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。 20、【化学-选修5:有机化学基础】(15分) 化合物F是合成抗心律失常药—多非利特的中间体,以苯为原料合成F的路线如下: 已知:①CH3CH=CH2CH3CHBrCH3 ②CH3CH=CH2CH3CH2CH2Br 试回答下列问题 (1)苯→A转化的反应类型是 。 (2)化合物C→D转化的反应条件通常是 , 化合物D (填 “存在”、“不存在”)顺反异构,已知化合物C的核磁共振氢谱显示有四种峰,且峰的面积比为2︰2︰1︰3,则C的结构简式为 。 (3)写出E→F转化的化学方程式 (4)化合B的同分异构体有多种,满足以下条件的同分异构体共有 种。 ①属于芳香族化合物 ②分子结构中没有甲基,但有氨基 ③能发生银镜反应和水解反应,并且与NaOH反应的物质的量之比为1︰2 (5)苯乙酮()常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线。 月考答案 1—14(每小题3分,共42分) CBDDB DACBD DDBD 15、(14分) (1)向D中加水浸没导管,夹紧止水夹a,微热C,导管口有气泡,停止微热后, 若D导管中形成一段稳定的水柱,则气密性良好(2分) (2)氢氧化钠(氢氧化钾或其他合理答案)(1分) D中溶液倒吸、SO2不能全部排出(或测得硫元素的含量偏低)(共1分) (3)SO32-+H2O2=SO42-+H2O (2分) 偏高(2分) (4) 灼烧(2分,填“干燥(烘干)”不给分) (5)bc(2分) (6)(2分) 16. ( 14 分) (1)①bdef (2分) ②防止硝酸银见光分解(2分) ③0.508%或0.51%(2分) (2)①H2O2+I-=H2O+IO-(2分) H2O2+IO-=H2O+O2↑+I-(2分) ② (3)加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性(2分) 17、(15分) (1) 分子晶体(1分), (1分) (2) 平面正三角形 (2分) ; BF3 、SO2等 (2分) (3) sp3、sp2(2分), N (1分), (4)bd (2分) (5) 8Fe+2NH3 2Fe4N+3H2,(2分,没配平扣1分) (2分) 18、(共15分) (1)碳碳双键(2分) CH3OH(2分) (2)2CH2=CH2 + O2 Ag → 2 (2分) (3)122(1分) 氧化反应(1分) (4)(2分) (5)9 (2分) (6) (3分) 19.【化学——选修3:物质结构与性质】(15分) (1)3d24s2(1分) 2(2分) 六方最密(2分) 12(2分) (2)分子(1分) (3)KCl、CaO均形成的是离子晶体,而K+半径大于Ca2+,K+电荷量小于Ca2+的;Cl—半径大于O2—,Cl—电荷量小于O2—的;故KCl晶格能小于CaO的晶格能(2分) O>N>C(1分) (4) CaTiO3(2分) (,,)(2分) 20、(15分) (1)取代反应(1分) (2)NaOH醇溶液、加热 (2分) 不存在(2分)(2分) (3)+CH3NH2+HBr (2分) (4)3 (3分) (5)(3分)查看更多