- 2021-07-05 发布 |
- 37.5 KB |
- 16页

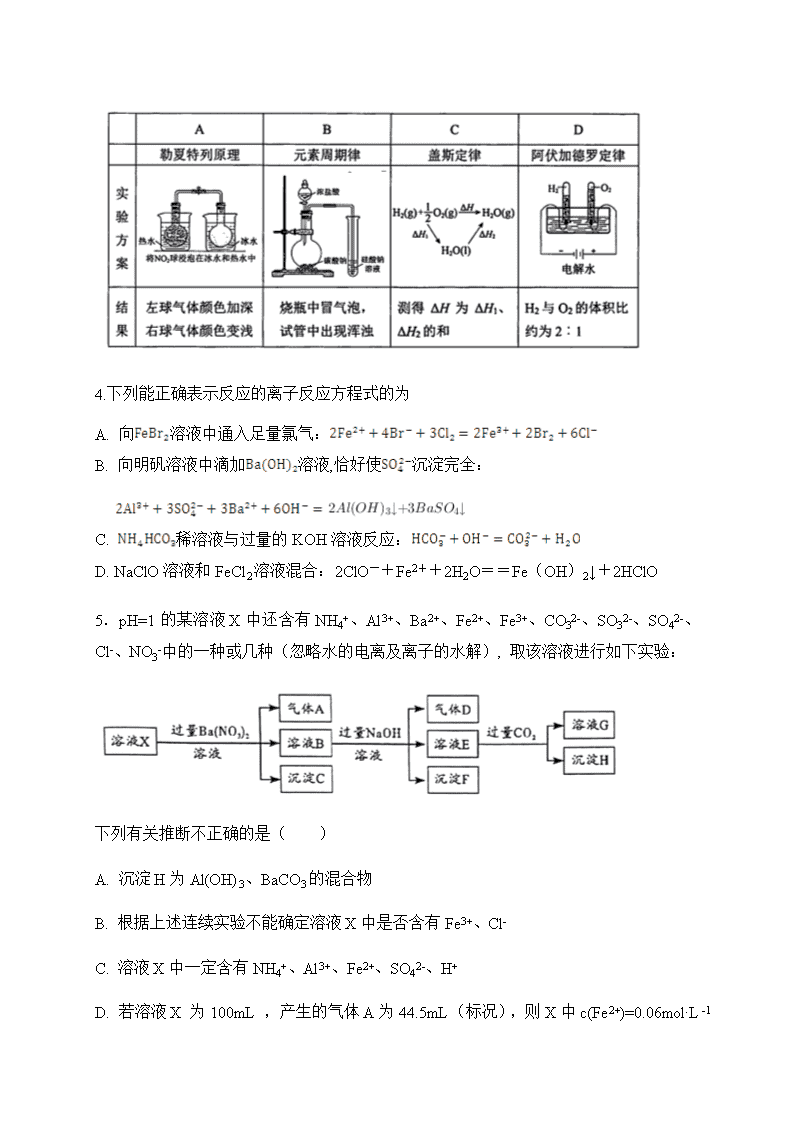

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖南省衡阳县第四中学2020届高三寒假延长作业化学试题
2020届衡阳县四中高三寒假延长-化学测试题 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Fe-56 一、选择题(共16小题,每小题3分,共48分。在每小题给出的四个选项中只有一项符合题目要求。) 1.《本草纲目》中对玻璃有如下叙述:“本作颇黎。颇黎,国名也。其莹如水,其坚如玉,故名水玉,与水精(即水晶,主要成分为SiO2)同名。有酒色、紫色、白色,莹澈与水精相似。”下列说法错误的是( ) A.文中所描述的玻璃颜色,来自某些金属氧化物 B. 将石灰石、纯碱、石英在高温下熔融,可制得普通玻璃 C. 玻璃质地坚硬,不易破碎 D.不能用带有磨口玻璃塞的玻璃试剂瓶盛放NaOH溶液 2.NA是阿伏加德罗常数的值。下列说法正确的是( ) A.pH=13的NaOH溶液中含有OH-的数目为0.1NA B.Na2O2与足量H2O反应生成0.1 mol O2时转移电子的数目为0.4NA C.常温常压下,23 g NO2与N2O4的混合气体中共含有NA个氧原子 D. 标况下,11.2LSO3所含的分子数目为0.5NA 3.实下列实验结果不能作为相应定律或原理的证据之一的是( ) 4.下列能正确表示反应的离子反应方程式的为 A. 向溶液中通入足量氯气: B. 向明矾溶液中滴加溶液,恰好使沉淀完全: C. 稀溶液与过量的KOH溶液反应: D. NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O==Fe(OH)2↓+2HClO 5.pH=1的某溶液X中还含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解), 取该溶液进行如下实验: 下列有关推断不正确的是( ) A. 沉淀H为Al(OH)3、BaCO3的混合物 B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- C. 溶液X中一定含有NH4+、Al3+、Fe2+、SO42-、H+ D. 若溶液X 为100mL ,产生的气体A为44.5mL(标况),则X中c(Fe2+)=0.06mol·L-1 6.标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是( ) A. a点对应溶液的导电性比d点强 B. 氢硫酸的酸性比亚硫酸的酸性强 C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀 D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1 7.工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: 其中第①步存在平衡:2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O 下列说法正确的是( ) A. 反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ B. 改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 C. 若2v (Cr2O72-) =v (CrO42-),说明反应①达平衡状态 D. FeSO4溶液呈酸性的原因是Fe2++ 2H2O Fe(OH) 2↓+ 2H+ 8. 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是( ) A. 分子中每个原子最外层均达到8电子稳定结构 B. P4S3中硫元素为-2价,磷元素为+3价 C. 一个P4S3分子中含有三个非极性共价键 D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol 9.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如右图所示。下列叙述正确的是( ) A.元素非金属性强弱的顺序为W>Y>Z B.Y单质的熔点高于X单质 C.W分别与X、Y、Z形成的二元化合物均只有一种 D.化合物M中W不都满足8电子稳定结构 10. 通过下列反应可合成一种医药中间体H: 下列说法不正确的是( ) A. M、N和H都能与NaHCO3溶液反应 B. M、N和H都能发生加成、氧化反应 C.1mol的M可以和2molNaOH反应 D. H的苯环上一氯代物有8种 11.固体酒精因储存和运输方便而被广泛使用。其制备方法之一如下: 下列说法不正确的是( ) A.将酒精加热到60 ℃的目的是使更多的硬脂酸溶解在其中 B.上述过程中,有酸碱中和反应发生 C.上述过程中,加入NaOH发生皂化反应 D.常温下,硬脂酸钠在酒精中的溶解度小于在水中的溶解度 12.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是( ) A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1 B. 在该条件下,反应前后的压强之比为6:5.3 C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ 13.恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+ Y(g) 2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是( ) A. 平衡时,X 的转化率为50% B. 该温度下平衡常数K=10 C. 10min内生成物Z 的反应速率0.2mol·L-1 ·min-1 D. 某一时刻,X、Y、Z的物质的量分别是0.4mol、0.2mol、1.6mol, 此刻V正查看更多