- 2021-07-05 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版选择题提速练二作业
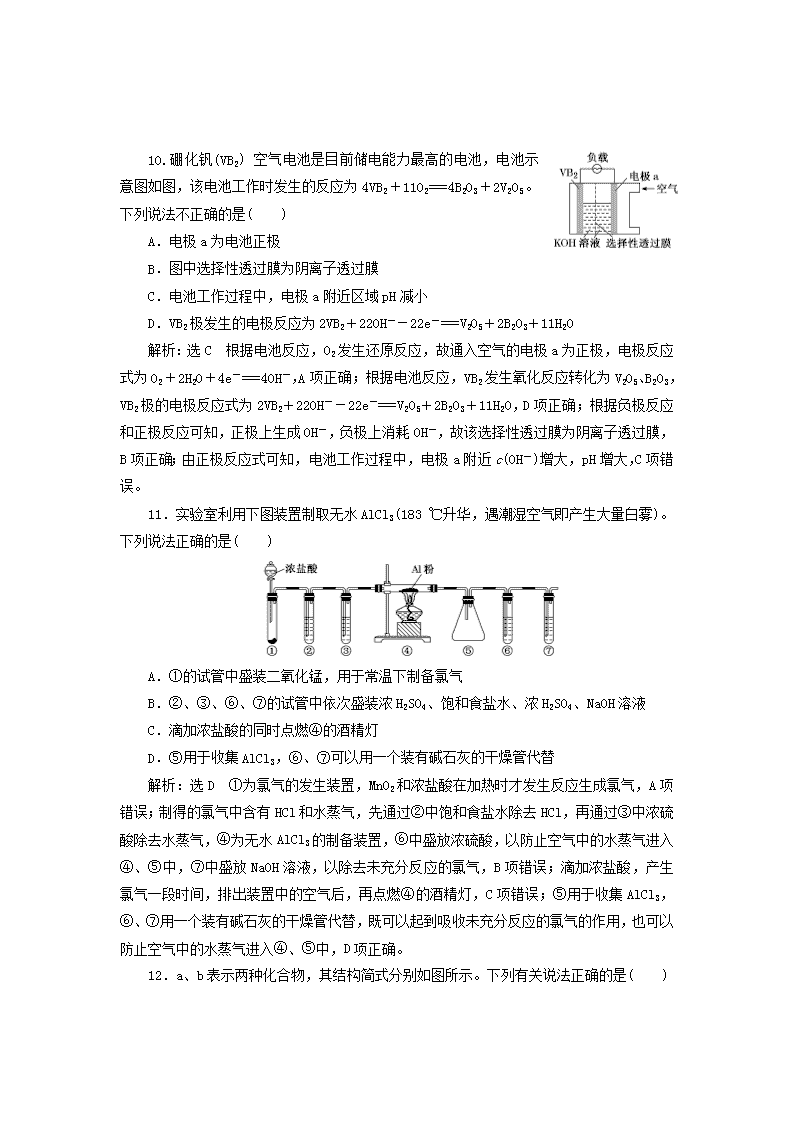
选择题提速练(二) 7.化学与社会、技术、环境、生活密切相关,下列有关说法中错误的是( ) A.石油裂解、煤的干馏和纳米银粒子的聚集都是化学变化 B.天然气、沼气都是比较清洁的能源,它们的主要成分都是烃类 C.碘酒、84消毒液、75%的酒精都可用于消毒 D.高纯硅广泛应用于太阳能电池和计算机芯片 解析:选A 纳米银粒子的聚集是物理变化,A项错误;天然气、沼气的主要成分都是甲烷,它们都是比较清洁的能源,B项正确;碘酒、84消毒液、75%的酒精都可用于消毒,C项正确;高纯硅广泛应用于太阳能电池和计算机芯片,D项正确。 8.下列反应中,属于取代反应的是( ) ①CH2===CH2+Br2CH2BrCH2Br ②2CH3CH2OH+O22CH3CHO+2H2O ③CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O ④C6H6+Br2C6H5Br+HBr A.①④ B.②③ C.①③ D.③④ 解析:选D ①是乙烯和溴发生的加成反应;②是乙醇的催化氧化反应;③是酯化反应,属于取代反应;④是苯与液溴发生的取代反应。 9.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,Y元素原子次外层电子数等于其最外层电子数的2倍。下列判断错误的是( ) A.原子半径:rW>rZ>rY>rX B.最简单气态氢化物的沸点:X>W C.Y元素的最高价氧化物能与强碱反应 D.W的最高价氧化物对应的水化物属于一元强酸 解析:选A 根据短周期主族元素X、Y、Z、W的相对位置关系,可确定Y、Z、W为期元素,再由“Y元素原子次外层电子数等于其最外层电子数的2倍”,可推出Y是Si,进一步推出X、Z、W分别为O、P、Cl。X(O)、Y(Si)、Z(P)、W(Cl)原子半径大小为rY>rZ>rW>rX,A项错误;H2O分子间可以形成氢键,沸点:H2O>HCl,B项正确;Y(Si)元素的最高价氧化物为SiO2,其能与强碱反应,C项正确;W(Cl)的最高价氧化物对应的水化物是HClO4,其属于一元强酸,D项正确。 10.硼化钒(VB2)空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时发生的反应为4VB2+11O2===4B2O3+2V2O5。下列说法不正确的是( ) A.电极a为电池正极 B.图中选择性透过膜为阴离子透过膜 C.电池工作过程中,电极a附近区域pH减小 D.VB2极发生的电极反应为2VB2+22OH--22e-===V2O5+2B2O3+11H2O 解析:选C 根据电池反应,O2发生还原反应,故通入空气的电极a为正极,电极反应式为O2+2H2O+4e-===4OH-,A项正确;根据电池反应,VB2发生氧化反应转化为V2O5、B2O3,VB2极的电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O,D项正确;根据负极反应和正极反应可知,正极上生成OH-,负极上消耗OH-,故该选择性透过膜为阴离子透过膜,B项正确;由正极反应式可知,电池工作过程中,电极a附近c(OH-)增大,pH增大,C项错误。 11.实验室利用下图装置制取无水AlCl3(183 ℃升华,遇潮湿空气即产生大量白雾)。下列说法正确的是( ) A.①的试管中盛装二氧化锰,用于常温下制备氯气 B.②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液 C.滴加浓盐酸的同时点燃④的酒精灯 D.⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替 解析:选D ①为氯气的发生装置,MnO2和浓盐酸在加热时才发生反应生成氯气,A项错误;制得的氯气中含有HCl和水蒸气,先通过②中饱和食盐水除去HCl,再通过③中浓硫酸除去水蒸气,④为无水AlCl3的制备装置,⑥中盛放浓硫酸,以防止空气中的水蒸气进入④、⑤中,⑦中盛放NaOH溶液,以除去未充分反应的氯气,B项错误;滴加浓盐酸,产生氯气一段时间,排出装置中的空气后,再点燃④的酒精灯,C项错误;⑤用于收集AlCl3,⑥、⑦用一个装有碱石灰的干燥管代替,既可以起到吸收未充分反应的氯气的作用,也可以防止空气中的水蒸气进入④、⑤中,D项正确。 12.a、b表示两种化合物,其结构简式分别如图所示。下列有关说法正确的是( ) A.a、b与苯是同分异构体 B.a、b中6个碳原子均处于同一平面 C.a的二氯代物有五种 D.b能使溴水、KMnO4溶液褪色,且褪色原理相同 解析:选C a、b的分子式均为C6H8,而苯的分子式为C6H6,故a、b是同分异构体,但二者与苯不是同分异构体,A项错误;a中6个碳原子共平面,但b中存在两个饱和碳原子,中间饱和碳原子连接的3个碳原子与该碳原子形成三角锥形,这4个碳原子不可能在同一个平面上,故B项错误;2个Cl原子取代同一个甲基上的2个氢原子时,只有1种二氯代物,2个Cl原子分别取代两个甲基上的1个氢原子时,只有1种二氯代物,1个Cl原子取代甲基上的氢原子,另外1个Cl原子取代四元环上的氢原子时,有2种二氯代物(、),两个Cl原子分别取代四元环上的两个氢原子时,只有1种二氯代物,故a的二氯代物共有5种,C项正确;b中含碳碳双键,与Br2发生加成反应,与KMnO4溶液发生氧化反应,二者褪色原理不同,D项错误。 13.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O的水解)。下列叙述正确的是( ) A.Ksp(Ag2C2O4)的数量级等于10-7 B.n点表示AgCl的不饱和溶液 C.向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 D.Ag2C2O4+2Cl-2AgCl+C2O的平衡常数为109.04 解析:选D 根据Ksp(Ag2C2O4)=c2(Ag+)·c(C2O),可得:lg Ksp(Ag2C2O4)=2lg +lg ,由题图可知,-lg =4时,lg =-2.46,则lg Ksp(Ag2C2O4)=2×(-4)-2.46=-10.46,Ksp(Ag2C2O4)=10-10.46=100.54×10-11,故Ksp(Ag2C2O4)的数量级为10-11,A项错误;通过n点向纵轴作垂线,该垂线与AgCl的沉淀溶解平衡曲线的交点为沉淀溶解平衡状态,即为AgCl的饱和溶液,而n点与该交点相比,纵坐标相同,但横坐标大于该交点的横坐标,即n点c(Cl-)大于该交点的c(Cl-),故n点Qc>Ksp (AgCl),有沉淀产生,B项错误;由题图可知当lg 与lg 相等时,达到饱和溶液时,AgCl对应的-lg 大,即c(Ag+)小,因此滴入AgNO3溶液时先产生AgCl沉淀,C项错误;该反应的平衡常数K=,两边取对数,lg K=lg -2lg ,当-lg =4时,lg =-5.75,lg =-2.46,lg K=-2.46-2×(-5.75)=9.04,故K=109.04,D项正确。 已知pOH=-lg c(OH-)。T ℃时,往50 mL 0.1 mol·L-1 MOH溶液中滴加0.1 mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如图所示,以下说法正确的是( ) A.a=12 B.盐酸与MOH溶液恰好中和时溶液pH=6.5 C.滴入盐酸体积达26.0 mL时,溶液中微粒浓度c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-) D.T ℃时,MOH的Kb>1.0×10-3 解析:选D KW=c(H+)·c(OH-),则-lg KW=pH+pOH,加入盐酸体积为25.0 mL时,pH=pOH=6.5,则KW=10-13,加入盐酸体积为0时,pOH=2,则pH=11,A项错误;盐酸与MOH溶液恰好中和时,消耗盐酸体积为50 mL,根据图像可知此时溶液pH<6.5,B项错误;滴入盐酸体积达26.0 mL时,得到物质的量之比为12∶13的MOH和MCl的混合溶液,溶液呈酸性,说明M+的水解程度大于MOH的电离程度,但电离和水解都是微弱的,故溶液中微粒浓度关系为c(Cl-)>c(M+)>c(MOH)>c(H+)>c(OH-),C项错误;T ℃时,0.1 mol·L-1 MOH的pOH=2,c(OH-)=0.01 mol·L-1,则MOH的Kb==>1.0×10-3,D项正确。查看更多