- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国版2021高考化学一轮复习课时作业14富集在海水中的元素--卤素含解析
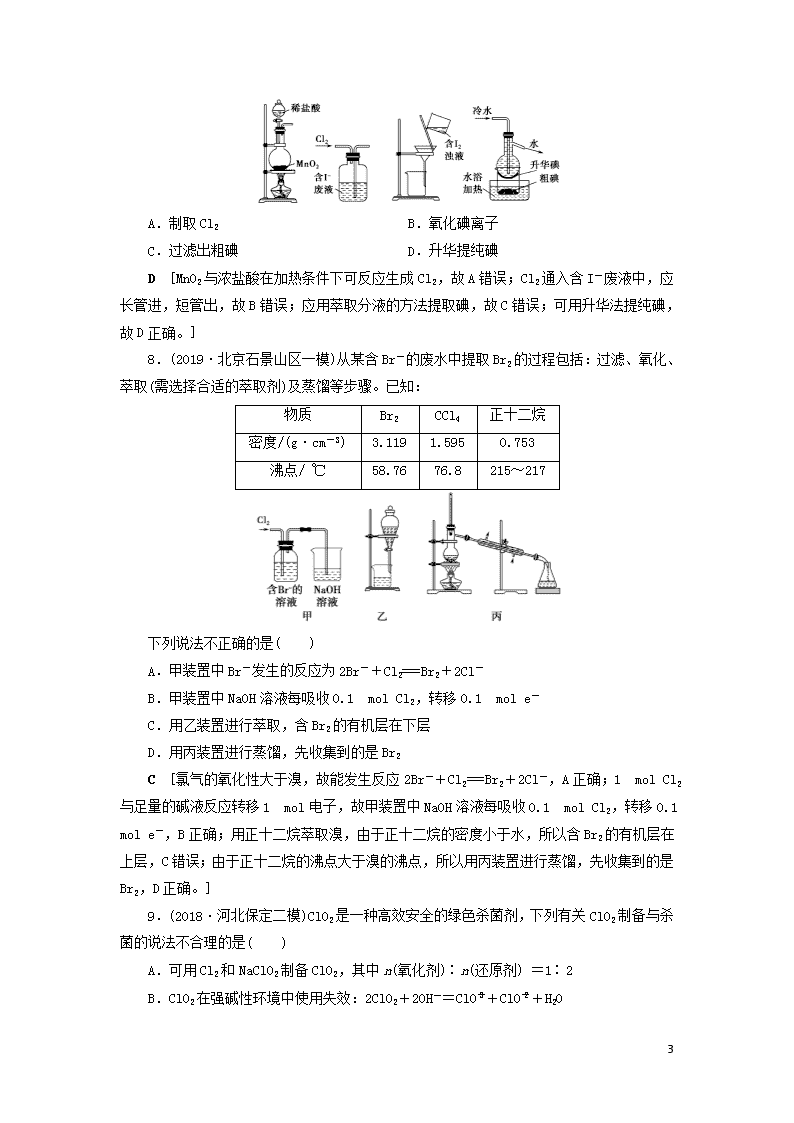
课时作业(十四) 富集在海水中的元素——卤素 1.(2019·辽宁凌源抽考)下列实验事实可用同一原理解释的是( ) A.漂白液和双氧水都能漂白物质 B.氯水和二氧化硫都能使紫色石蕊试液变色 C.将苯和裂化汽油分别滴入溴水中,水层褪色 D.加热盛有I2和NH4Cl的试管,管口有固体凝结 A [漂白液的有效成分是NaClO,NaClO、双氧水均具有强氧化性,能把有色物质氧化,A正确;氯水和二氧化硫都能使紫色石蕊试液变色,但原理不同,氯水中有次氯酸,其具有强氧化性,可以把石蕊氧化为无色物质,而二氧化硫溶于水后使溶液呈酸性,石蕊遇酸变红,B不正确;将苯和裂化汽油分别滴入溴水中,水层褪色,两者的褪色原理不同,前者把溴水中的溴萃取出来而使水层褪色,后者与溴发生了加成反应生成了无色物质,C不正确;分别加热盛有I2和NH4Cl的试管,管口有固体凝结,两者原理不同,前者是碘升华后遇冷凝华,后者是NH4Cl受热分解生成氯化氢和氨,氯化氢和氨在管口又重新化合为氯化铵,D不正确。] 2.(2019·山东潍坊模拟)下列关于氯水的说法正确的是( ) A.新制氯水中只含Cl2和H2O分子 B.光照氯水有气泡冒出,该气体是氯气 C.新制氯水可使蓝色石蕊试纸先变红后褪色 D.氯水放置数天后pH将变大 C [氯气溶于水,只有少量水发生Cl2+H2O=HCl+HClO,新制氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-,存在三种分子,A错误;新制氯水中存在HClO,HClO见光受热易分解,发生2HClO2HCl+O2↑,产生气体是氧气,B错误;新制氯水中含有HCl和HClO,盐酸显酸性,使蓝色石蕊试纸变红,HClO具有强氧化性,能把有色物质漂白,因此新制氯水可使蓝色石蕊试纸先变红后褪色,C正确;根据B选项分析,久置的氯水是稀盐酸,pH将减小,D错误。] 3.(2019·江西上饶联考)经氯气消毒的自来水,若用于配制以下溶液:①NaOH、②AgNO3、③Na2CO3、④FeSO4、⑤KI、⑥NaCl、⑦Na2SO3,不会使配制的溶液变质的是( ) A.全部 B.②④⑤⑥ C.②⑤ D.⑥ D [氯水的成分是Cl2、HCl、HClO。①NaOH和氯气、盐酸、次氯酸发生反应,溶液会变质,故错误;②Ag++Cl-===AgCl↓,溶液会变质,故错误;③Na2CO3+2HCl===2NaCl+CO2↑+H2O,溶液会变质,故错误;④2Fe2++Cl2===2Fe3++2Cl-,溶液会变质,故错误;⑤Cl2+2I-===I2+2Cl-,溶液会变质,故错误;⑥不发生反应,溶液不会变质,故正确;⑦Cl2+SO 7 +H2O===2Cl-+SO+2H+,溶液会变质,故错误;综上所述,D项正确。] 4.甲、乙、丙三瓶溶液分别为NaCl、NaBr、KI,向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙依次含有( ) A.NaBr NaCl KI B.NaBr KI NaCl C.KI NaBr NaCl D.NaCl KI NaBr B [已知氧化性:Cl2>Br2>I2,可发生:Cl2+2NaBr=2NaCl+Br2,Cl2+2KI=2KCl+I2,向甲中加入淀粉溶液和氯水,溶液变为橙色,说明有单质溴生成,没有碘单质产生,因此甲中含有NaBr,不含KI,再加入丙,颜色无明显变化,则丙中含有NaCl,则乙中含有KI。] 5.(2019·湖南怀化联考)下列关于新制氯水的说法不正确的是( ) A.颜色为浅黄绿色,说明新制氯水中有氯气分子存在 B.向新制氯水中滴加石蕊,溶液先变红,说明新制氯水有酸性 C.向品红溶液中滴加几滴新制氯水,溶液褪色,说明新制氯水有漂白性 D.向新制氯水中加入少量碳酸钙固体,充分反应后溶液中Cl-浓度减小 D [A.氯气溶于水后,部分氯气和水反应生成盐酸和次氯酸,部分氯气以分子存在于水溶液中,氯气呈黄绿色,所以新制氯水显浅黄绿色,故A正确;B.氯水中氯气和水反应生成的盐酸使石蕊试液变红色,故B正确;C.氯水溶液中氯气、HClO都强氧化性,向品红溶液中滴加氯水,溶液褪色,说明氯水中含有HClO,故C正确;D.在下列平衡:Cl2+H2OH++Cl-+HClO,由于盐酸的酸性比碳酸强,碳酸的酸性比HClO强,则若向氯水中加入少量CaCO3粉末,会和溶液中的盐酸反应,促进氯气和水的反应正向进行,氯离子浓度增大,故D错误。] 6.(2019·吉林长春模拟)从海带中提取碘单质,成熟的工艺流程如下。下列关于海水制碘的说法,不正确的是( ) 干海带海带灰悬浊液滤液碘水I2的CCl4溶液I2 A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 C.在碘水中加入几滴淀粉溶液,溶液变蓝色 D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取” A [灼烧固体时应在坩埚中,A项不正确;H2O2能将I-氧化为I2,B项正确。] 7.(2019·江西盐城模拟)下列制取Cl2,用其氧化含I-废液,回收并提纯I2的装置和原理能达到实验目的的是( ) 7 A.制取Cl2 B.氧化碘离子 C.过滤出粗碘 D.升华提纯碘 D [MnO2与浓盐酸在加热条件下可反应生成Cl2,故A错误;Cl2通入含I-废液中,应长管进,短管出,故B错误;应用萃取分液的方法提取碘,故C错误;可用升华法提纯碘,故D正确。] 8.(2019·北京石景山区一模)从某含Br-的废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适的萃取剂)及蒸馏等步骤。已知: 物质 Br2 CCl4 正十二烷 密度/(g·cm-3) 3.119 1.595 0.753 沸点/ ℃ 58.76 76.8 215~217 下列说法不正确的是( ) A.甲装置中Br-发生的反应为2Br-+Cl2===Br2+2Cl- B.甲装置中NaOH溶液每吸收0.1 mol Cl2,转移0.1 mol e- C.用乙装置进行萃取,含Br2的有机层在下层 D.用丙装置进行蒸馏,先收集到的是Br2 C [氯气的氧化性大于溴,故能发生反应2Br-+Cl2===Br2+2Cl-,A正确;1 mol Cl2与足量的碱液反应转移1 mol电子,故甲装置中NaOH溶液每吸收0.1 mol Cl2,转移0.1 mol e-,B正确;用正十二烷萃取溴,由于正十二烷的密度小于水,所以含Br2的有机层在上层,C错误;由于正十二烷的沸点大于溴的沸点,所以用丙装置进行蒸馏,先收集到的是Br2,D正确。] 9.(2018·河北保定二模)ClO2是一种高效安全的绿色杀菌剂,下列有关ClO2制备与杀菌的说法不合理的是( ) A.可用Cl2和NaClO2制备ClO2,其中n(氧化剂)∶n(还原剂) =1∶2 B.ClO2在强碱性环境中使用失效:2ClO2+2OH-=ClO+ClO+H2O 7 C.ClO2处理饮用水时残留的ClO,可用FeSO4来除去:ClO+2Fe2++4H+=2Fe3++Cl-+2H2O D.等物质的量的ClO2杀菌效果比Cl2、HClO 强 C [氯气的化合价从0升高到+4价,NaClO3中化合价从+5价降低到+4价,所以氧化剂和还原剂的比例为1∶2,A项正确;二氧化氯在强碱性环境中自身腐蚀氧化还原反应,正确,B项错误;方程式电荷不守恒,C 项错误,二氧化氯作为氧化剂,由+4价降低到-1价,杀菌效果比氯气、次氯酸强,D项正确。] 10.(2019·广西桂林模拟)ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是( ) A.通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中 B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2===2ClO+2H++O2↑ C.步骤a的操作包括过滤、洗涤和干燥 D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输 B [在ClO2发生器中一定产生ClO2气体,通入空气,可以将其排出,确保在吸收塔中被充分吸收,A项正确;吸收塔中加入了浓NaOH溶液,不可能得到H+,B项错误;冷却结晶得到NaClO2固体,经过过滤、洗涤,干燥得到产品,C项正确;气体的贮存和运输都比固体困难,所以将ClO2气体制成NaClO2固体的主要目的是便于贮存和运输,D项正确。] 11.(2019·福建泉州质检)四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是( ) A.②中应盛装饱和食盐水 B.冷凝管有冷凝、回流和导气的作用 C.反应结束时,应先停止③处的加热,后停止①处的加热 D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置 7 A [已知四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,而制得氯气中混有水蒸气,所以②中应盛装浓硫酸,故A错误;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,故B正确;反应结束时,先停止③处加热,后停止①处加热,可以使制得的TiCl4在氯气氛围中冷却,防止空气进入装置中使TiCl4变质,故C正确;因四氯化钛(TiCl4)极易水解,所以应在装置④和⑤之间加一个防止水蒸气进入④的装置,故D正确。] 12.(2019·广东茂名模拟)氯元素有多种盐类,其中亚氯酸钠(NaClO2)受热易分解。现以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: 请回答下列问题: (1)“反应1”中氧化剂与还原剂物质的量比为______;“反应2”的氧化剂是______(化学式),该反应的化学方程式为_______________________________________________。 (2)采取“减压蒸发”而不用“常压蒸发”,原因是____________________________。 (3)从“母液”中可回收的主要物质是________(化学式)。 (4)“冷却结晶”后经______(填操作名称)即可获得粗产品。 解析 (1)NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,则反应1的方程式为2NaClO3+SO2===2ClO2+Na2SO4,反应中Cl元素的化合价降低,则NaClO3为氧化剂,反应中S元素的化合价升高,则SO2为还原剂,氧化剂与还原剂物质的量比为2∶1,根据生成的目标产物NaClO2可知,反应2的方程式为H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂;(2)减压蒸发是在较低温度下进行的,防止常压蒸发温度过高,亚氯酸钠容易分解;(3)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4;(4)冷却结晶后要分离出固体,应用过滤的方法 答案 (1)2∶1 ClO2 H2O2+2ClO2+2NaOH===2NaClO2+2H2O+O2↑ (2)常压蒸发温度过高,亚氯酸钠容易分解 (3)Na2SO4 (4)过滤 13.(2019·福建泉州质检)热稳定系数和总氯量是漂白粉行业标准里的两个指标。 Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物中有O2和少量Cl2。 7 (1)加热干燥的漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有______。 (2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。 ①B中发生反应的离子方程式为________________________。 ②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案: ________________________________ ________________________________________________________________________ Ⅱ.测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下: ①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。 ②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3%的H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.100 0 mol·L-1AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液的平均体积为25.00 mL。[已知:Ksp(AgCl,白色)=1.56×10-10,Ksp(Ag2CrO4,砖红色)=9.0×10-12] (3)步骤①中,溶解、稀释过程中所用的玻璃仪器有烧杯、玻璃棒、________、________。 (4)加入H2O2水溶液,搅拌至不再产生气泡,目的是____________________(用离子方程式表示)。 (5)滴定终点的现象是__________________________________________________。 (6)该漂白粉总氯的百分含量为______。 (7)下列操作导致总氯百分含量测定结果偏高的是____(填序号)。 A.指示剂K2CrO4的用量过多 B.在滴定终点读取滴定管刻度时,俯视标准液液面 C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 解析 (1)加热干燥的漂白粉样品,观察到B中有大量无色气泡产生,说明漂白粉受热分解的产物中有O2,O元素的化合价从-2价升高到0价,根据氧化还原反应的规律可知,Cl元素的化合价应从+1价降低到-1价,所以次氯酸钙分解的固体产物中一定有CaCl2。(2)①由题给信息可知,久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2,则在B中Cl2和NaOH发生反应生成NaCl、NaClO和H2O,离子方程式为2OH-+Cl2===Cl-+ClO-+H2 7 O;②加热漂白粉时有少量氯气生成,则氯气和NaOH溶液反应后所得的溶液中含有Cl-,所以只要检验B中含有Cl-即可证明加热潮湿的漂白粉时有少量氯气生成,实验方案为取少量B中溶液,先加入稀硝酸酸化,再滴加硝酸银溶液,出现白色沉淀,说明有Cl2生成。(3)步骤①中,所需的玻璃仪器除烧杯、玻璃棒外,还需要500 mL容量瓶和胶头滴管。(4)H2O2能与ClO-发生氧化还原反应:ClO-+H2O2===Cl-+O2↑+H2O。(5)用AgNO3标准溶液进行滴定,当溶液中的Cl-完全反应后,开始生成砖红色的Ag2CrO4沉淀,所以滴定终点的现象为当滴入最后一滴标准液,溶液中出现砖红色沉淀,且半分钟内不消失。(6)由化学方程式ClO-+H2O2===Cl-+O2↑+H2O、Ag++Cl-===AgCl↓,可得关系式:ClO-~Cl-~Ag+,所以样品中氯元素的总质量m(Cl)=0.025 L×0.100 0 mol·L-1××35.5 g· mol-1=1.775 g,则该漂白粉总氯的百分含量为×100%=35.5%。(7)若指示剂K2CrO4的用量过多,溶液中CrO的浓度较大,会造成Cl-尚未完全沉淀时就有砖红色沉淀生成,消耗标准溶液的体积偏小,测定结果偏低,故A错误;在滴定终点读取滴定管的刻度时,俯视标准液液面,会使读取的标准溶液体积偏小,测定结果偏低,故B错误;滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,会使读取的标准溶液体积偏大,测定结果偏高,故C正确。 答案 (1)CaCl2 (2)①2OH-+Cl2===Cl-+ClO-+H2O ②取少量B中溶液,先加入稀硝酸酸化,再滴加硝酸银溶液,出现白色沉淀,说明有Cl2生成 (3)500 mL容量瓶 胶头滴管 (4)ClO-+H2O2===Cl-+O2↑+H2O (5)当滴入最后一滴标准液,溶液中出现砖红色沉淀,且半分钟内不消失 (6)35.5% (7)C 7查看更多