2017-2018学年安徽省淮南市第二中学高二上学期期中考试化学(理)试题
淮南二中2017—2018学年高二上学期期中化学试卷(理科)
可能用到的相对原子质量:H:1 C:12 O:16 Cl:35.5 S:32 Ag:108
N:14 Cu:64
一、选择题(每小题只有一个选项符合题意)
1.氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是( )
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.分别以稀硫酸、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.分别以稀硫酸、KOH为介质的氢氧燃料电池的总反应式相同
2.下列事实不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.向橙色K2Cr2O7溶液中加入几滴6mol/L的NaOH溶液后,溶液变为黄色
C.新制氯水中有下列平衡Cl2+H2O HCl+HClO,当加入硝酸银溶液后,氯水颜色变浅
D.对2HI(g) H2(g)+I2(g)平衡体系增加压强使气体颜色变深
3.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-=== Cl2 ↑
B.甲烷燃料电池负极的电极反应式为:O2 + 2H2O + 4e-=== 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=== Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e -=== Fe2+
4.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
5.在某温度下,有关可逆反应mA (g)+nB(g) pC(g)+qD(g)的化学平衡常数为K的说法正确的是( )
A. K越大,达到平衡时,正向反应进行的程度越小
B. K越小,达到平衡时,反应物的转化率越大
C. K随反应物浓度改变而改变
D.K随温度改变而改变
6.在一定条件下,对于A2(g)+3B2(g)2AB3(g)
反应来说,以下化学反应速率的表示中,化学反应速率最快的是( )
A.v (A2)=0.8 mol·L-1·s-1 B.v (A2)=30 mol·L-1·min-1
C.v (AB3)=1.0 mol·L-1·s-1 D.v (B2)=1.2 mol·L-1·s-1
7.下列叙述中,正确的是( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④ C.②③④ D.④⑤
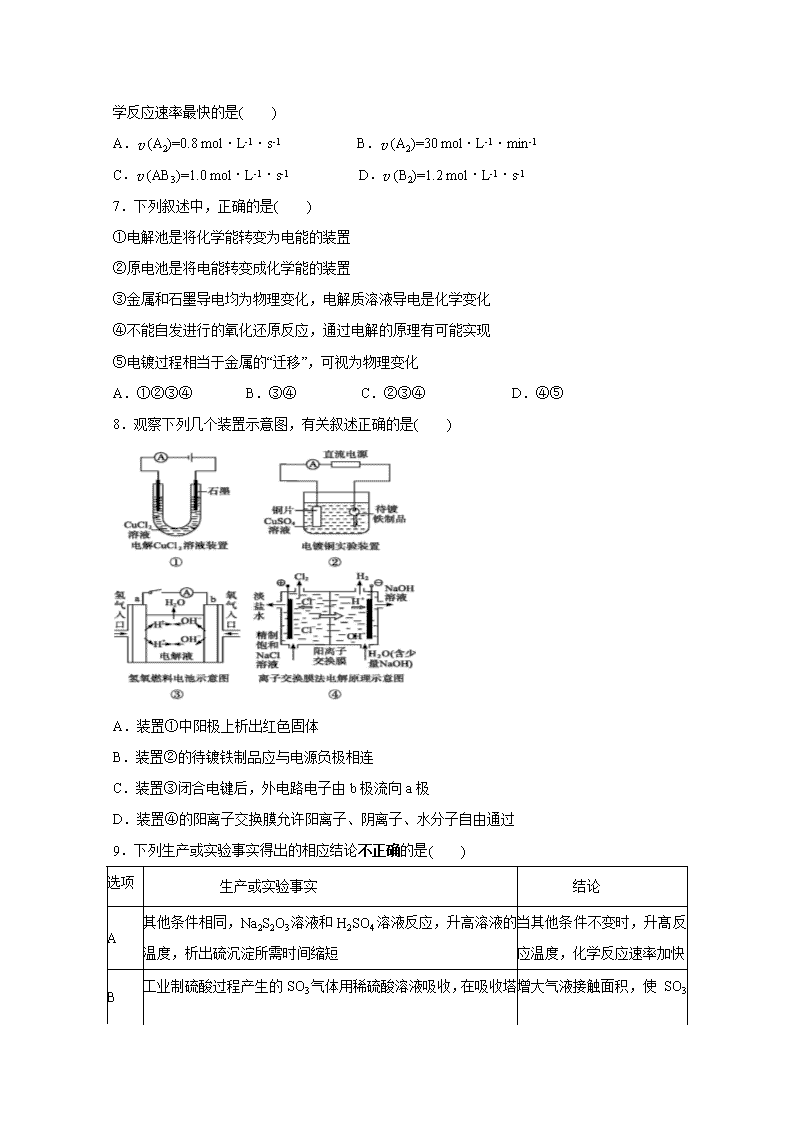
8.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源负极相连
C.装置③闭合电键后,外电路电子由b极流向a极
D.装置④的阳离子交换膜允许阳离子、阴离子、水分子自由通过
9.下列生产或实验事实得出的相应结论不正确的是( )
选项
生产或实验事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短
当其他条件不变时,升髙反应温度,化学反应速率加快
B
工业制硫酸过程产生的SO3气体用稀硫酸溶液吸收,在
增大气液接触面积,使 SO3
吸收塔里进行,吸收塔里要装填瓷环
气体的吸收速率增大
C
在容积可变的密闭容器中发生反应:2NH3(g)N2H4(1)+H2(g) ,把容器的体积缩小一半
正反应速率加快,逆反应速率减慢
D
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2〜3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
10.少量铁片与100 mL 0.01mol/L的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变氢气的产量,可以使用如下方法中的( )
①加H2O②加KNO3溶液③滴入几滴浓盐酸(不考虑浓盐酸的挥发)④加入少量铁粉⑤加入硫酸钠溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸的挥发)⑧改用10 mL 0.1 mol/L的盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.①④⑥⑦⑧
11.一定温度下,在固定容积的密闭容器中,对于可逆反应mA(g)+nB(g)pC(g)+qD(g) ,当m、n、p、q为任意正整数时,下列状态:
①体系的压强不再发生变化 ②气体的密度不再发生变化
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v (A)∶v (B)∶v (C)∶v (D)=m∶n∶p∶q
其中,一定能说明该可逆反应已达到平衡状态的是( )
A.③④ B.②③④
C.①②③④ D.①②③④⑤
12.下列热化学方程式中,正确的是( )
A.氢气的燃烧热为ΔH=-285.5 kJ·mol -1,则液态水电解生成氢气和氧气的热化学方程式为:2H2O(l) ===2H2(g)+O2(g) ΔH=+285.5 kJ·mol -1
B.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19. 3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol -1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol -1
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol -1
13.可逆反应mA(g)+nB(g)pC(g)+qD(g)速率随时间变化的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2
⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
A.②④⑤⑦ B.②④⑥⑧
C.②③⑤⑦ D.②③⑥⑧
14.有一化学平衡mA(g)+nB(g) pC(g)+qD(g) ,如下图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n
p+q
15.将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是( )
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A.①③ B.①④ C.②③ D.③④
16.在密闭容器中,一定量混合气体发生下列反应:aA (g)+bB (g) cC(g)+ dD(g)达到平衡后,测得C气体的浓度为0.5mol/L,t1时刻在恒温下,将密闭容器的体积缩小为1/2,再达到平衡时,测得C气体的浓度为0.9mol/L,则下列叙述正确的是( )
A.压缩容器体积使单位体积内活化分子数目、活化分子百分数均增多
B.t1时刻的变化使平衡向左移动,化学平衡常数变小
C.a+bp2
二、非选择题
19.(1)白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热。
P4(s,白磷)+O2(g) === P4O10(s) ΔH1=-745.8 kJ·mol -1
4P(s,红磷)+5O2(g) === P4O10(s) ΔH2=-2954 kJ·mol -1
①白磷燃烧热的ΔH=________ kJ·mol -1。
②白磷转化为红磷的热化学方程式为P4(s,白磷) ===4P(s,红磷) ΔH=-29.2 kJ·mol -1
在相同的条件下,能量较低的是________(填“白磷”或“红磷”),白磷的稳定性比红磷________(填“高”或“低”)。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:N2(g)+2O2(g) ===2NO2(g) ΔH1=+67.7 kJ·mol -1
N2H4(g)+O2(g) ===N2(g)+2H2O(g) ΔH2=-534 kJ·mol -1。
试计算1 mol肼N2H4(g)和二氧化氮NO2(g)完全反应时放出的热量为 kJ,写出肼N2H4(g)与二氧化氮NO2(g)反应的热化学方程式: 。
20.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为_____________________________________。
(2)反应开始至2 min,气体Z的平均反应速率为 。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的1/2倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
(4)在一密闭容器中发生反应N2(g)+3H2(g)2NH3(g) ΔH <0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
①处于平衡状态的时间段是________(填字母代号)。
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
②判断t1、t3、t4时刻分别改变的一个条件是:(填字母代号)
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.恒温恒容时充入氮气
t1时刻________;t3时刻________;t4时刻________。
③依据上述②中的结论,下列时间段中,氨的百分含量最高的是__________(填字母代号)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
21. (1) 用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解质溶液,
组别
A槽
B槽
1
饱和NaOH溶液
饱和CuSO4溶液
2
饱和AgNO3溶液
饱和CuCl2溶液
3
饱和Na2SO4溶液
饱和AgNO3溶液
4
饱和NaCl溶液
饱和AgNO3溶液
要满足下列要求:工作一段时间后,A槽pH上升,B槽的pH下降且这段时间内 b、c两极上反应的离子的物质的量相等。
①应选择的电解质溶液是上述四组中的第________组(填数字)。
②写出该组电解过程中a、b电极上的电极反应式和B槽电解总反应化学方程式:
a极_______________________________________________________________________
b极_______________________________________________________________________
B电解槽总反应化学方程式:_________________________________________________
③理论上当这段时间内b极上析出7.1 g电解产物时,a极上析出产物的质量为________g(不考虑气体的溶解);若B槽电解质溶液为500 mL,(电解时c电极上没有氢气产生,且忽略电解前后电解质溶液的体积变化和盐类水解对结果的影响),则此时B槽中的c(H+)比电解前增加了________mol/L。
(2)利用如右图所示的装置,可以模拟铁的电化学防护。
①若X为锌,为减缓铁的腐蚀,开关K应置于__________处(填“M”或“N”)。
②若X为碳棒,开关K置于N处,该电化学防护法称为_____________________。
22.石油是工业的血液,石油热裂解的副产物甲烷可以用来制备氢气,其生产流程如下图:
流程中的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表:
温度/℃
400
500
830
1000
平衡常数K
10
9
1
(1)该反应的化学平衡常数表达式为:K=_________________。
(2)从上表可以推断:此正反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO(g)和2mo1H2O(g),则达到平衡后CO的转化率为 。
(3)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向逆反应方向进行的有___________(填实验编号)
实验编号
n(CO)
n(H2O) (g)
n(H2 )
n(CO2 )
A
1
5
2
3
B
2
2
1
1
C
0.5
0.5
1
1
(4)下图表示此流程的第II步反应,在t1 时刻达到平衡,在t2时刻因改变某个条件使CO 和CO2浓度发生变化的情况如下图所示。图中t2时刻发生改变的条件是_________________。(写出一种即可)
(5)某温度下,H2(g)+CO2(g) CO(g)+H2O(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度
甲
乙
丙
c (H2)/mol/L
0.010
0.020
0.020
c (CO2)/mol/L
0.010
0.010
0.020
下列判断不正确的是__________(填字母代号)。
A.都达到平衡时,乙中CO2的转化率大于甲中CO2的转化率
B.都达到平衡时,甲中和丙中H2的转化率都是60%
C.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
D.都达到平衡时,丙中c (CO2)是甲中c (CO2)的2倍,且此时丙中c (CO2)是0.012 mol/L
淮南二中2017—2018学年高二上学期期中化学试卷(理科)
参考答案
一、选择题(本题有18个小题每小题3分,共54分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
C
D
A
B
D
A
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
C
A
D
A
D
B
C
D
C
二、非选择题(共46分)
19.(共8分)
(1) ①-2983.2 (2分)
②红磷(1分) 低 (1分)
(2) 567.85(2分)
2N2H4(g)+2NO2(g)3N2(g)+4H2O(g) ΔH=-1 135.7 kJ·mol -1(2分)
20.(共13分)
(1)3X+Y2Z(2分)
(2)0.05 mol·L-1·min-1(2分)
(3)①0.9(2分) ②放热(1分)
(4) ①ACDF(全对得2分,漏选得1分,选错0分)
②C(1分) E(1分) B(1分)
③A(1分)
21. (共14分)
(1)①4(2分)
②2H++ 2e-=== H2↑或2H2O+2e-=== H2↑+ 2OH-(2分)
2Cl--2e-=== Cl2↑(2分)
4AgNO3+2H2O 4Ag+O2↑+4HNO3(2分)
③0.2(2分) 0.4(2分)
(2) ① M(1分)
②外加电流的阴极保护法(1分)
22. (共11分)
(1) K= (2分)
(2) 放(1分); 66.7%(2分)
(3) AC (全对得2分,漏选得1分,选错0分)
(4)降低温度(或减少氢气的量或减小氢气的浓度等) (2分)
(5)D(2分)