- 2021-07-05 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河北省鹿泉第一中学2019-2020学年高二9月月考试题(解析版)
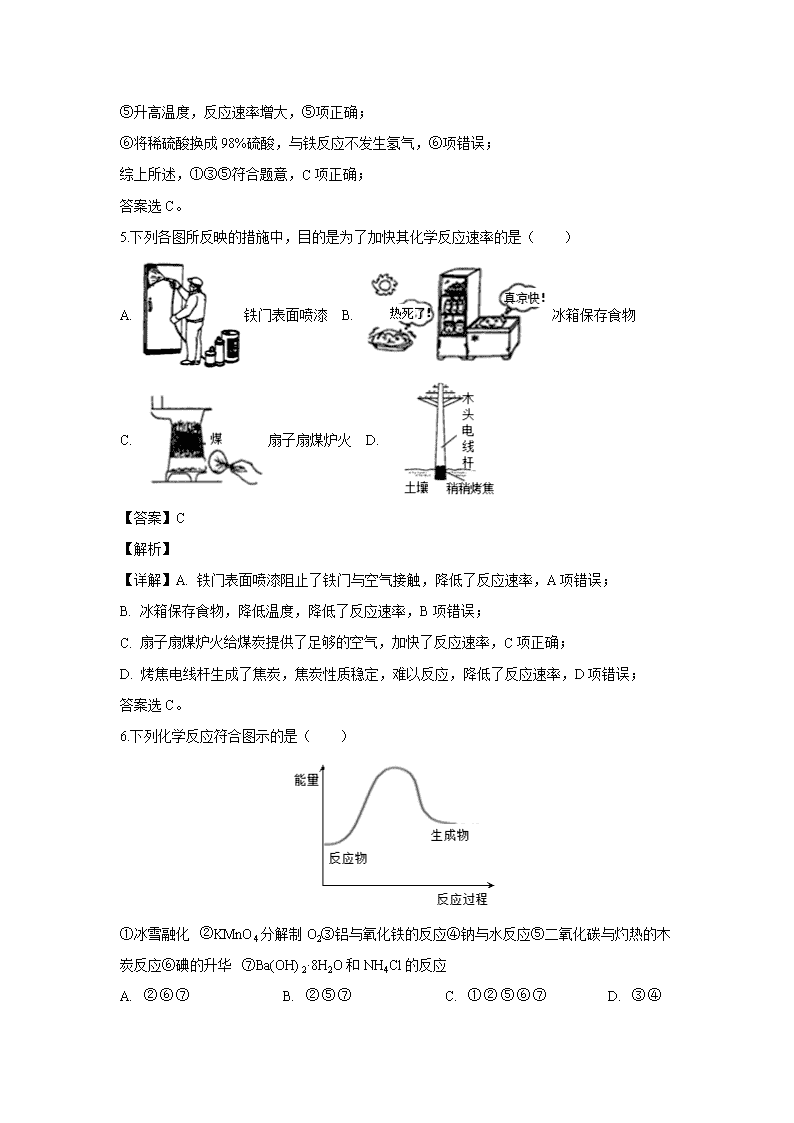
河北省鹿泉第一中学2019-2020学年高二9月月考试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl 35.5 Fe 56 第Ⅰ卷(选择题,40分) 一、选择题(每题只有一个正确答案。每题2分,共25小题,50分) 1.下列能量转化过程中,由光能转变为化学能的是( ) A. 光伏发电 B. 风力发电 C. 光合作用 D. 电解制钠 【答案】C 【解析】 【详解】A. 光伏发电是太阳能转化为电能,A不选; B. 风力发电是风能转化为电能,B不选; C. 光合作用是由光能转变为化学能,C选; D. 电解制钠是电能转化为化学能,D不选; 答案选C。 2.下列热化学方程式中,△H能正确表示物质的燃烧热的是( ) A. CO(g)+1/2O2(g)═CO2(g);△H=﹣283.0 kJ/mol B. C(s)+1/2O2(g)═CO(g);△H=﹣110.5 kJ/mol C. H2(g)+1/2O2(g)═H2O(g);△H=﹣241.8 kJ/mol D. 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol 【答案】A 【解析】 【详解】A、CO的化学计量数为1,产物为稳定氧化物,△H代表燃烧热,故A正确;B、C的化学计量数为1,但产物不是稳定氧化物,△H不代表燃烧热,故B错误;C、H2的化学计量数为1,但产物不是稳定氧化物,△H不代表燃烧热,故C错误;D、C8H18 的化学计量数不是1,产物是稳定氧化物,△H不代表燃烧热,故D错误;故选A。 3.下列说法中正确的是( ) A. 、的反应在低温时不能自发进行 B. 反应:,在高温时能自发进行 C. 增大压强,平衡向正反应方向移动,平衡常数K值增大 D. 增大反应物浓度,使活化分子百分数增加,化学反应速率增大 【答案】B 【解析】 【详解】A. △H−T△S<0的反应可自发进行,则△H<0、△S<0的反应在低温时能自发进行,A项错误; B. 对于反应CaCO3(s)=CaO(s)+CO2(g),△H>0、△S>0,则高温下△H−T△S<0,能自发进行,B项正确; C. 平衡常数K只与温度有关,与压强无关,C项错误; D. 增大反应物浓度,使活化分子数目增加,则反应速率增大,但活化分子百分数不变,D项错误; 答案选B。 4.一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量KNO3固体;③加入少量CuSO4固体;④加入少量水;⑤加热;⑥将稀硫酸换为98%的硫酸,其中可提高H2的生成速率的措施有( ) A. ①⑤ B. ①⑤⑥ C. ①③⑤ D. ①②⑤ 【答案】C 【解析】 【分析】为加快铁与硫酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,据此分析作答。 【详解】①将铁块换为等质量的铁粉,增加接触面积加快化学反应速率,①项正确; ②加入KNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,②项错误; ③加入少量CuSO4固体,铁置换出铜,形成原电池反应,可加快反应速率,③项正确; ④加入少量水,浓度减小,则反应速率减小,④项错误; ⑤升高温度,反应速率增大,⑤项正确; ⑥将稀硫酸换成98%硫酸,与铁反应不发生氢气,⑥项错误; 综上所述,①③⑤符合题意,C项正确; 答案选C。 5.下列各图所反映的措施中,目的是为了加快其化学反应速率的是( ) A. 铁门表面喷漆 B. 冰箱保存食物 C. 扇子扇煤炉火 D. 【答案】C 【解析】 【详解】A. 铁门表面喷漆阻止了铁门与空气接触,降低了反应速率,A项错误; B. 冰箱保存食物,降低温度,降低了反应速率,B项错误; C. 扇子扇煤炉火给煤炭提供了足够的空气,加快了反应速率,C项正确; D. 烤焦电线杆生成了焦炭,焦炭性质稳定,难以反应,降低了反应速率,D项错误; 答案选C。 6.下列化学反应符合图示的是( ) ①冰雪融化 ②KMnO4分解制O2③铝与氧化铁的反应④钠与水反应⑤二氧化碳与灼热的木炭反应⑥碘的升华 ⑦Ba(OH)2·8H2O和NH4Cl的反应 A. B. C. D. 【答案】B 【解析】 【分析】图象分析可知反应物能量低于生成物,说明反应是吸热反应,据此分析判断选项。 【详解】①冰雪融化属于物理变化,①项错误; ②KMnO4分解制O2是吸热反应,②项正确; ③铝与氧化铁的反应是放热反应,③项错误; ④钠与水反应是放热反应,④项错误; ⑤二氧化碳与灼热的木炭反应是吸热反应,⑤项正确; ⑥碘的升华是物理变化,⑥项错误; ⑦Ba(OH)2⋅8H2O和NH4Cl的反应是吸热反应,⑦项正确; ②⑤⑦符合题意,B项正确; 答案选B。 7.一定温度下,对于可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是( ) A. 单位时间内消耗a mol A,同时生成3a mol C B. 容器内的压强不再变化 C. D. C的体积分数不再变化 【答案】D 【解析】 【分析】化学平衡状态的判据是:①V正=V逆,②反应体系各成分浓度保持不变,③变量不再变化的状态.以此判据解题。 【详解】当V正=V逆时达到平衡状态,则 A.单位时间内消耗a mol A,同时生成3a mol C均表示正反应方向的速率V正,不能判定平衡状态,A项错误; B.反应前后气体的物质的量之和始终不变,根据PV=nRT,温度一定,容器一定,反应前后气体的物质的量一定,压强也始终为定值,则该项不能说明反应达到平衡状态,B项错误; C.对不同物质而言,正逆速率之比等于系数之比时为平衡状态,即,C项错误; D.C的体积分数会随着反应的进行而变化,当其保持不变时,则说明反应达到平衡状态,D项正确; 答案选D。 8.已达化学平衡的下列反应:2X(g)+Y(g)2Z(g)减小压强时,对反应产生的影响是( ) A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C. 正、逆反应速率都减小,平衡向逆反应方向移动 D. 正、逆反应速率都增大,平衡向正反应方向移动 【答案】C 【解析】 【详解】已知2X(g)+Y(g)⇌2Z(g),该反应正方向气体体积减小的反应,则减小压强,正、逆反应速率都减小,平衡则向气体体积增大的逆反应方向移动,C项正确; 答案选C。 9.在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( ) A. B. C. D. 【答案】A 【解析】 【详解】依据题意可知, H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ•mol-1 ①, C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1 ②, CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ•mol-1 ③, 由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(l), 其反应热为2×(-285.8kJ•mol-1)+2×(-393.5kJ•mol-1)+870.3kJ•mol-1=-488.3kJ•mol-1,A项正确; 答案选A。 10.下列措施或事实不能用勒夏特列原理解释的是( ) A. 新制的氯水在光照下颜色变浅 B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点 C. 氢气和碘蒸气反应达平衡后加压颜色加深 D. 硫酸工业上SO2氧化成SO3,通入过量的空气 【答案】C 【解析】A. 氯水中存在平衡Cl2+H2OHClO+H++Cl−,光照下HClO分解,溶液中HClO浓度降低,平衡正向移动,使氯水的颜色变浅,可用勒夏特列原理解释,故A不选;B. 缩小体积加压后,二氧化氮和四氧化二氮的浓度增大,平衡向生成四氧化二氮的方向移动,所以加压后颜色先变深后变浅,但仍比原来的颜色深,可用勒夏特列原理解释,故B不选;C. 氢气和碘蒸气反应的方程式为H2(g)+I2(g)2HI(g),增大压强I2的浓度增大,颜色加深,但反应前后气体的体积不变,增大压强平衡不移动,不能用勒夏特列原理解释,故C选;D. 工业上将SO2氧化成SO3的方程式为:2SO2(g)+O2(g)2SO3(g),增大空气的量,平衡向正反应方向移动,SO2的转化率增大,可用勒夏特列原理解释,故D不选;答案选C。 11.在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) △H =—373.20kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( ) A. 加催化剂同时升高温度 B. 加催化剂同时增大压强 C. 升高温度同时充入N2 D. 降低温度同时减小压强 【答案】B 【解析】 【详解】2NO(g)+2CO(g)N2(g)+2CO2(g) △H =—373.2.0kJ/mol,反应是气体体积减小的放热反应,则 A. 催化剂可加快反应速率,但升温平衡会向逆反应方向进行,NO的转化率降低,A项错误; B. 催化剂可加快反应速率,增大压强平衡正向进行,NO的转化率升高,B项正确; C. 升温速率增大,但平衡会向逆反应方向进行,且充入N2平衡会向逆反应方向进行,则NO的转化率降低,C项错误; D. 降低温度同时减小压强,反应速率均会降低,D项错误; 答案选B。 12.CO(g)+H2O(g)H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下,下列说法正确的是( ) A. 加入催化剂,改变了反应的途径,反应的也随之改变 B. 改变压强,平衡不发生移动,反应放出的热量不变 C. 升高温度,反应速率加快,反应放出的热量不变 D. 若在原电池中进行,反应放出的热量不变 【答案】B 【解析】 【详解】A. 催化剂改变反应的途径,降低反应的活化能,反应物与生成物的能量不变,焓变不变,A项错误; B. 增大压强,正逆反应速率均增大,该反应为气体体积不变的反应,且速率同等程度增大,反应放出的热量不变,B项正确; C. 该反应是放热反应,升高温度,平衡向逆反应方向移动,反应放出的热量减小,C项错误; D. 在原电池中进行,将化学能转换为电能,D项错误; 答案选B。 13.某温度下,在一恒容密闭容器中进行可逆反应:X(g)+Y(g)Z(g)+W(s) ΔH>0,下列叙述正确的是( ) A. 当容器中混合气体的压强不再变化时,反应达到平衡 B. 平衡后加入少量W,逆反应速率增大 C. 平衡后升高温度,平衡逆向移动 D. 平衡后加入X,ΔH增大 【答案】A 【解析】A.该反应为气体体积增大的反应,则当容器中混合气体的压强不再变化时,反应达到平衡,故A正确;B.W为固体,则平衡后加入少量W,反应速率不变,平衡不移动,故B错误;C.该反应为吸热反应,升高温度,平衡正向移动,故C错误;D.焓变与平衡移动、X的物质的量无关,与反应方程式有关,故D错误;故选A。 14.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看成该化学键的键能。已知热化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol,请根据热化学方程式和表中数据计算N≡N键的键能x约为( ) 化学键 H-H N≡N H-N 键能 436 kJ/mol x 391kJ/mol A. 431kJ/mol B. 946kJ/mol C. 649kJ/mol D. 869kJ/mol 【答案】B 【解析】试题分析:已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x, 对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,反应热=反应物的总键能-生成物的总键能,故△H=xkJ/mol+3×436kJ/mol-2×3×391=-92.4kJ/mol,解得:x≈945.6kJ/mol,故选B. 15.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1 已知:碳的燃烧热△H1=a kJ•mol-1 S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1 2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1 则x为( ) A. 3a+b-c B. c-3a-b C. a+b-c D. c-a-b 【答案】A 【解析】已知硫的燃烧热为ΔH1=" a" kJ·mol-1,则硫的燃烧热化学方程式为,①S(s)+O2(g)=SO2(g) ΔH1=" a" kJ·mol-1,②S(s)+2K(s)==K2S(s) ΔH2=" b" kJ·mol-1,③2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3=" c" kJ·mol-1,根据盖斯定律,可得ΔH =3ΔH1+ΔH2—ΔH3,即x=3a+b-c,答案选A。 16.下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( ) A. 石墨转变成金刚石是吸热反应 B. 白磷比红磷稳定 C. CO(g)+H2O (g)=CO2 (g)+H2(g)>0 D. S(g)+O2(g)=SO2 1 S(g)+O2(g)=SO2 2,则 【答案】A 【解析】A、石墨能量低于金刚石,因此石墨转变为金刚石是吸热反应,选项A正确;B、白磷能量高于红磷,所以白磷比红磷不稳定,选项B错误;C、该反应由高能量变成低能量,反应放热,所以ΔH < 0,选项C错误;D、气态的硫与氧气反应放出热量比固态的硫与氧气的反应多,ΔH值为负值,因此ΔH2 >ΔH1,选项D错误。答案选A。 17.(2016•北京)K2Cr2O7溶液中存在平衡:Cr2O72—(橙色)+H2O⇌2CrO42—(黄色)+2H+ ,用K2Cr2O7溶液进行下列实验: 结合实验,下列说法不正确的是( ) A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72—被C2H5OH还原 C. 对比②和④可知K2Cr2O7酸性溶液氧化性强 D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 【答案】D 【解析】A.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故A正确;B.②中重铬酸钾氧化乙醇,重铬酸钾被还原,故B错误;C.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故C正确;D.若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故D正确;故选B。 18.在密闭容器中,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g)。在500℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( ) A. B. C. D. 【答案】C 【解析】 【详解】依据化学平衡,设一氧化碳的消耗浓度为x mol/L,分析三段式列式计算: CO(g)+H2O(g)H2(g)+CO2(g) 起始浓度(mol/L) 0.02 0.02 0 0 转化浓度(mol/L) x x x x 平衡浓度(mol/L)0.02-x 0.02-x x x 则平衡常数K==9 解得x=0.015 则CO的转化率=×100%=75%,C项正确;答案选C。 19.室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( ) A. △H2>△H3 B. △H1<△H3 C. △H1+△H3=△H2 D. △H1+△H2>△H3 【答案】B 【解析】试题分析:根据题意知,CuSO4·5H2O(s)溶于水的热化学方程式为CuSO4·5H2O(s)Cu2+(aq)+SO42—(aq)+5H2O(l),△H1>0;CuSO4(s)溶于水的热化学方程式为CuSO4(s)Cu2+(aq)+SO42—(aq),△H2<0;根据盖斯定律知,CuSO4·5H2O受热分解的热化学方程式为:CuSO4·5H2O(s)CuSO4(s)+5H2O(l), △H3=△H1—△H2>0A、根据上述分析知,△H2<△H3,错误;B、根据上述分析知,△H1<△H3,正确;C、根据上述分析知,△H3=△H1—△H2,错误;D、根据上述分析知,△H1+△H2<△H3,错误。 20.在一体积可变的密闭容器中,加入一定量的X,Y,Z,发生反应mX(g)+nY(g) ⇌pZ(g) ΔH=QkJ·mol-1。反应达到平衡后,Y的物质的量浓度与温度、容器体积的关系如下表所示。下列说法不正确的是 ( ) A. B. 体积不变,温度升高,平衡向逆反应方向移动 C. Q<0 D. 温度不变,压强增大,Y的质量分数增大 【答案】D 【解析】 【分析】根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数大于2,所以可确定增大体积,平衡逆向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动;当体积相同时,温度升高,Y的浓度增大,即平衡逆向移动,所以此反应的正向为放热反应,以此解答该题。 【详解】根据上述分析可知, A. 在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数大于2,所以可确定增大体积,平衡向逆反应方向移动,则,A项正确; B. 根据上述分析可知,反应的正向为放热反应,体积不变,温度升高,平衡向逆反应方向移动,B项正确; C. 根据上述分析可知,反应的正向为放热反应,Q<0,C项正确; D. 温度不变,压强增大,即缩小体积,平衡向正反应方向移动,则Y的质量分数减小,D项错误; 答案选D。 21.一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( ) A. 反应的化学方程式为 B. 时,Y的浓度是X浓度的倍 C. 根据时的数据,可求出该温度下的平衡常数 D. 时,逆反应速率大于正反应速率 【答案】B 【解析】 【详解】A. t1时,Y的物质的量为6mol,减少了10mol-6mol=4mol,X的物质的量为4mol,增加了4mol-2mol=2mol,反应根据变化量之比是化学计量数之比可知反应的化学方程式为2YX,A错误; B. t1时,Y的物质的量为6mol,X的物质的量为4mol,物质的量之比等于浓度之比,则Y的浓度是X浓度的1.5倍,B正确; C. 由图可知t2时,反应没有达到平衡,根据t2时的数据,不能求出该温度下的平衡常数,C错误; D. 由图可知t3时,反应达到平衡,正逆反应速率相等,D错误; 答案选B。 22.在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( ) A. CO合成甲醇的反应为吸热反应 B. 平衡常数 C. 该反应在时的平衡常数比时的小 D. 处于A点的反应体系从变到,达到平衡时增大 【答案】D 【解析】 【详解】A. 由图可知,T2温度下到达平衡所需时间较短,反应速率较快,温度T2>T1,则温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,所以合成甲醇的反应为放热反应,A项错误; B. CO(g)+2H2(g)⇌CH3OH(g)的平衡常数表达式,B项错误; C. 由图可知,T2温度下到达平衡所需时间较短,反应速率较快,故温度T2>T1,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,化学平衡常数降低,在T1时的平衡常数比T2时的大,C项错误; D. 由图可知,处于A点的反应体系从T1变到T2,温度升高,平衡向逆反应方向移动,氢气物质的量增大,甲醇的物质的量减小,增大,D项正确; 答案选D。 23.2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)⇌PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( ) A. 0.4mol B. 0.2mol C. 小于0.2mol D. 大于0.2mol,小于0.4mol 【答案】C 【解析】 【详解】达平衡后移走1mol PCl3 和0.5mol C12 ,重新到达的平衡,可以等效为开始加入1molmol PC13和0.5mol C12到达的平衡,与原平衡相比压强减小,该反应为气体体积缩小的反应,则平衡向逆反应移动,反应物的转化率减小,达新平衡时PC15的物质的量小于原平衡的,即在相同温度下再达平衡时PCl5的物质的量<0.4mol×=0.2mol,故答案为C。 24.对于反应N2O42NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示。下列说法正确的是( ) A. A、C两点的正反应速率的关系 B. A、B、C、D、E各状态,是状态E C. 维持不变,所需时间为x,维持不变,所需时间为y,则 D. 使E状态从水平方向到达C状态,从理论上来讲,可选用条件是从突然加压至 【答案】D 【解析】 【详解】A. 增大压强,反应速率增大,C点压强大于A点压强,所以v(A)查看更多