- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届贵州省遵义市湄潭县湄江中学高二上学期期中化学试卷 (解析版)
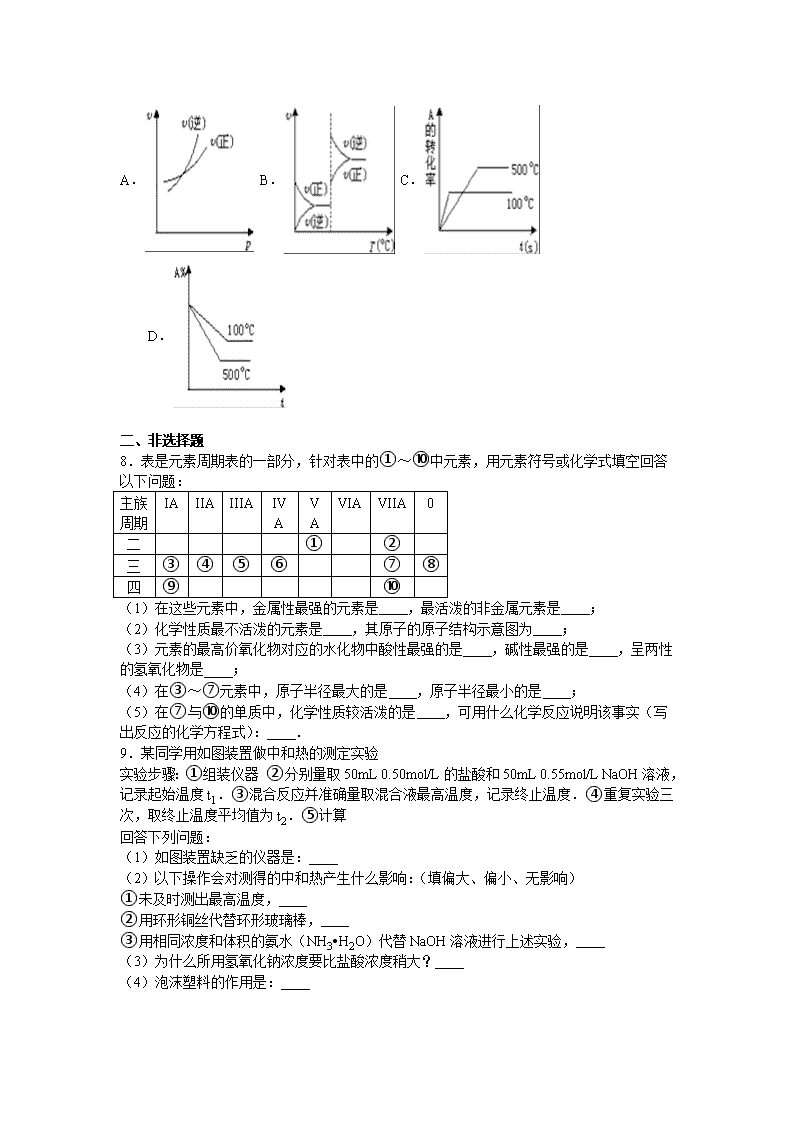
2016-2017学年贵州省遵义市湄潭县湄江中学高二(上)期中化学试卷 一、选择题(每题只有一个正确答案,每小题6分,共42分) 1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( ) ①天然气 ②煤 ③火力发电 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能. A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 2.已知H﹣H键键能(断裂时吸收或生成时释放的能量)为436kJ•mol﹣1,H﹣N键键能为391kJ•mol﹣1,根据化学方程式:N2(g)+3H2(g)=2NH3(g);△H=﹣92kJ•mol﹣1.计算N≡N键的键能是( ) A.431kJ•mol﹣1 B.649kJ•mol﹣1 C.896kJ•mol﹣1 D.946kJ•mol﹣1 3.无论化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的. 已知:H2O(g)═H2O(l)△H1=﹣Q1 kJ•mol﹣1① C2H5OH(g)═C2H5OH(l)△H2=﹣Q2 kJ•mol﹣1② C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=﹣Q3 kJ•mol﹣1③ 若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( ) A.(Q1+Q2+Q3) kJ B.[0.5(Q1+Q2+Q3)]kJ C.(0.5Q1﹣1.5Q2+0.5Q3) kJ D.(1.5Q1﹣0.5Q2+0.5Q3) kJ 4.反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( ) A.υ(D)=0.4 mol/(L•s) B.υ(C)=0.5 mol/(L•s) C.υ(B)=0.6 mol/(L•s) D.υ(A)=0.15 mol/(L•s) 5.在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2⇌2SO3,下列叙述能够说明反应已经达到平衡状态的是( ) A.容器中SO2、O2、SO3共存 B.SO2与SO3的浓度相等 C.容器中SO2、O2、SO3的物质的量之比为2:1:2 D.反应容器中压强不随时间变化 6.下列事实不能用勒夏特列原理解释的是( ) A.对于2HI(g)⇌H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 B.溴水中有下列平衡Br2+H2O⇌HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 C.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 D.反应CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 7.对于可逆反应A(g)+2B(g)⇌4C(g)(正反应吸热),下列图象中正确的是( ) A. B. C. D. 二、非选择题 8.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题: 主族 周期 IA IIA IIIA IVA VA VIA VIIA 0 二 ① ② 三 ③ ④ ⑤ ⑥ ⑦ ⑧ 四 ⑨ ⑩ (1)在这些元素中,金属性最强的元素是 ,最活泼的非金属元素是 ; (2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为 ; (3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ; (4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ; (5)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): . 9.某同学用如图装置做中和热的测定实验 实验步骤:①组装仪器 ②分别量取50mL 0.50mol/L的盐酸和50mL 0.55mol/L NaOH溶液,记录起始温度t1.③混合反应并准确量取混合液最高温度,记录终止温度.④重复实验三次,取终止温度平均值为t2.⑤计算 回答下列问题: (1)如图装置缺乏的仪器是: (2)以下操作会对测得的中和热产生什么影响:(填偏大、偏小、无影响) ①未及时测出最高温度, ②用环形铜丝代替环形玻璃棒, ③用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验, (3)为什么所用氢氧化钠浓度要比盐酸浓度稍大? (4)泡沫塑料的作用是: (5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”) 10.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量. (1)写出该反应的热化学方程式 . (2)已知H2O(l)═H2O(g);△H=+44kJ•mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ. (3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 . (4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ•mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 . 11.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深. 回答下列问题: (1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为 mol•L﹣1•s﹣1,100℃时反应的平衡常数为 . (2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡. ①T 100℃(填“大于”“小于”),判断理由是 . ②计算温度T时反应的平衡常数K (3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 . (4)在恒温恒压条件下,向体系中通入氖气,该反应的速率将 (变快、不变、变慢),平衡将 (填正反应、逆反应、不移动)方向移动. 2016-2017学年贵州省遵义市湄潭县湄江中学高二(上)期中化学试卷 参考答案与试题解析 一、选择题(每题只有一个正确答案,每小题6分,共42分) 1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( ) ①天然气 ②煤 ③火力发电 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能. A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 【考点】反应热和焓变. 【分析】煤、石油、天然气是化石燃料,太阳能、核能、地热能、潮汐能、风能、氢能、生物质能等都是新能源. 【解答】解:煤、石油、天然气是化石能源,不是新能源,常见新能源有:太阳能、核能、地热能、潮汐能、风能、氢能、生物质能等,故B正确. 故选B. 2.已知H﹣H键键能(断裂时吸收或生成时释放的能量)为436kJ•mol﹣1,H﹣N键键能为391kJ•mol﹣1,根据化学方程式:N2(g)+3H2(g)=2NH3(g);△H=﹣92kJ•mol﹣1.计算N≡N键的键能是( ) A.431kJ•mol﹣1 B.649kJ•mol﹣1 C.896kJ•mol﹣1 D.946kJ•mol﹣1 【考点】反应热和焓变. 【分析】根据反应热△H=反应物的总键能﹣生成物的总键能,然后结合化学反应方程式中各种物质的化学式以及化学计量数进行计算. 【解答】解:已知:H﹣H键能为436kJ•mol﹣1,N﹣H键键能为391kJ•mol﹣1,令N≡N的键能为x, 对于反应N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ•mol﹣1. 反应热△H=反应物的总键能﹣生成物的总键能,故x+3×436kJ•mol﹣1﹣2×3×391kJ•mol﹣1=﹣92.4kJ•mol﹣1 解得:x=946kJ•mol﹣1, 故选D. 3.无论化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的. 已知:H2O(g)═H2O(l)△H1=﹣Q1 kJ•mol﹣1① C2H5OH(g)═C2H5OH(l)△H2=﹣Q2 kJ•mol﹣1② C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=﹣Q3 kJ•mol﹣1③ 若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( ) A.(Q1+Q2+Q3) kJ B.[0.5(Q1+Q2+Q3)]kJ C.(0.5Q1﹣1.5Q2+0.5Q3) kJ D.(1.5Q1﹣0.5Q2+0.5Q3) kJ 【考点】用盖斯定律进行有关反应热的计算. 【分析】无论化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的.依据盖斯定律结合热化学方程式计算得到所求热化学方程式得到焓变. 【解答】解:H2O(g)═H2O(l)△H1=﹣Q1 kJ•mol﹣1① C2H5OH(g)═C2H5OH(l)△H2=﹣Q2 kJ•mol﹣1② C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=﹣Q3 kJ•mol﹣1③ 若使23g酒精液体完全燃烧,最后恢复到室温生成的水是液体,依据盖斯定律计算③﹣②+①×3得到: C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣(Q3﹣Q2+3Q1)KJ/mol; 23g酒精物质的量为0.5mol,液体完全燃烧,最后恢复到室温生成的水是液体,放热(1.5Q1﹣0.5Q2+0.5Q3) kJ, 故选D. 4.反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( ) A.υ(D)=0.4 mol/(L•s) B.υ(C)=0.5 mol/(L•s) C.υ(B)=0.6 mol/(L•s) D.υ(A)=0.15 mol/(L•s) 【考点】化学反应速率和化学计量数的关系. 【分析】反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快. 【解答】解:反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快 A、υ(D)/2=0.2 mol/(L•s) B、v(C)/2=0.25mol/(L•s), C、v(B)/3=0.2mol/(L•s), D、v(A)/1=0.15mol/(L•s), 所以反应速率v(C)>v(B)v(D)>v(A). 故选:B. 5.在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2⇌2SO3,下列叙述能够说明反应已经达到平衡状态的是( ) A.容器中SO2、O2、SO3共存 B.SO2与SO3的浓度相等 C.容器中SO2、O2、SO3的物质的量之比为2:1:2 D.反应容器中压强不随时间变化 【考点】化学平衡状态的判断. 【分析】当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断, A、无论是否达到平衡状态都存在三种物质共存; B、各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据; C、各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据; D、SO2与SO3的浓度不再变化,说明正逆反应速率相等. 【解答】解:反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变, A.该反应为可逆反应,无论是否达到平衡状态都存在三种物质共存的特点,故A错误; B.平衡时各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B错误; C.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故C错误; D.SO2与SO3的浓度不再变化,说明正逆反应速率相等,反应达到平衡状态,故D正确. 故选D. 6.下列事实不能用勒夏特列原理解释的是( ) A.对于2HI(g)⇌H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 B.溴水中有下列平衡Br2+H2O⇌HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 C.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 D.反应CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 【考点】化学平衡移动原理. 【分析】勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释. 【解答】解:A、由H2、I2(g)、HI组成的平衡体系,存在H2+I2⇌2HI,缩小体积,压强增大,平衡不移动,不能用勒夏特列原理解释,故A正确; B、加入硝酸银溶液后,会和HBr之间反应,所以平衡正向移动,溶液颜色变浅,能用勒夏特列原理解释,故B错误; C、合成氨反应是放热的反应,增大压强,会促使平衡正向移动,可以提高氨的产率,能用勒夏特列原理解释,故C错误. D、反应 CO+NO2⇌CO2+NO (△H<0),达平衡后,提高温度会使得平衡逆向移动,二氧化氮浓度增大,颜色加深,能用勒夏特列原理解释,故D错误; 故选A. 7.对于可逆反应A(g)+2B(g)⇌4C(g)(正反应吸热),下列图象中正确的是( ) A. B. C. D. 【考点】化学反应速率与化学平衡图象的综合应用;体积百分含量随温度、压强变化曲线;转化率随温度、压强的变化曲线. 【分析】可逆反应A(g)+2B(g)⇌4C(g)(正反应吸热),则升高温度,正逆反应速率均增大,化学平衡正向移动;增大压强,化学平衡逆向移动,结合图象来解答. 【解答】解:A.增大压强,化学平衡逆向移动,重新达到平衡前逆反应速率大于正反应速率,与图象相符,故A正确; B.该反应为吸热反应,升高温度化学平衡应正向移动,正反应速率大于逆反应速率,故B错误; C.温度高,反应速率大,先到达平衡,即500℃时先达到平衡状态,与图象不符,故C错误; D.由图象可知,温度高的先达到平衡,且温度高时向正反应进行的程度大,则A的含量低,故D正确; 故选AD. 二、非选择题 8.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题: 主族 周期 IA IIA IIIA IVA VA VIA VIIA 0 二 ① ② 三 ③ ④ ⑤ ⑥ ⑦ ⑧ 四 ⑨ ⑩ (1)在这些元素中,金属性最强的元素是 K ,最活泼的非金属元素是 F ; (2)化学性质最不活泼的元素是 Ar ,其原子的原子结构示意图为 ; (3)元素的最高价氧化物对应的水化物中酸性最强的是 HClO4 ,碱性最强的是 KOH ,呈两性的氢氧化物是 Al(OH)3 ; (4)在③~⑦元素中,原子半径最大的是 Na ,原子半径最小的是 Cl ; (5)在⑦与⑩的单质中,化学性质较活泼的是 Cl2 ,可用什么化学反应说明该事实(写出反应的化学方程式): 2NaBr+Cl2=Br2+2NaCl . 【考点】位置结构性质的相互关系应用. 【分析】由元素在周期表的位置可知,①~⑩分别为N、F、Na、Mg、Al、Si、Cl、Ar、K、Br, (1)同主族从上到下金属性增强,同周期从左向右金属性减弱;同主族从上到下非金属性减弱,同周期从左向右非金属性增强; (2)稀有气体的性质不活泼; (3)元素的最高价氧化物对应的水化物中,高氯酸的酸性最强,KOH的碱性最强,氢氧化铝具有两性; (4)电子层越多,原子半径越大,同周期从左向右原子半径减小; (5)同主族从上到下对应单质的活泼性减弱,可利用单质之间的置换反应说明. 【解答】解:由元素在周期表的位置可知,①~⑩分别为N、F、Na、Mg、Al、Si、Cl、Ar、K、Br, (1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F,故答案为:K;F; (2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为,故答案为:Ar;; (3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3, 故答案为:HClO4;KOH;Al(OH)3; (4)同周期从左向右原子半径减小,则在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl,故答案为:Na;Cl; (5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用2NaBr+Cl2=Br2+2NaCl说明该事实,故答案为:Cl2;2NaBr+Cl2=Br2+2NaCl. 9.某同学用如图装置做中和热的测定实验 实验步骤:①组装仪器 ②分别量取50mL 0.50mol/L的盐酸和50mL 0.55mol/L NaOH溶液,记录起始温度t1.③混合反应并准确量取混合液最高温度,记录终止温度.④重复实验三次,取终止温度平均值为t2.⑤计算 回答下列问题: (1)如图装置缺乏的仪器是: 温度计 (2)以下操作会对测得的中和热产生什么影响:(填偏大、偏小、无影响) ①未及时测出最高温度, 偏小 ②用环形铜丝代替环形玻璃棒, 偏小 ③用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验, 偏小 (3)为什么所用氢氧化钠浓度要比盐酸浓度稍大? 使盐酸充分反应 (4)泡沫塑料的作用是: 防止反应放出的热量散失 (5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 不相等 (填“相等、不相等”),所求中和热 相等 (填“相等、不相等”) 【考点】中和热的测定. 【分析】(1)根据量热计的构造来判断该装置的缺少仪器; (2)①未及时测出最高温度,测得温度差偏小; ②实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒,散失热量,测得温度差偏小; ③氨水电离需要吸热; (3)根据氢氧化钠足量确保盐酸完全反应,放出的热量更完全; (4)为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用泡沫塑料填满; (5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答. 【解答】解:(1)根据量热计的构造可知该装置的缺少仪器是温度计; 故答案为:温度计; (2)①未及时测出最高温度,测得温度差偏小,由Q=cm△T可知热量偏小,中和热的数值偏小, 故答案为:偏小; ②实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒,散失热量,测得温度差偏小,由Q=cm△T可知热量偏小,中和热的数值偏小, 故答案为:偏小; ③用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液,氨水电离需要吸热,所以测得温度差偏小,由Q=cm△T可知热量偏小,中和热的数值偏小,故答案为:偏小; (3)根据氢氧化钠足量确保盐酸完全反应,放出的热量更完全,使测得的数值更准确; 故答案为:使盐酸充分反应; (4)为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用泡沫塑料填满,所以泡沫塑料的作用防止反应放出的热量散失;故答案为:防止反应放出的热量散失; (5)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等, 故答案:不相等;相等. 10.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量. (1)写出该反应的热化学方程式 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.625kJ/mol . (2)已知H2O(l)═H2O(g);△H=+44kJ•mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 408.8 kJ. (3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 生成N2和H2O,对环境无污染 . (4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ•mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=﹣1135.7kJ•mol﹣1 . 【考点】热化学方程式;反应热和焓变. 【分析】(1)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变; (2)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变; (3)肼燃烧生成氮气和水; (4)根据盖斯定律计算焓变,并书写热化学方程式. 【解答】解:(1)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.625kJ/mol; 故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.625kJ/mol; (2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.625kJ/mol, ②H2O(l)═H2O(g)△H=+44kJ/mol; 依据盖斯定律,①﹣②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣817.625kJ/mol 则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408.8KJ; 故答案为:408.8KJ; (3)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染; 故答案为:生成N2和H2O,对环境无污染; (4)①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ•mol﹣1; ②N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=﹣534KJ•mol﹣1 将方程式2②﹣①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(﹣534KJ•mol﹣1)﹣(+67.7KJ•mol﹣1)=﹣1135.7kJ•mol﹣1, 故答案为:2N2H4(g)+2 NO2 (g)═3N2(g)+4 H2O(g)△H=﹣1135.7kJ•mol﹣1. 11.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深. 回答下列问题: (1)反应的△H 大于 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为 0.001 mol•L﹣1•s﹣1,100℃时反应的平衡常数为 0.36mol/L . (2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡. ①T 大于 100℃(填“大于”“小于”),判断理由是 正反应方向吸热,反应向吸热方向移动,故温度升高 . ②计算温度T时反应的平衡常数K 1.28mol/L (3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 逆反应 (填“正反应”或“逆反应”)方向移动,判断理由是 对气体体积增大的反应,增大压强平衡向逆反应方向移动 . (4)在恒温恒压条件下,向体系中通入氖气,该反应的速率将 变慢 (变快、不变、变慢),平衡将 正反应 (填正反应、逆反应、不移动)方向移动. 【考点】物质的量或浓度随时间的变化曲线;化学平衡的影响因素. 【分析】(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=计算得到;化学平衡常数利用化学平衡常数表达式计算; (2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃; ②计算T℃时两种物质的浓度,计算得到化学平衡常数; (3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向; (4)在恒温恒压条件下,向体系中通入氖气,体积增大,压强减小,平衡想请他体积增大的方向进行; 【解答】解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L﹣0.04mol/L=0.06mol/L,v(N2O4)==0.001mol•L﹣1•s﹣1;K===0.36mol/L, 故答案为:大于、0.001mol•L﹣1•s﹣1、0.36mol/L; (2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于、正反应方向吸热,反应向吸热方向移动,故温度升高; ②平衡时,c(NO2)=0.120mol•L﹣1+0.002mol•L﹣1•s﹣1×10s×2=0.16mol•L﹣1,c(N2O4)=0.04mol•L﹣1﹣0.002mol•L﹣1•s﹣1×10s=0.020mol•L﹣1,K2==1.28mol/L, 故答案为:1.28mol/L; (3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动, 故答案为:逆反应、对气体体积增大的反应,增大压强平衡向逆反应方向移动; (4)在恒温恒压条件下,向体系中通入氖气,体积增大,压强减小,该反应的速率将减小,平衡向气体体积增大的分析进行,平衡正向进行,故答案为:变慢;正反应; 查看更多