- 2021-07-05 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届四川省成都石室中学高二上学期期中考试(2016
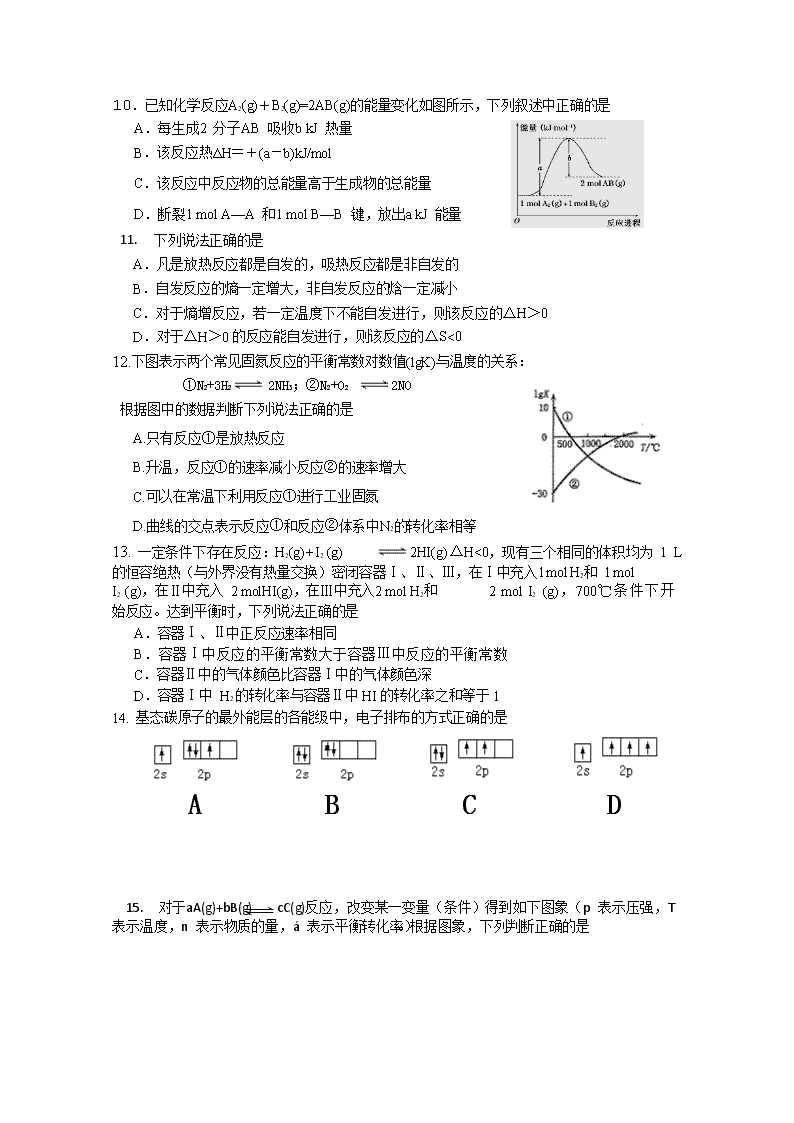
成都石室中学高2018届2016~2017学年度上期半期考试 化 学 考试范围为选修四第一章至第三章以及选修三第一章第一节,考试时间100min。 可能用到的相对原子质量: H-1 C-12 O-16 第 I 卷 一、选择题(单选 每题选对得2 分 满分30 分) 1. 对N2+3H2 2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正 反应速率的是 A.加热 B.增大体积 C.加负催化剂 D.补充He 2. 以 下 能级 符 号 不 正 确的 是 ( ) A.3s B.3p C.3d D.3f -1 -1 3.已知X2(g)+Y2 (g) 2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L 0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是 A.Z 为0.4mol·L-1 B.X 为0.2 mol·L-1 、0.3mol·L 、 C.Y 为0.4 mol·L-1 D.Z为0.3 mol·L-1 4. 某温度下,在一恒容容器中进行如下反应N2+3H2 2NH3,下列情况一定能说明反应 已达到平衡的是 ①容器内压强不随时间而变化 ②单位时间内,有3molH2反应,同时有2molNH3生成 ③气体的密度不随时间而变化 ④单位时间内,有1molN2生成,同时有2molNH3生成⑤用N2、 H2、 NH3表示的该反应的化学反应速率之比为1∶3∶2⑥气体的平均摩尔质量不随时间而变化 A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥ 5. 常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到pH=7 的溶液,混合时硫 酸 与NaOH 溶液的体积比为 A.1: 200 B. 200 : 1 C. 100 : 1 D.1:100 + - 6. 稀氨水中存在着下列平衡:NH3•H20 NH4 +0H,若要使平衡向逆反应方向移动,同时 使c(OH-)增大,应加入适量的物质是(忽略溶解热) ①NH4C1固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgS04固体 A.仅①②③⑤ B. 仅③⑥ C. 仅③ D. 仅③⑤ 7. 用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V 3 mL, 若 V 3 >V 1 >V 2,则所使用仪器可能是 A.容量瓶 B.量筒 C.碱式滴定管 D.以上仪器均可 8. 关于中和热的测定实验,下列说法正确的是 A.为了使反应进行的更完全,可以使酸或碱适当过量 B.为了使反应充分,可以向酸(碱)中分次加入碱(酸) C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关 D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大 9.常温下,向浓度为0.1 mol/L、体积为V L的氨水中逐滴加入0.1 mol/L的盐酸,下列 各选项 中数值变大的有 10. 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是 A.每生成2 分子AB 吸收b kJ 热量 B.该反应热ΔH=+(a-b)kJ/mol C.该反应中反应物的总能量高于生成物的总能量 D.断裂1 mol A—A 和1 mol B—B 键,放出a kJ 能量 11. 下列说法正确的是 A.凡是放热反应都是自发的,吸热反应都是非自发的 B.自发反应的熵一定增大,非自发反应的焓一定减小 C.对于熵增反应,若一定温度下不能自发进行,则该反应的△H>0 D.对于△H>0 的反应能自发进行,则该反应的△S<0 12.下图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系: ①N2+3H2 2NH3;②N2+O2 2NO 根据图中的数据判断下列说法正确的是 A.只有反应①是放热反应 B.升温,反应①的速率减小反应②的速率增大 C.可以在常温下利用反应①进行工业固氮 D.曲线的交点表示反应①和反应②体系中N2的转化率相等 13. 一定条件下存在反应:H2(g)+I2 (g) 2HI(g) ΔH<0,现有三个相同的体积均为 1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和 1mol I2 (g),在Ⅱ中充入 2 molHI(g),在Ⅲ中充入2 mol H2和 2 mol I2 (g),700℃条件下开 始反应。达到平衡时,下列说法正确的是 A.容器Ⅰ、Ⅱ中正反应速率相同 B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数 C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深 D.容器Ⅰ中 H2 的转化率与容器Ⅱ中 HI 的转化率之和等于 1 14. 基态碳原子的最外能层的各能级中,电子排布的方式正确的是 A B C D 15. 对于aA(g)+bB(g) cC(g)反应,改变某一变量(条件)得到如下图象(p 表示压强,T 表 示温度,n 表示物质的量,á 表示平衡转化率)。根据图象,下列判断正确的是 A.反应I:若p1>p2,则a+b<c B. 反应Ⅱ:此反应的ΔH<0,且T1<T2 C.反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响 D.反应Ⅳ:表示t1 时刻增大B 的浓度对反应速率的影响 二、选择题(混选 每题 1-2 个正确选项,选 全对得2 分 部分正确得1 分,满分10 分) 16.pH=2.1 的两种酸溶液A、B 各1 mL,分别加水稀释到100 mL,其pH 与溶液体积的关系如图,下列说法不正确的是 A.若a<4.1,则A、B都是弱酸 B.稀释后,A酸溶液的酸性比B酸溶液强 C.若 a=4.1,则A是强酸,B是弱酸 D.A、B两种 酸溶液的物质的量浓度一定相等 17.下列条件下,对应离子一定能大量共存的是 + + 2- - A.在0.1 mol/LNa2CO3 溶液中:Al3 、NH4 、SO4 、NO3 C.使甲基橙变红的溶液中:NH +、Cl 一、SO 2_、Mg2+ - 2- D.25℃时,水电离出的c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3 、S 18.25℃时,在10 mL 浓度为0.1 mol/L 的NH3·H2O 溶液中滴加0.1 mol/L 盐酸,下列有关 描述正确的是 A.加入5 mL 盐酸时: c(NH+) > c(Cl-) >c(OH-)>c(H+) B.加入10 mL 盐酸时:c(NH+)+c(H+)=c(OH-) +c(Cl-) C.在 溶液pH=7 时:水的电离程度最大 D.加入20 mL 盐酸时:c(Cl-)=2c(NH+) 19. 下列有关问题,与盐的水解无关的是 A.NH4Cl 与ZnCl2 溶液可作焊接金属中的除锈剂 B.用NaHSO4 去除暖手瓶中的水垢 C.实验室盛放Na2CO3 溶液的试剂瓶不能用磨口玻璃塞 D.加热蒸干AlCl3 溶液得到Al(OH)3 固体 20. 根据下列实验事实,不能得到相应结论的是 选项 实验操作和现象 结论 向2mol/ L 的醋酸溶液中加入镁条,产生气 泡的速率先加快再减慢 反应刚开始时,醋酸电离平衡 正移,c(H+)增大A 常温下分别测等浓度的醋酸和氨水pH ,发 现二者的pH 之和为14 向均盛有2mL5% H2O2 溶液的两支试管中 分别滴入0.2mol/LFe3+,和0.3mol/LCu2+ 溶 lmL ,前者生成气泡的速率更快 向硼酸 (H3BO3 )溶液中滴加少量Na2CO3 溶液,观察到无明显现象. 常温下,醋酸和氨水的电离平 衡常数相等B 催化效果:Fe3+>Cu2+C — Ka(H3BO3) < Ka( HCO3 ) D 2 3 2 2 2 2 第II卷 三、填空题 21. (6分)含碳的化合物之间很容易发生转化。请回答下列问题: (1)有机物M在有光的时候很容易转化成N,其过程如下: M到N过程中,光能转化为 能;其中较稳定的物质是 (用M、N回答)。 (2)已知 (l)的燃烧热为3267.5kJ·mol-1, (l)+6O(g) ═6CO(g)+3H(g)2 2 2 △H=a kJ·mol-1,则a -3267.5(填“>”、“<”或“=”)。 (3)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成1mol 纯化 合 物时的反应热称为该化合物的标准摩尔生成焓(△H¢)。已知100kPa,一定温度下: Fe O (s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ·mol-1 CO(g)+1/2O (g)=CO (g) △H=-280.0kJ·mol-1 C(石墨)+O (g)=CO (g) △H=-390.5kJ·mol-1 ¢ 则Fe2O3的标准摩尔生成焓△H = 。 22.(14分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表: 回答下列问题: (1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释10倍,则 稀释后的溶液中c(H+) 原来的十分之一(填“大于”、“小于”或“等于”). (2)物质的量浓度均为0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。 a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN (3)25℃时,将20mL0.1mol·L-1CH COOH 溶液和20mL0.1mol·L-1HSCN 溶液分别与20mL 0.1mol·L -1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初 始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反 应 结 - - 束后,假设NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO “>”、“<”或“=”;) ) _c(SC N )(填 化学式 电离平衡常数 HSCN -1 1.3×10 CH3COOH -5 1.8×10 H2CO3 HClO 3.0×10-8K =4.3×10 -7 K =5.6×10- 11 a1 a2 (4)25℃时,CH3COONa 与CH3COOH 的混合溶液,若测得pH=8,则溶液中 c(Na+)-c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。 (5)向NaClO 溶液中通入少量的CO2,发生反应的离子方程式为 。 23. (18 分)化学学习小组进行如下实验。 【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽 (1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究 浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。 【测定H2C2O4·xH2O 中x 值】 已知:M(H2C2O4)=90g/mol ①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。 ②取25.00 mL待测液放入锥形瓶中,再加入适的稀H2SO4 ③用浓度为0.05000 mol·L-1的KMnO 标准溶液进行滴定; (2)请写出与滴定有关反应的离子方程式 (3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填a、b)。 (4)由右图可知消耗KMnO4溶液体积为 (5)滴定过程中眼睛应注视 mL; ; (6)通过上述数据,求得x= 。以标准KMnO4溶液滴定样品溶液的浓 度,未用 标准KMnO4溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。 2- 2- 24. (10分) 工业废水中常含有一定量的Cr2O7 伤害,工业上对废水处理的工艺流程如下: 和CrO4 ,它们会对生态系统产生很大的 2- (1)CrO4 中Cr 的化合价 (1 分); Cr3+的核外电子排布式为 。 (2)写出第①步发生的离子反应方程式 ;若常温下,减 小平衡体系的pH 至pH=2,则溶液趋向于显 色(1 分)。 物理量 V(0.20 mol/L H2C2O4溶液)/mL V(蒸馏 水)/mL 0 0 a V(0.010mol/L KMnO4溶液)/mL T/℃ 乙 2.0 2.0 1.0 ① ② ③ 4.0 4.0 4.0 50 25 25 t/min 0 20 40 60 80 120 第 一 次 试 验 x(HI) 1 0.90 0.85 0.815 0.795 0.784 第 二 次 试 验 x(HI) 0 0.60 0.73 0.773 0.780 0.784 2- (3)第②步中,还原0.01mol Cr2O7 离子,需要 mol 的FeSO4·7H2O. (4)已知Cr(OH)3 在溶液中存在以下平衡:H++CrO2 -+H2O Cr(OH)3 Cr3++3OH- 下列有关说法中正确的是 a.加HCl则平衡均向右移动,则生成Cr3+盐 b.按照物质分类Cr(OH)3是两性氢氧化物,属于弱电解质 c.Cr3+盐中逐滴加入NaOH溶液,先产生沉淀,后沉淀消失 + - d.Cr(OH)3饱和溶液中一定有c(H )=c(OH ) 25. (12分)I已知,CO 的毒性表现在CO 与血红蛋白(Hb)结合成Hb·CO,使血红蛋白 失 去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2 O2+Hb·CO,已知在人 体体温37℃下,该平衡常数为220。试回答: (1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以 说 明: (2)抽烟时,进入肺部的空气中c(CO)=10-6mol/L,c(O )=10-2mol/L,则c(Hb·CO) 为c(Hb·O2)的 倍。 (3)已知当血液中cHbCO的比值大于 0.02 时,人的智力会很快受到损伤,为避免 cHbO2 人的智力受到损伤,c(O2)与c(CO)的比值应大于 。 II 在某一温度条件下, Bodensteins 研究了反应:2HI(g) H2(g) +I2(g),气体 混合物中HI 的物质的量分数x(HI)与反应时间t 的关系如下表: (4)根据上述实验结果,该反应的平衡常数K 的计算式为 。 (5)上述反应,正反应速率为v 正=k 正x2(HI),逆反应速率为v 逆=k 逆x(H2)x(I2),其中k 正、 -1 k 逆为速率常数,则k 逆为 (以 K 和 k 正 表示)。若 k 正 =0.002 min ,第一次试验时, -1 当t=20 min,v 正= min 。 三、填空题 21. (6分) 第II卷 (1) (1分); (1分)。 (2) 。 (3) 。 22.(14分) (1) 。 ; (2) 。 (3) , ; (4) 。 (5) 。 23. (18 分) (1) , ; 。 (2) 。 (3) 。 (4) ; (5) _ _ _ _ _ _ _ _ ; (6) _ 。 。 24. (10分) (1) (1 分); 。 (2) ; (1 分)。 (3) 。 (4) ; 25. (12分) (1) (2) 。 (3) 。 (4) 。 (5) 。 。 成都石室中学高 2018 届 2016~2017 学年 度上期半期考试 化学答案 1-5ADDAD 6-10CBABB 11-15 CABCB 16-20BD C AB B AD 21.(1)化学 M(2 分) (2)>(2 分) (3)-821.5KJ/mol (2 分) - + 22(1) H2CO3 HCO3 +H (2)e查看更多
相关文章
- 当前文档收益归属上传用户